卡培他滨联合顺铂治疗晚期转移性三阴乳腺癌46例
2013-10-31薛海鸥岳莉
★ 薛海鸥 岳莉
(辽宁医学院附属第一医院肿瘤科 锦州 121001)
卡培他滨联合顺铂治疗晚期转移性三阴乳腺癌46例
★ 薛海鸥*岳莉
(辽宁医学院附属第一医院肿瘤科 锦州 121001)
目的:回顾性分析卡培他滨联合顺铂治疗蒽环类及紫杉类耐药的转移性三阴乳腺癌的疗效及不良反应。方法:转移性三阴乳腺浸润性导管癌患者86例,A组46例采用卡培他滨联合顺铂,B组40例采用卡培他滨,3周重复,至少接受2个周期化疗,并评价2组治疗有效率、毒副作用和远期生存情况。结果:A组总有效率(CR+PR)为43.48%(20/46),B组22.50%(9/40),2组比较差异有统计学意义(P<0.05)。不良反应中A组胃肠道毒性和骨髓抑制发生率高于B组,差异有统计学意义(P<0.05)。A组1、2、3年生存率分别为69.57%、50.00%、26.26%;B组1、2、3年生存率分别为47.50%、23.91%、10.00%,2组远期生存的比较,A组生存率高于B组,差异有统计学意义(P>0.05)。结论:卡培他滨联合顺铂治疗蒽环类及紫杉类耐药转移性三阴乳腺癌有较好的疗效,尽管不良反应发生率较高,但毒副作用可耐受,值得临床进一步研究。
三阴乳腺癌;卡培他滨;顺铂
乳腺癌是发展中国家女性最常见的恶性肿瘤之一,尽管预后相对较好,但是三阴乳腺癌(triple-negative breast cancer,TNBC)是该疾病中导致治疗失败和死亡的主要原因。雌激素受体(ER)和孕激素受体(PR),表皮生长因子受体2(HER-2)的表达是鉴别乳腺癌亚型的重要因素[1],三阴性乳腺癌(TNBC)的特点是缺乏ER,PR,HER-2的表达。TNBC复发和转移的风险较高[2],并且容易对蒽环类和紫杉类药物耐药,对激素和靶向治疗也不敏感,这些药物治疗失败后没有更好的解救方案可选择,这是目前临床治疗TNBC最大的难题。本研究回顾性分析晚期TNBC患者采用卡培他滨联合顺铂治疗的疗效,可能为三阴乳腺癌的临床治疗提供一些参考。
1 资料与方法
1.1 一般资料
回顾性分析2007年12月-2013年3月在我院肿瘤内科治疗的TNBC患者。入选标准:(1)确诊为转移性晚期乳腺浸润性导管癌;(2)ER、PR和Her-2均为阴性;(3)女性,年龄35-60岁;(4)无严重的肝肾功能及骨髓功能异常;(5)KPS评分超过70分,无化疗禁忌,预期生存期超过4个月;(6)既往蒽环类和紫杉类治疗失败。
1.2 治疗方法
A组采用卡培他滨2 500mg/m2·d连用2周,休息1周,顺铂25mg/m2,第1-3d静脉滴注,B组单独使用卡培他滨,3周为一个周期。每2周期进行疗效评价,如果化疗期间白细胞低于3.0×109/L则给予粒细胞集落刺激因子支持治疗,血小板低于80×109/L给予IL-11治疗,A组正规水化、利尿和止吐治疗。
1.3 疗效评价
疗效参考RECIST实体瘤疗效标准进行评价,分为完全缓解CR,部分缓解PR,稳定SD,进展PD,有效RR=CR+PR。每2周期评价疗效,每周期进行毒副作用评价,治疗期间死亡或者更改方案者退出实验。
1.4 随访
所有患者随访至2013年3月,无进展生存(PFS),为治疗之间至肿瘤进展或任何原因导致的死亡,最后随访时间总生存为治疗之间至该病导致的死亡。
1.5 统计学方法
采用SPSS17.0统计软件进行分析,生存期采用kaplan-meier法,有效率和不良反应发生率的比较采用卡方检验,P<0.05差异有统计学意义。
2 结果
2.1 近期化疗效果
A组CR为0%(0/46),PR为43.48%(20/46),SD为41.30%(19/46),PD为15.22%(7/46),总有效率(CR+PR)为43.48%(20/46);B组CR为0%(0/40),PR为22.50%(9/40),SD为40.00%(16/40),PD为37.50%(15/40),总有效率(CR+PR)为22.50%(9/40),两组比较差异统计学意义(χ2=4.02,P<0.05)。
2.2 毒副作用评价
2组患者化疗期间毒副作用均可耐受,全部病例无化疗相关死亡。2组不良反应的比较(见表1),A组白细胞减少及恶心呕吐发生率高于B组,差异有统计学意义(P<0.05)。
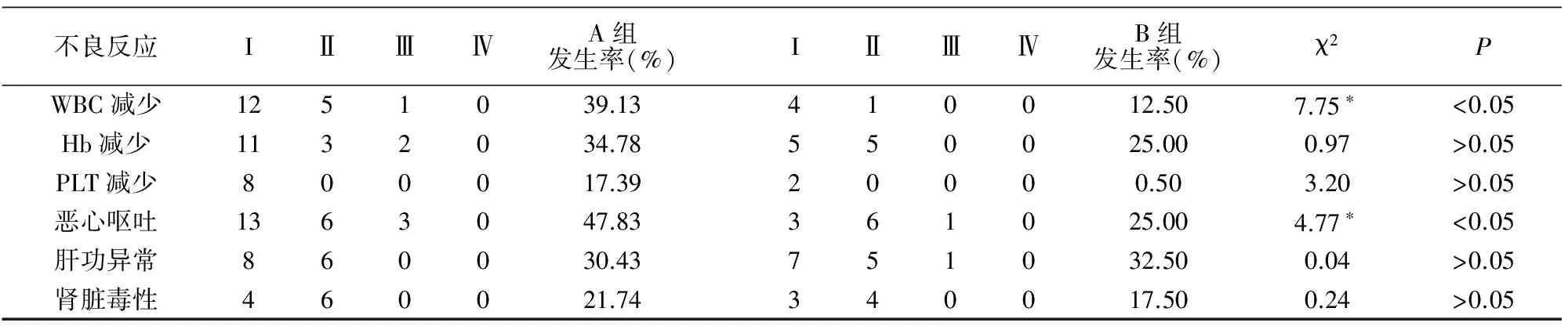
表1 2组不良反应发生率的比较 例
2.3 远期生存
所有患者随访至2013年3月,中位随访时间18(11~38)个月。A组中位PFS为5.4(3.7~10)个月,中位OS为15.2(9~39)个月,1、2、3年生存率分别为69.57%、50.00%、26.26%;B组中位PFS为4.3(2.6-8.9)个月,中位OS为12.6(8~38)个月,1、2、3年生存率分别为47.50%、23.91%、10.00%。2组远期生存的比较,A组生存率高于B组,差异有统计学意义(P>0.05)。
3 讨论
尽管多数早期乳腺癌是可以治愈的,但是由于发现较晚或不规范的治疗导致转移和复发,这也成了乳腺癌的主要死亡原因[3]。放疗在一定程度上能控制疾病的转移和复发,化疗可以提高患者生存率,特别是紫杉醇和蒽环类药物化疗效果都令人兴奋,但是耐药问题也十分棘手[4],并且化疗药只能对生长期的肿瘤产生作用,但对静止期的肿瘤细胞作用甚微[5],所以经过多个疗程的放疗和化疗,乳腺癌仍然可能复发和转移。三阴性乳腺癌占所有新诊断乳腺癌患者约11%-20%[6],与其他亚型乳腺癌相比,TNBC患者缺乏激素治疗和靶向治疗的抗体表型,进展迅速,预后较差[7,8]。这可能是因为在某些情况下,特定的非规范的治疗产生的分子变化可能导致临床耐药,因此,对TNBC提出有效的治疗策略,是乳腺癌发展作为一个重大的挑战[9]。以往的报道显示,由于鉴定和治疗的迫切需要,寻求与TNBC相关的生物标志物,包括Ki-67,血管内皮生长因子(VEGF)和表皮生长因子受体(EGFR)等[10-12]都可能是潜在的治疗靶点,但是却发现疗效甚微。
新药开发固然重要,但通过优化使用现有药物的患者可能更会受益。许多抗癌药物允许使用的两个或更多药物的联合,从而达到治疗的协同作用。但许多临床试验已经尝试使用最大耐受剂量方案,但重叠毒性导致生活质量下降。有研究发现[13]多西他赛和卡培他滨治疗蒽环类治疗失败的乳腺癌患者,比单药多西他赛有显着的整体生存优势,所有可评估患者的无病进展时间中位数为3.6个月,所有患者的中位总生存期为9.8个月。但是这种生存优势,是以毒性的急剧增加和药剂量的减少为前提的[14],多西他赛的严重骨髓抑制导致患者生活质量受到影响。
铂类是新一代的抗肿瘤药,常应用于多种实体瘤,尤其在头颈部和肺鳞癌中疗效显著,它的主要作用机制是与DNA结合,抑制DNA的复制。不少学者提出[9],TNBC由于缺乏DNA损伤修复机制,可能对烷化剂或者铂类较为敏感。一些研究者采用以铂类为基础的化疗,在TNBC组表现出显著的短期疗效,但与非TNBC的新辅助化疗相比,对晚期乳腺癌患者的远期生存没有任何优势[15]。铂类药物治疗三阴乳腺癌可能提高疗效,一项研究报告[16],分别用4个周期的顺铂为基础的新辅助化疗,TNBC达到临床完全缓解(CCR)或部分缓解(PR)为64%。另一项研究[17]使用顺铂,阿霉素和多西紫杉醇每周给药一次的化疗方案,74例初治三阴乳腺癌患者中,有46例有效并且总的5年无病生存率(DFS)率为76%。尽管采用铂类治疗TNBC组CCR率可能高于非TNBC组,TNBC患者的疾病进展风险降低47%[18],然而三阴乳腺癌患者远期疗效较差,容易复发[19]。虽然许多临床研究已经证明铂类治疗三阴乳腺癌具有优越性,但是仍然需要加大样本量,以提供更高质量的和长期生存的临床证据。
本组均为蒽环类或紫杉类治疗失败的晚期三阴乳腺癌患者,采用卡培他滨联合顺铂方案化疗有效率仍可达到43.48%。卡培他滨联合顺铂组白细胞减少和恶心呕吐发生率高于单药卡培他滨组,差异有统计学意义(P<0.05)。通过随访发现,卡培他滨联合顺铂的生存率高于单药卡培他滨组,差异有统计学意义(P<0.05)。以往的研究显示[17],虽然TNBC对化疗较为敏感,但远期预后较差,TNBC组表现出较高的远期复发率,较短的无病生存率和较低的总生存率。铂类治疗TNBC患者能延长生存时间[20],比其他药物治疗具有一定的优势,但与非TNBC患者相比预后仍然不理想。
综上所述,卡培他滨联合顺铂治疗转移性三阴乳腺癌疗效较好,尽管不良反应发生率较单药组高,但毒性作用可耐受,是蒽环类和紫杉类耐药后较好的解救方案。但对改善转移性三阴乳腺癌的长期生存作用仍然有限,有待于寻求新的方法以提高疗效。
[1]de Ruijter TC, Veeck J, de Hoon JP, et al. Characteristics of triple-negative breast cancer. J Cancer Res Clin Oncol[J]. 2011, 137(2):183-192.
[2]Dent R, Trudeau M, Pritchard KI, et al. Triple-negative breast cancer: clinical features and patterns of recurrence. Clin Cancer Res[J]. 2007, 13(15 Pt 1):4 429-4 434.
[3]Wishart GC, Chetty U. Introduction to sessions on guidelines and endocrine therapy, the influence of breast screening on number of mastectomies and the challenge between molecular science and traditional dogma in the treatment of breast cancer. Introduction to Session 6. Breast Cancer Res[J]. 2009, 11 Suppl 3:S17.
[4]Yamazaki R, Nishiyama Y, Furuta T, et al. Novel acrylonitrile derivatives, YHO-13177 and YHO-13351, reverse BCRP/ABCG2-mediated drug resistance in vitro and in vivo. Mol Cancer Ther[J]. 2011, 10(7):1 252-1 263.
[5]Kucukzeybek Y, Gorumlu G, Cengiz E, et al. Apoptosis-mediated cytotoxic effects of ibandronic acid on hormone- and drug-refractory prostate cancer cells and human breast cancer cells. J Int Med Res[J]. 2010, 38(5):1 663-1 672.
[6]Ismail-Khan R, Bui MM. A review of triple-negative breast cancer. Cancer Control[J]. 2010, 17(3):173-176.
[7]Millikan RC, Newman B, Tse CK, et al. Epidemiology of basal-like breast cancer. Breast Cancer Res Treat[J]. 2008, 109(1):123-139.
[8]Krishnamurthy S, Poornima R, Challa VR, et al. Triple negative breast cancer - our experience and review. Indian J Surg Oncol[J]. 2012, 3(1):12-16.
[9]Schneider BP, Winer EP, Foulkes WD, et al. Triple-negative breast cancer: risk factors to potential targets. Clin Cancer Res[J]. 2008, 14(24):8 010-8 018.
[10]Keam B, Im SA, Lee KH, et al. Ki-67 can be used for further classification of triple negative breast cancer into two subtypes with different response and prognosis. Breast Cancer Res[J]. 2011, 13(2):R22.
[11]Linderholm BK, Hellborg H, Johansson U, et al. Significantly higher levels of vascular endothelial growth factor (VEGF) and shorter survival times for patients with primary operable triple-negative breast cancer. Ann Oncol[J]. 2009, 20(10):1 639-1 646.
[12]Millar EK, Graham PH, O'Toole SA, et al. Prediction of local recurrence, distant metastases, and death after breast-conserving therapy in early-stage invasive breast cancer using a five-biomarker panel. J Clin Oncol[J]. 2009, 27(28):4 701-4 708.
[13]Young SD, Lafrenie RM, Clemons MJ. Phase ii trial of a metronomic schedule of docetaxel and capecitabine with concurrent cele-coxib in patients with prior anthracycline exposure for metastatic breast cancer. Curr Oncol[J]. 2012, 19(2):e75-83.
[14]O'Shaughnessy J, Miles D, Vukelja S, et al. Superior survival with capecitabine plus docetaxel combination therapy in anthracycline-pretreated patients with advanced breast cancer: phase III trial results. J Clin Oncol[J]. 2002, 20(12):2 812-2 823.
[15]Liu M, Mo QG, Wei CY, et al. Platinum-based chemotherapy in triple-negative breast cancer: A meta-analysis. Oncol Lett[J]. 2013, 5(3):983-991.
[16]Silver DP, Richardson AL, Eklund AC, et al. Efficacy of neoadjuvant Cisplatin in triple-negative breast cancer. J Clin Oncol[J]. 2010, 28(7):1 145-1 153.
[17]Frasci G, D'Aiuto G, Comella P, et al. Preoperative weekly cisplatin, epirubicin, and paclitaxel (PET) improves prognosis in locally advanced breast cancer patients: an update of the Southern Italy Cooperative Oncology Group (SICOG) randomised trial 9908. Ann Oncol[J]. 2010, 21(4):707-716.
[18]Koshy N, Quispe D, Shi R, et al. Cisplatin-gemcitabine therapy in metastatic breast cancer: Improved outcome in triple negative breast cancer patients compared to non-triple negative patients. Breast[J]. 2010, 19(3):246-248.
[19]Miyagi Y, Kawanishi K, Yamada S, et al. Cytocidal effect and DNA damage of nedaplatin: a mathematical model and analysis of experimental data. Cancer Chemother Pharmacol[J]. 2001, 47(3):229-235.
[20]Chang HR, Glaspy J, Allison MA, et al. Differential response of triple-negative breast cancer to a docetaxel and carboplatin-based neoadjuvant treatment. Cancer[J]. 2010, 116(18):4 227-4 237.
46CasesofAdvancedStageTransitivityTriple-negativeBreastCancerCuredwithCapecitabineandCisplatin
XUEHai-ou,YUELi
ThefirstaffiliatedhosptalofLiaoningMedcineUniversity,Jinzhou121001
Objective: A retrospective analysis of capecitabine and cisplatin treatment of anthracycline and taxane-resistant metastatic triple-negative breast cancer efficacy and adverse reactions. Methods: metastatic triple-negative breast invasive ductal carcinoma 86 cases, A group of 46 patients using capecitabine plus cisplatin, B group, 40 cases were treated with capecitabine, three weeks repeat,
at least two cycles of chemotherapy, and were evaluated treatment effectiveness, side effects and long-term survival. Results: A total effective rate (CR + PR) was 43.48% (20/46), B group 22.50% (9/40), the difference was statistically significant (P<0.05). A group of adverse reactions in gastrointestinal toxicity and bone marrow suppression was higher than in group B, the difference was statistically significant (P<0.05). A group of 3-year survival rates were 69.57%, 50.00%, 26.26%; B group and 3-year survival rates were 47.50%, 23.91%, 10.00%, compared two groups of long-term survival, A group of survival than in group B, the difference was statistically significant (P> 0.05). Conclusion: capecitabine plus cisplatin treatment of anthracycline and taxane-resistant metastatic TNBC has a good effect, despite a higher incidence of adverse reactions, but the side effects can be tolerated and is worthy of further study .
Triple-negative Breast Cancer; Capecitabine; Cisplatin
薛海鸥,女,副主任医师,E-mail:xuehaiou333@163.com。
R 737.9
B
2013-06-18)
