恶性胸水中醛缩酶A的水平及其对人肺腺癌细胞增殖、迁移与侵袭能力的影响*
2013-10-24冯小鹏孙珍贵汪向海陈兴无
冯小鹏, 孙珍贵, 汪向海, 邢 敏, 陈兴无
(皖南医学院弋矶山医院呼吸内科,安徽 芜湖 241001)
恶性胸水中醛缩酶A的水平及其对人肺腺癌细胞增殖、迁移与侵袭能力的影响*
冯小鹏#, 孙珍贵, 汪向海, 邢 敏, 陈兴无△
(皖南医学院弋矶山医院呼吸内科,安徽 芜湖 241001)
目的比较肺癌患者伴恶性胸水(MPE)和结核性胸膜炎患者胸水(TBPE)中醛缩酶A(ALDOA)的表达水平及其与癌胚抗原(CEA)和乳酸脱氢酶(LDH)的相关性,探讨ALDOA对肺腺癌A549细胞增殖、迁移及侵袭的影响。方法ELISA和化学发光法检测65例MPE和35例TBPE中ALDOA、CEA和LDH水平;以不同浓度的ALDOA作用于A549细胞,分别采用MTT 法、划痕及体外侵袭实验研究ALDOA对A549细胞增殖、迁移和侵袭的影响。结果MPE中ALDOA浓度[(46.8±21.4) μg/L]明显高于TBPE[(23.9±17.2) μg/L](P<0.01),其中腺癌[(71.7±32.1) μg/L]明显高于鳞癌[(21.3±14.6) μg/L](P<0.05);MPE中CEA和LDH水平[(82.2±56.6) μg/L和(755.8±382.5) U/L]也明显高于TBPE[(12.6±9.7)μg/L和(388.4±163.9) U/L](P<0.01)。2组患者胸水中ALDOA与CEA和LDH均呈正相关关系(P<0.01或P<0.05)。不同浓度ALDOA刺激A549细胞后,细胞增殖增强且迁移、侵袭加快,并呈浓度依赖性。结论肺癌患者MPE中ALDOA表达水平明显高于TBPE中的水平,其中肺腺癌胸水ALDOA水平明显高于鳞癌;ALDOA与CEA和LDH水平高度正相关;ALDOA浓度依赖性地增强肺腺癌A549细胞增殖、迁移和侵袭。
醛缩酶A; 胸水; 肺肿瘤; 细胞增殖; 细胞迁移; 肿瘤侵袭
肺癌是全球最常见的恶性肿瘤及死亡的首要原因,非小细胞肺癌(non-small-cell lung cancer,NSCLC)是最常见的类型[1],尤其肺腺癌的发病率迅速增加,占全部肺癌的40%左右[2]。尽管诊断、治疗取得较大进展,NSCLC长期生存率仍不能令人满意,5年存活率低于15%[3]。早期蔓延或转移是其5年生存率低的主要原因[4]。转移到胸膜形成恶性胸水(malignant pleural effusion,MPE)是一种常见的并发症[5],部分患者甚至是就诊的首发表现。显微镜下,可见胸膜表面有众多的肿瘤浸润病灶,表明癌细胞具高度侵袭性,但癌细胞进入胸膜腔以及促进胸膜转移灶蔓延的机制仍有待进一步探讨。
癌细胞侵袭和转移的重要标志是持续性增殖和运动性增强,许多介质发挥了重要作用。细胞周围微环境营养缺乏、pH变化和氧合不足诱导代谢和增殖状态的改变,有利于癌细胞在转移部位的生存。MPE提供癌症细胞生存的微环境和有关介质,可促进癌细胞在胸膜腔的生长和迁移[6]。
缺氧是实体肿瘤组织内广泛存在的现象,此时癌细胞氧利用率高,糖酵解增强。醛缩酶A(果糖1,6-二磷酸醛缩酶,fructose 1,6-bisphosphate aldolase A, ALDOA)是糖酵解过程的关键酶之一,催化果糖-1,6-二磷酸裂解为3-磷酸甘油醛和磷酸二羟丙酮。已证明该酶在肺癌和肺癌MPE中[7-8]高表达,并且可通过某些生长因子如表皮生长因子结合于细胞骨架,促进细胞迁移、加快损伤修复[9]。
我们推测肺癌患者MPE中ALDOA水平升高,可能增进癌细胞增殖、迁移与侵袭。本研究观察肺癌(包括腺癌和鳞癌)MPE和结核性胸水(tuberculous pleurisy,TBPE)中ALDOA水平差异,比较ALDOA与诊断MPE有较高特异性的2种肿瘤标志物[癌胚抗原(carcinoembryonic antigen, CEA)和乳酸脱氢酶(lactate dehydrogenase, LDH)]的相关性;通过MTT、划痕和Transwell小室实验,观察ALDOA对人肺腺癌细胞株A549增殖、迁移和侵袭的影响,旨在探讨ALDOA在肺腺癌细胞转移、侵袭及MPE形成中的作用。
材 料 和 方 法
1研究对象
选择皖南医学院弋矶山医院呼吸内科2010年7月~2011年6月间确诊为肺癌合并胸水的住院患者(MPE组)65例[男27,女38例,平均年龄(57.8±15.3)岁]和结核性胸水患者(TBPE组)35例[男20、女15例,平均年龄(49.9±13.6)岁]。所有患者签知情同意书。MPE诊断标准:(1)患者影像学显示原发性支气管肺癌合并MPE;(2)胸腔积液中找到肺癌细胞和(或)胸膜活检标本病理学确诊为转移性肺癌。TBPE诊断标准:胸水为渗出液,腺苷脱氨酶>40 U/L,胸膜活检示结核性肉芽肿[10]。
2胸水采集和存储
收集患者入院后首次胸腔穿刺抽取的胸水20 mL,经3 000 r/min离心分离,留取上清等份分装于离心管、-20 ℃冻存备用。
3胸水上清ALDOA浓度测定
ELISA法测定ALDOA浓度,操作步骤参照试剂盒(上海豪森生物有限公司)说明书进行。检测灵敏度下限为23.5 ng/L。
4LDH和CEA水平测定
应用全自动生化仪、电化学发光免疫分析技术定量检测LDH和CEA,操作按照仪器和试剂(拜耳集团诊断部)说明书进行。
5细胞株及主要试剂
人肺腺癌细胞株A549由中国科技大学中心实验室惠赠,RPMI-1640培养基、胰蛋白酶(Gibco), 胎牛血清(杭州四季清公司),ALDOA(ProSpec),MTT试剂(Sigma),Transwell小室(Corning),Matrigel凝胶(北京威格拉斯生物技术有限公司)。
6A549细胞培养
A549细胞常规培养于含10%胎牛血清、1×105U/L青霉素以及100 mg/L链霉素的RPMI-1640培养基中,于37 ℃、5%CO2孵箱中培养。取对数生长期细胞,胰酶消化后进行细胞传代,分别根据实验需要种于不同的培养板(皿)中。
7细胞增殖实验
将A549细胞以1×108/L接种于96孔培养板, 培养24 h后,加入含不同浓度ALDOA(0、5、25、50 μg/L)的无血清培养液作用24 h。然后每孔加入10 μL MTT(5 g/L),继续培养4 h。终止反应后弃上清液,每孔加入100 μL DMSO, 振荡10 min, 至蓝色结晶完全溶解,于全自动酶标仪570 nm处测定吸光度(A)。每组设3个复孔,实验重复3次。
8细胞划痕实验
l×108/L A549细胞接种于24孔培养板,完全融合后,无血清培养液继续培养24 h。用10 μL加样枪枪头尖端在细胞板上划痕,PBS漂洗2次,每孔加入400 μL含不同浓度ALDOA(5、25、50 μg/L)的无血清培养液,分别于0 h、24 h在倒置相差显微镜下观察、拍照,每条划痕随机取3处用NIH Image图像分析软件(ImageJ)测量划痕宽度,取平均值计算其迁移距离,迁移距离(μm)=0 h的划痕宽度-24 h的划痕宽度。
9Transwell小室迁移实验
采用Transwell小室法,将生长良好的A549细胞重悬于无血清培养液,取l×108/L细胞悬液200 μL接种于Transwell上室,下室加入500 μL含ALDOA(0、5、25、50 μg/L)的无血清培养液,培养24 h。取
出Transwell小室,弃培养液,甲醇固定20 min,将小室适当风干,0.1%结晶紫染色20 min;自来水洗3遍,棉签擦尽上室面细胞,光学显微镜下随机选取3个视野,计数小室下室面的细胞数,每组设3个复孔,取平均值。
10细胞侵袭实验
实验方法与9类似,但侵袭小室上室面滤膜用5 g/L Matrigel 100 μL覆盖,风干后用于实验。
11统计学处理
数据以均值±标准差(mean±SD)表示,采用SPSS 13.0进行统计学分析,两组间均数比较采用独立样本t检验,双变量相关分析采用Pearson相关性分析。以P<0.05为差异有统计学意义。
结 果
1两组患者胸水中ALDOA、CEA和LDH水平
肺癌MPE组和TBPE组胸水中ALDOA浓度分别为(46.8±21.4)μg/L和(23.9±17.2)μg/L,MPE组明显高于TBPE组(P<0.01)。CEA浓度分别为(82.2±56.6)μg/L和(12.6±9.7)μg/L;LDH浓度分别为(755.8±382.5)U/L和(388.4±163.9)U/L;MPE组均明显高于TBPE组(P<0.01),见图1。

Figure 1. Comparison of ALDOA (A),CEA (B) and LDH (C) levels in malignant pleural effusion (MPE) and tuberculous pleural effusion (TBPE).Mean±SD.n=3.**P<0.01vsTBPE.
图1两组患者胸水中ALDOA、CEA和LDH水平的比较
2肺腺癌和鳞癌MPE中ALDOA水平
肺腺癌和鳞癌患者MPE中ALDOA浓度分别为:(71.7±32.1)μg/L和(21.3±14.6)μg/L,腺癌组明显高于鳞癌组(P<0.05),见图2。

Figure 2. Comparison of ALDOA in MPE from adenocarcinoma and squamous-cell carcinoma patients.Mean±SD.n=3.*P<0.05vssquamous-cell carcinoma.
图2肺腺癌和鳞癌患者MPE中ALDOA水平的比较
3MPE和TBPE中ALDOA与CEA和LDH的相关性
MPE中ALDOA与CEA和LDH显著正相关(r=0.8672,P<0.01;r=0.4963,P<0.05),TBPE中ALDOA与CEA和LDH也分别呈现正相关关系(r=0.6783,P<0.01;r=0.4676,P<0.05)。
4ALDOA对A549细胞增殖的影响
MTT 实验表明,低浓度ALDOA(5 μg/L)对A549细胞增殖无明显影响(P>0.05),但25和50 μg/L ALDOA明显促进A549细胞增殖(P<0.05),见图3。
5ALDOA对A549细胞迁移的影响
细胞划痕后经不同浓度ALDOA刺激24 h,细胞迁移距离分别为(17.3±5.2)μm、(44.8±12.7)μm和(73.3±14.6)μm;与对照组[(13.00±4.95)μm]比较,低浓度ALDOA(5 μg/L)对A549细胞迁移无明显影响(P>0.05),但25和50 μg/L ALDOA组细胞迁移距离明显增加(P<0.05),见图4。

Figure 3. Effect of ALDOA on A549 cell proliferation.Mean±SD.n=3.*P<0.05vs0 μg/L.
图3ALDOA对A549细胞增殖的影响
利用Transwell小室迁移实验,发现ALDOA组穿透的细胞增多,并且浓度越大穿透的细胞越多。镜下计数显示,ALDOA组细胞穿过Transwell小室数分别为20.0±4.8、58.0±7.3和107.0±15.6;与对照组(11.0±1.5)相比,低浓度ALDOA(5 μg/L)对A549细胞迁移无明显影响(P>0.05),另2种浓度ALDOA组细胞穿过Transwell小室的细胞数均明显增加(P<0.05),而且浓度越高穿过Transwell小室的细胞数越多,见图5。

Figure 4. Effect of ALDOA on A549 cell migration(×200). A:control;B:ALDOA (5 μg/L);C:ALDOA (25 μg/L); D:ALDOA (50 μg/L).
图4ALDOA对A549细胞迁移的影响
6ALDOA对A549细胞侵袭的影响
ALDOA作用于A549细胞,24 h后光镜下计数穿过Transwell聚碳酸酯膜的细胞数分别为76.6±13.9、101.1±11.9和127.4±14.6,对照组为67.3±14.3;与对照组比较,ALDOA组细胞侵袭数增多;而50 μg/L组细胞侵袭数明显多于5 μg/L和25 μg/L组(P<0.05),见图6。
讨 论
异常生长和转移被视为癌细胞重要的生物学特性,几个步骤调节转移的发生(局部浸润、进入血管、外渗、启动、肿瘤微转移灶形成、血管发生),其中癌细胞浸润是最重要和特征性步骤,而癌细胞浸润过程中细胞的迁移和侵袭起着至关重要作用[11]。阐明细胞运动、迁移和侵袭的分子机制对了解肺癌及MPE的发展非常重要。癌细胞直接侵袭胸膜组织蔓延并持续增殖和胸膜通透性增强可能是MPE发生的最主要机制。
越来越多的研究表明肿瘤微环境对肿瘤恶性进展的临床意义[6]。MPE含有多种源于炎症、上皮细胞和癌细胞释放的血浆滤出蛋白,提供癌细胞生长、侵袭和脉管播散的微环境和有关介质。迄今, 一些生物标志物如CEA、LDH等已应用于胸腔积液的病因分析。这些介质也可能特异维持癌细胞在胸膜腔生存和侵袭,用作研究胸水形成机制的工具。
癌细胞增殖和侵袭需有足够的能量供应,代谢重编程有益于癌细胞生存[12]。癌细胞糖酵解作用增强,醛缩酶在其中起重要作用,通过裂解己糖磷酸果糖1,6-二磷酸C3和C4键,催化磷酸果糖1,6-二磷酸转换为3-磷酸甘油醛和磷酸二羟丙酮,进而影响肿瘤细胞糖代谢和细胞增殖。恶性肿瘤患者血清中醛缩酶升高,尤以同工酶ALDOA最突出。已证明ALDOA与人类许多疾病如肿瘤包括肺癌[7]、肝癌、自身免疫性疾病的发生发展有重要关系。癌组织ALDOA浓度明显高于癌旁组织,其浓度的高低对患者化疗药物选择、治疗效果及预后均有指导意义。肺癌患者血清ALDOA与其自体抗体蛋白水平升高,其上调的机制尚不清楚。Lin等[8]发现ALDOA等糖代谢酶异常还与MPE形成有关,免疫组化和免疫荧光分析MPE和胸膜转移病灶发现肿瘤细胞特异性表达ALDOA。

Figure 5. Effect of ALDOA on A549 cell migration detected by Transwell assay(×200). A:control;B:ALDOA (5 μg/L);C:ALDOA (25 μg/L); D:ALDOA (50 μg/L).Mean±SD.n=3.*P<0.05vsA.
图5Transwell小室检测ALDOA对细胞迁移的影响
本研究中,我们发现ALDOA在MPE中的浓度明显高于结核性胸水,而且以肺腺癌胸水升高最明显;提示MPE特别是肺腺癌相关的MPE存在能量供给和利用异常,而且ALDOA还可能与MPE形成有关。MPE患者胸水中ALDOA水平上调可能与缺氧诱导因子1α[13]和肿瘤坏死因子α诱导表达有关。这种糖代谢异常不仅对肿瘤发生,而且对MPE中癌细胞胸膜侵袭、增殖和血管内皮生长因子分泌均十分重要[8]。
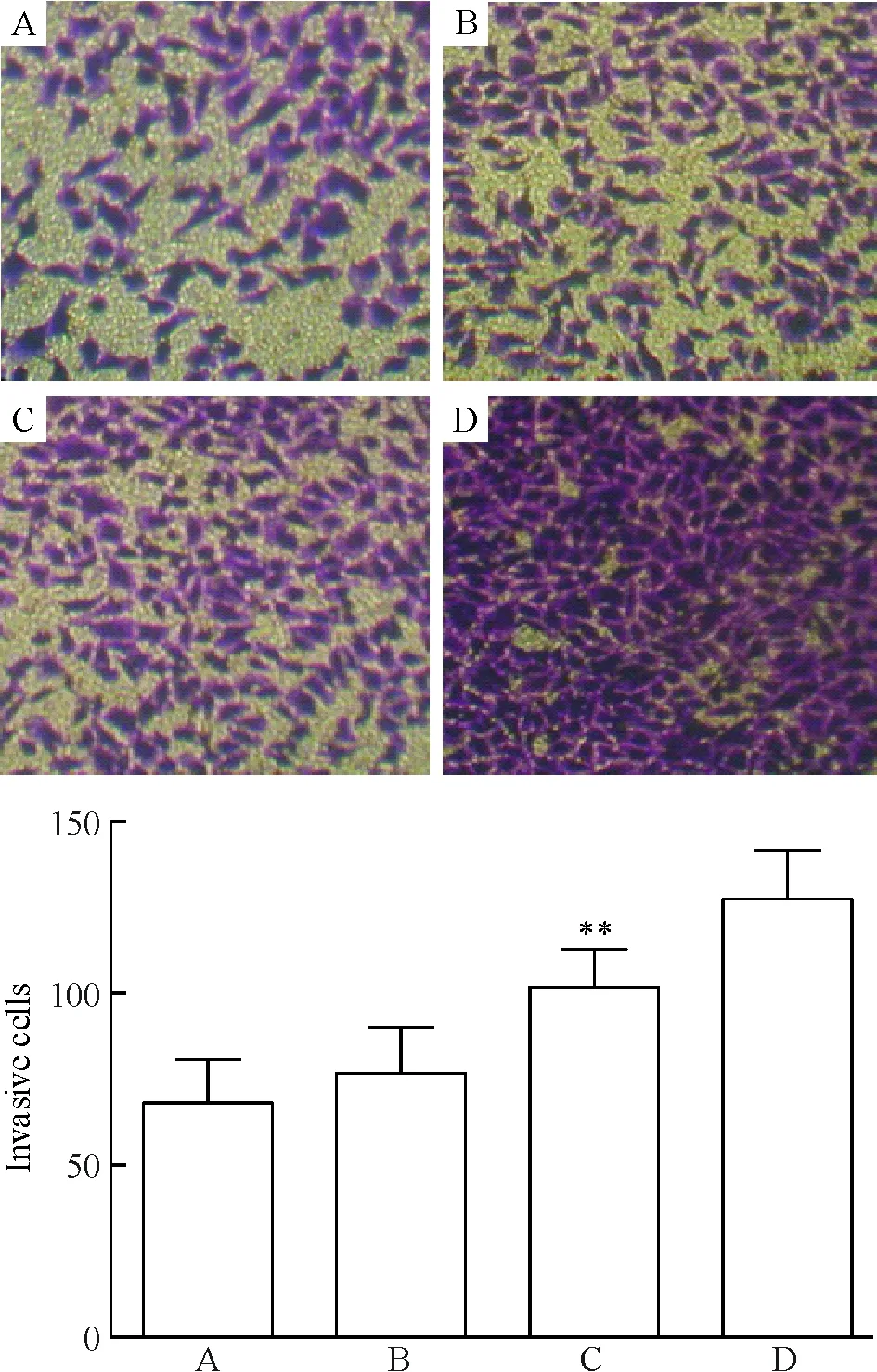
Figure 6. Effect of ALDOA on A549 cell invasion(×200). A:control;B:ALDOA (5 μg/L);C:ALDOA (25 μg/L); D:ALDOA (50 μg/L).Mean±SD.n=3.**P<0.01vsA.
图6ALDOA对A549细胞侵袭的影响
CEA是最特异性的癌胚蛋白之一,反映肿瘤的存在,其mRNA水平也被用于检测微播散或微转移(灶)。胸水CEA是MPE的一个有用诊断工具,也有助于鉴别恶性胸膜间皮瘤和转移性肺癌[14];而且是不能由细胞检测的胸膜亚临床微转移的一个有用指标[15]。MPE中CEA水平升高可能与癌细胞阻塞淋巴管及胸膜浸润、CEA产生后不易进入血循环,在胸腔内积聚有关。本实验观察到MPE较结核性胸水CEA水平升高,并且以肺腺癌MPE中浓度最高;相关性分析表明胸水CEA与ALDOA高度相关。MPE中癌细胞CEA基因表达激活,可促进细胞黏附、抑制细胞死亡、介导信号转导及激发肿瘤免疫,因此CEA在MPE癌细胞生长、迁移和侵袭过程中可能有重要作用。MPE中CEA与ALDOA的共同上升趋势提示两者在MPE发生过程中可能有协同作用,两者是否存在共同的生成诱导因子或具有促进关系则不甚清楚。LDH也是一种糖酵解酶,为NAD+的中间产物;人胸膜间皮细胞和巨噬细胞具有强阳性LDH细胞化学反应。癌组织中无氧酵解增强,促使糖酵解关键酶LDH升高。本研究中,我们观察到MPE和中LDH与ALDOA也呈正相关关系,可能与这两种糖酵解酶有共同的生成诱导因子有关。
糖酵解酶除了影响能量生成,还对细胞某些功能有调控作用:肿瘤组织乏氧环境及糖酵解过程增强均有利于触发血管内皮生长因子生成;糖酵解的代谢产物乳酸也刺激血管生成,糖酵解率高的癌细胞呈优势生长。有研究发现ALDOA在增殖的细胞中表达上调[13],提示其与细胞增殖相关。在结肠癌,ALDOA参与细胞生长调节,刺激癌细胞扩散[16]。本研究发现ALDOA浓度依赖性地刺激A549增殖,提示ALDOA可通过调节糖酵解而影响肿瘤细胞生长增殖。
除了参与糖酵解途径与细胞生存、增殖,ALDOA可通过某些生长因子如EGF结合细胞骨架,促进细胞迁移、加快损伤修复[9]。在人角质形成细胞(HaCaT)中,ALDOA沿皱膜和伪足高表达, 与伪足一起定位于肌动蛋白细胞骨架。通过划痕实验,观察到转染ALDOA siRNA的HaCaT细胞机械划伤后伤口修复明显减慢,伪足形成细胞也减少;EGF刺激后,伤口修复区和ALDOA及其mRNA水平增加[9]。本实验应用细胞划痕实验观察ALDOA对细胞迁徙的影响,发现在ALDOA作用下A549细胞迁徙加快,且这种促进作用呈明显剂量依赖性;进一步通过Transwell小室检测ALDOA对A549细胞穿透的影响,发现ALDOA刺激的A549细胞穿过Transwell小室的细胞数较对照组明显增多,并且也呈浓度依赖性;提示ALDOA增强肺癌细胞A549迁徙及穿透并呈浓度依赖性。此外,我们发现ALDOA促进A549细胞与Matrigel胶的黏附,ALDOA刺激的A549细胞穿过聚碳酸酯膜的细胞数明显增多,并且ALDOA浓度越高,穿透的细胞越多;提示ALDOA增强肺癌细胞A549黏附及侵袭并呈浓度依赖性。
总之,受渗透压、缺氧、酸碱性等多种理化因素的影响,胸水中ALDOA、CEA和LDH表达水平增高,尤其在肺腺癌伴胸膜转移的患者中ALDOA增高明显。ALDOA促进A549细胞增殖、迁移、粘附和侵袭,提示ALDOA在肺癌特别是腺癌细胞转移、MPE形成中起着重要的作用。
[1] Archontogeorgis K, Steiropoulos P, Tzouvelekis A, et al. Lung cancer and interstitial lung diseases:a systematic review[J].Pulm Med,2012,2012:315918.
[2] Hanagiri T, Baba T, So T, et al. Time trends of surgical outcome in patients with non-small cell lung cancer[J].J Thorac Oncol,2010,5(6):825-829.
[3] Kadara H, Kabbout M, Wistuba II.Pulmonary adenocarcinoma: a renewed entity in 2011[J].Respirology,2012,17(1):50-65.
[4] Molina JR, Yang P, Cassivi SD, et al.Non-small cell lung cancer: epidemiology, risk factors, treatment, and survivorship[J].Mayo Clin Proc,2008,83(5):584-594.
[5] Heffner JE, Klein JS. Recent advances in the diagnosis and management of malignant pleural effusions[J]. Mayo Clin Proc,2008,83(2):235-250.
[6] Lorusso G, Rüegg C. The tumor microenvironment and its contribution to tumor evolution toward metastasis[J].Histochem Cell Biol,2008,130(6):1091-1103.
[7] Rho JH, Roehrl MH,Wang JY.Glycoproteomic analysis of human lung adenocarcinomas using glycoarrays and tandem mass spectrometry: differential expression and glycosylation patterns of vimentin and fetuin A isoforms[J].Protein J,2009,28(3-4):148-160.
[8] Lin CC, Chen LC, Tseng VS,et al. Malignant pleural effusion cells show aberrant glucose metabolism gene expression[J].Eur Respir J,2011,37(6):1453-1465.
[9] Tochio T, Tanaka H, Nakata S, et al. Fructose-1,6-bisphosphate aldolase A is involved in HaCaT cell migration by inducing lamellipodia formation[J].J Dermatol Sci,2010,58(2):123-129.
[10] Light RW.Update on tuberculous pleural effusion[J]. Respirology,2010,15(3):451-458.
[11] 张 洁,陈俊杰,陈成水,等.STAT1和ICAM-1在非小细胞肺癌中的表达及其临床意义[J].中国病理生理杂志,2012,28(8):1378-1382.
[12] Kroemer G, Pouyssegur J.Tumor cell metabolism: cancer’s Achilles’ heel[J]. Cancer Cell,2008,13(6):472-482.
[13] Hamaguchi T,Iizuka N, Tsunedomi R, et al. Glycolysis module activated by hypoxia-inducible factor 1α is related to the aggressive phenotype of hepatocellular carcinoma[J].Int J Oncol,2008,33(4):725-731.
[14] Shi HZ, Liang QL, Jiang J, et al. Diagnostic value of carcinoembryonic antigen in malignant pleural effusion: a meta-analysis[J]. Respirology,2008,13(4):518-527.
[15] Tomita M, Shimizu T, Matsuzaki Y, et al.Prognostic significance of carcinoembryonic antigen level in pleural lavage fluid for patients with lung adenocarcinoma[J].Ann Thorac Surg,2005,80(1):276-281.
[16] Tammali R, Ramana KV, Srivastava SK. Aldose reductase regulates TNF-α-induced PGE2 production in human colon cancer cells[J]. Cancer Lett,2007,252(2):299-306.
AldolaseAlevelinmalignantpleuraleffusionanditseffectsonproliferation,migrationandinvasionofhumanlungadenocarcinomacells
FENG Xiao-peng, SUN Zhen-gui, WANG Xiang-hai, XING Min, CHEN Xing-wu
(DepartmentofRespiratoryDisease,YijishanHospitalofWannanMedicalCollege,Wuhu241001,China.E-mail:cxw0028@126.com)
AIM: To investigate the levels of aldolase A (ALDOA), carcinoembryonic antigen (CEA) and lactate dehydrogenase (LDH) in malignant pleural effusion (MPE) from patients with lung cancer and tuberculous pleural effusion (TBPE) from patients with tuberculous pleurisy, and to explore the effects of ALDOA on the proliferation, migration and invasion of human lung adenocarcinoma A549 cells.METHODSPleural effusion samples including 65 cases of MPE and 35 cases of TBPE were collected, and the levels of ALDOA, CEA and LDH were detected by ELISA and chemiluminescence assay. After A549 cells were treated with different concentrations of ALDOA, the proliferation, migration and invasion of the cells were investigated by MTT assay, scratch test, Matrigel assay and Transwell invasion assay.RESULTSThe levels of ALDOA, CEA and LDH in MPE were (46.8±21.4) μg/L, (82.2±56.6) μg/L and (755.8±382.5) U/L, respectively, which were significantly higher than those in TBPE [(23.9±17.2) μg/L, (12.6±9.7) μg/L and (388.4±163.9) U/L, respectively;P<0.01]. The concentration of ALDOA in MPE from adenocarcinoma patients [(71.7±32.1) μg/L] was significantly higher than that in MPE from squamous-cell carcinoma patients [(21.3±14.6) μg/L,P<0.05]. The concentrations of ALDOA in MPE and TBPE were positively correlated with the concentrations of CEA and LDH (P<0.01 orP<0.05). ALDOA enhanced the proliferation, migration and invasion of A549 cells in a concentration-dependent manner.CONCLUSIONThe expression level of ALDOA in MPE is significantly higher than that in TBPE, especially in MPE from lung adenocarcinoma patients. There are highly positive correlations between ALDOA and CEA, ALDOA and LDH in pleural effusion. ALDOA concentration-dependently promotes the proliferation, migration and invasion of A549 cells.
Aldolase A; Pleural effusion; Lung neoplasms; Cell proliferation; Cell migration; Neoplasm invasiveness
R363
A
1000- 4718(2013)09- 1662- 06
2013- 04- 28
2013- 07- 09
弋矶山医院引进人才专项科研基金资助项目(No.YR201012)
△通讯作者 Tel: 0553-5739320; E-mail: cxw0028@126.com
# 现工作单位:广东省惠州市第一人民医院重症医学科
10.3969/j.issn.1000- 4718.2013.09.022
