四逆汤对同型半胱氨酸损伤的EAhy926细胞caveolin-1和eNOS表达的影响*
2013-10-24郝宝顺刘定辉宋志明余舒杰朱洁明钱孝贤吴伟康
刘 勇, 郝宝顺, 刘定辉, 宋志明, 余舒杰, 周 彬, 吴 琳, 王 敏, 朱洁明, 钱孝贤,△, 陈 璘, 吴伟康
(1中山大学附属第三医院心血管内科,广东 广州 510630; 2中山大学中西医结合研究所,广东 广州 510080)
四逆汤对同型半胱氨酸损伤的EAhy926细胞caveolin-1和eNOS表达的影响*
刘 勇1, 郝宝顺1, 刘定辉1, 宋志明1, 余舒杰1, 周 彬1, 吴 琳1, 王 敏1, 朱洁明1, 钱孝贤1,2△, 陈 璘1, 吴伟康2
(1中山大学附属第三医院心血管内科,广东 广州 510630;2中山大学中西医结合研究所,广东 广州 510080)
目的探讨四逆汤(Sini decoction,SND)防治内皮细胞损伤的机制及陷窝蛋白1(caveolin-1)和一氧化氮(NO)系统在其中的作用。方法建立同型半胱氨酸(Hcy)损伤的人脐静脉内皮融合细胞(EAhy926细胞)模型,观察四逆汤的保护作用及其对NO系统和caveolin-1的影响。结果Hcy加入后细胞生长缓慢,贴壁细胞数明显减少,NO浓度明显减低(P<0.05),caveolin-1 mRNA和蛋白表达明显增强(P<0.05),内皮型NO合酶(eNOS) mRNA和蛋白表达明显减弱(P<0.05);四逆汤处理组贴壁细胞及细胞形态明显改善,NO浓度较Hcy模型组明显升高(P<0.05),caveolin-1 mRNA和蛋白表达较Hcy模型组明显减弱(P<0.05),eNOS mRNA和蛋白表达较Hcy模型组明显增强(P<0.05),其中以四逆汤1.0 kg/L +Hcy 4.0 μmol/L组最明显。结论Hcy可能通过增加caveolin-1表达和抑制eNOS表达而损伤人脐静脉内皮细胞,而四逆汤通过抑制caveolin-1表达和增加eNOS的表达拮抗Hcy对细胞的损伤。
四逆汤; 内皮细胞; 陷窝蛋白1; 内皮型一氧化氮合酶
冠状动脉粥样硬化性心脏病是威胁人类健康的重要疾病,各种原因如增龄、高血糖和高血压都可导致内皮细胞的损伤,促进动脉粥样硬化的发生和发展,最终导致各种老年性疾病如冠状动脉粥样硬化性心脏病的发生[1]。因此,内皮细胞损伤是导致动脉粥样硬化的重要病理生理机制,如果能对此进行深入研究,寻找针对内皮细胞损伤的干预方法,将延缓动脉粥样硬化等年龄相关性疾病的发生发展,延长人们的寿命。前期研究发现,一氧化氮(nitric oxide,NO)系统和陷窝蛋白1(caveolin-1)参与了内皮细胞损伤的发病机制,而目前临床采用四逆汤(Sini decoction,SND)治疗冠状动脉粥样硬化产生了很好的疗效[1],获得一定程度的认可。四逆汤由附子、干姜、甘草三味药物组成,基础研究发现四逆汤对一氧化氮系统有调节作用。本研究旨在探讨四逆汤治疗动脉粥样硬化的可能机制及caveolin-1和一氧化氮系统在其中的作用。
材 料 和 方 法
1材料
1.1细胞 人脐静脉内皮融合细胞(EAhy926细胞),购自上海生物研究所。
1.2药物和仪器 四逆汤:附子60 g、干姜36 g、甘草24 g(购自中山大学附属第三医院药剂科),加双蒸水500 mL,浸泡30 min,水煮沸腾后改小火煎煮30 min,取上清液以12 000 r/min离心20 min,取上清以0.22 μm滤器除菌后分装,-20 ℃保存;同型半胱氨酸(homocysteine,Hcy)购自Sigma;NO试剂盒购自南京建成公司;实时荧光定量PCR反应试剂:Trizol试剂、逆转录试剂盒PrimeScriptTMRT reagent Kit和SYBR Premix Ex TaqTMKit购自宝生物工程(大连)有限公司。荧光定量PCR仪:Applied Biology 7500;Western blotting全套仪器购自天能公司。
2方法
2.1Hcy损伤模型的建立 取对数生长的EAhy926细胞按每孔1×104接种于6孔培养板中,待细胞生长至50%~60%时,换用含不同浓度同型半胱氨酸(0.5、1.0、2.0、4.0和8.0 μmol/L),继续培养24h后分别提取上清液、蛋白和RNA。
2.2四逆汤对Hcy损伤细胞的保护 取对数生长的EAhy926细胞按每孔1×104接种于6孔培养板中,待细胞生长至50%~60%时,换用含2%胎牛血清的DMEM培养基饥饿细胞8 h,加入含不同浓度四逆汤(0、1.0、0、0.5和1.0 kg/L)的DMEM培养基作用1 h,1 h后各组换用含同型半胱氨酸4.0 μmol/L培养基,继续培养24 h后分别提取上清液、蛋白和RNA。
2.3细胞培养上清液NO检测 采用硝酸还原酶法,严格按试剂盒说明书操作。
2.4实时荧光定量PCR检测 细胞内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)和caveolin-1 mRNA表达采用实时荧光定量PCR检测。
2.4.1细胞总RNA提取 总mRNA提取步骤按Trizol说明书进行,细胞培养板每孔加入1 mL Trizol以裂解细胞,吸入无酶EP管中,每管加入0.2 mL氯仿,用手剧烈振摇后室温静置5 min,4 ℃、12 000 r/min离心15 min,吸取上层水相至新的无酶EP管中,每管加入400 μL异丙醇混匀,室温静置10 min,4 ℃、12 000 r/min离心10 min,弃去上清液,每管加入1 mL 75%乙醇(99.9%乙醇∶DEPC水=3∶1)洗涤RNA沉淀;4 ℃、7 500 r/min离心5 min;弃上清,纸巾吸尽残留液,室温干燥7 min;每管加入DEPC水30 μL溶解RNA,-80 ℃保存备用。
2.4.2逆转录反应合成cDNA 按照逆转录试剂盒PrimeScriptTMRT regent Kit说明书操作,逆转录程序为 37 ℃15 min(逆转录反应)、85 ℃ 5 s(逆转录的失活反应)。
2.4.3Real-time PCR (1)引物如下:eNOS(GenBank No.NM_001165413)前向引物5’-TGG TAC ATG AGC ACT GAG ATC G-3’,逆向引物5’-CCA CGT TGA TTT CCA CTG CTG-3’;caveolin-1前向引物5’-CCT CCT CAC AGT TTT CAT CC-3’,逆向引物5’-CAA TCA CAT CTT CAA AGT CAA TC-3’;β-actin(GenBank No.NM-001101.3)前向引物5’-AGC GGG AAA TCG TGC GTG AC-3’,逆向引物5’-TCC ATG CCC AGG AAG GAA GG-3’。(2)实时荧光定量PCR反应按照荧光定量试剂盒SYBR Premix Ex TaqTMKit说明书,在ABI7500 PCR仪进行,程序如下:预变性,95 ℃ 30 s;PCR反应,先95 ℃ 5 s,后60 ℃ 31 s;(3)用β-actin校准不同组别eNOS和caveolin-1的表达,用2-[Ct(eNOS/caveolin-1)-Ct(β-actin)]表示。
2.5Western blotting检测eNOS和caveolin-1蛋白表达
2.5.1蛋白提取 预先配好蛋白提取液,按南京凯基生物有限公司全蛋白提取试剂盒说明书操作,每700 μL A试剂加入0.7 μL B试剂和0.7 μL C试剂,用PBS清洗细胞2次,分别用大、小枪头吸尽PBS液,共吸2次,按照培养孔底面积的大小加入不同体积蛋白提取液,冰上裂解数分钟,以细胞刮轻轻刮下细胞,将细胞提取液吸至预先标记的预冷EP管,冰上以摇床混匀裂解15 min; 4 ℃ 12 000 r/min离心15 min;小心吸取上清至新的EP管,为蛋白提取液,以BCA法测定蛋白浓度,分装保存于-80 ℃冰箱。
2.5.2Western blotting 各泳道蛋白上样总量为20 μg,样品蛋白经SDS-聚丙烯酰胺凝胶电泳分离,电转移至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上,放入5%脱脂奶粉封闭液室温摇床上封闭1 h,加Ⅰ抗,放入4 ℃冰箱摇床上过夜,第2天弃去Ⅰ抗,用TBST缓冲液(Tris 50 mmol/L,NaCl 100 mmol/L,pH 7.5,含1%Tween 20)摇床上清洗,加封闭液稀释的辣根过氧化物酶标记的Ⅱ抗室温摇床上孵育1 h,弃去Ⅱ抗,1×TBST摇床上清洗PVDF膜3次,加入发光液,薄膜覆盖,放胶片曝光,胶片放入显影液显影,再放入定影液定影,洗净胶片,晾干,扫描仪扫描胶片,Quantity One 软件分析蛋白条带。
3统计学处理
采用SPSS 19.0分析软件,数据以均数±标准差(mean±SD)表示,组间均数比较采用方差分析和LSD-t检验,以P<0.05为差异有统计学意义。
结 果
1EAhy926细胞鉴定
经流式细胞术检测细胞表面CD31,结果显示EAhy926细胞的 CD31表达率>99.6%,符合内皮细胞特性,见图1。

Figure 1. Detection of CD31 on the surface of the cells by flow cytometry to identify endothelial cells.
图1流式细胞术检测细胞表面CD31鉴定内皮细胞结果
2Hcy对EAhy926细胞的损伤作用
EAhy926细胞生长至50%~60%时,换用含不同浓度同型半胱氨酸的培养基,结果发现含0.5、1.0、2.0、4.0和8.0 μmol/L Hcy培养基加入后细胞生长缓慢,且随浓度增加,贴壁细胞数明显减少,其中以4.0 μmol/L Hcy作用24 h对总体细胞数影响较小且能有效诱导细胞损伤,故作为Hcy损伤模型,见图2。

Figure 2. Representative morphology of EAhy926 cells after treatment with various concentrations of Hcy for 24 h(×10).
图2不同浓度Hcy培养24h后EAhy926细胞形态
3四逆汤对Hcy损伤EAhy926细胞的保护作用
EAhy926细胞生长至50%~60%时,经不同浓度四逆汤(0、1.0、0、0.5和1.0 kg/L)预处理后,换用含同型半胱氨酸4.0 μmol/L培养基,继续培养24 h,发现与对照组相比,Hcy模型组细胞生长缓慢,贴壁细胞数明显减少;四逆汤组与模型组相比,贴壁细胞数增加,细胞形态明显改善,其中以四逆汤1.0 kg/L+Hcy 4.0 μmol/L组最明显,见图3。
4Hcy对EAhy926细胞NO水平的影响
随着Hcy浓度增加,EAhy926细胞培养液上清NO浓度逐渐减少,且以Hcy 8.0 μmol/L最显著,见图4。

Figure 3. Effect of Sini decoction(SND) on EAhy926 cells injured by Hcy (×10).
图3四逆汤对Hcy损伤EAhy926细胞的保护作用

Figure 4. Effects of Hcy on NO concentration in the supernatant of EAhy926 cells.Mean±SD.n=3.#P<0.05vs0 μmol/L.
图4Hcy对EAhy926细胞NO水平的影响
5四逆汤对Hcy损伤后EAhy926细胞NO的影响
四逆汤1.0 kg/L组与对照组相比,EAhy926细胞培养液上清NO水平无明显改变,而Hcy模型组NO水平明显降低,四逆汤处理组细胞的NO水平较模型组升高,其中以四逆汤1.0 kg/L+Hcy 4.0 μmol/L组最明显(P<0.05),见图5。

Figure 5. Effects of Sini decoction(SND)on NO concentration in the supernatant of EAhy926 cells injured by Hcy.Mean±SD.n=3.*P<0.05vsSND 0 kg/L+Hcy 0 μmol/L;#P<0.05vsSND 0 kg/L+Hcy 4.0 μmol/L.
图5四逆汤对Hcy损伤后EAhy926细胞NO水平的影响
6四逆汤对Hcy损伤后eNOS和caveolin-1mRNA表达的影响
通过实时荧光定量PCR检测发现,四逆汤1.0 kg/L组与对照组相比,caveolin-1和 eNOS mRNA表达无明显改变,而Hcy模型组caveolin-1 mRNA表达明显增加,eNOS mRNA表达明显减少;与模型组对比,四逆汤处理组细胞的caveolin-1 mRNA表达减少,eNOS mRNA表达增加,其中以四逆汤1.0 kg/L+Hcy 4.0 μmol/L组最明显(P<0.05),见图6、7。

Figure 6. Effects of Sini decoction(SND) on eNOS mRNA expression in EAhy926 cells injured by Hcy. Mean±SD.n=3.*P<0.05vsSND 0 kg/L+Hcy 0 μmol/L;#P<0.05vsSND 0 kg/L+Hcy 4.0 μmol/L.
图6四逆汤对Hcy损伤后eNOSmRNA表达的影响
7四逆汤对Hcy损伤后eNOS和caveolin-1蛋白表达的影响
Western blotting检测发现,四逆汤1.0 kg/L组与对照组相比,caveolin-1和 eNOS 蛋白表达无明显改变,而Hcy模型组caveolin-1 蛋白表达明显增加,eNOS蛋白表达明显减少;与Hcy模型组对比,四逆汤处理组细胞的caveolin-1 蛋白表达减少,eNOS mRNA表达增加,其中以四逆汤1.0 kg/L+Hcy 4.0 μmol/L组最明显,见图8、9。

Figure 7. Effects of Sini decoction(SND) on caveolin-1 mRNA expression in EAhy926 cells injured by Hcy. Mean±SD.n=3.*P<0.05vsSND 0 kg/L+Hcy 0 μmol/L;#P<0.05vsSND 0 kg/L+Hcy 4.0 μmol/L.
图7四逆汤对Hcy损伤后caveolin-1mRNA表达的影响

Figure 8. Effects of Sini decoction(SND)on eNOS protein expression in EAhy926 cells injured by Hcy.Mean±SD.n=3.*P<0.05vsSND 0 kg/L+Hcy 0 μmol/L;#P<0.05vsSND 0 kg/L+Hcy 4.0 μmol/L.
图8四逆汤对Hcy损伤后eNOS蛋白表达的影响
讨 论
本实验采用中药煎剂过滤除菌后加入完全培养基作用于细胞,一次性完成药物的制备,从而保证了药物作用剂量的稳定,而通过煎煮的方法制备药物,继承了经典的中药汤剂传统,保证了药物有效成份的含量。通过高速离心去除粗颗粒样杂质,再经过滤器过滤除菌,保证了药物的纯净。经上述方法制备的四逆汤加入完全培养基后成功作用于细胞,而且与对照组比较,单纯四逆汤对细胞的形态及生长无明显影响,证明中药煎剂经过离心及过滤可成功应用于细胞培养,实验发现Hcy损伤组EAhy926细胞生长缓慢,且随浓度增加,贴壁细胞数明显减少,四逆汤组与Hcy损伤组相比,贴壁细胞明显增加,细胞形态明显改善,结果显示四逆汤有明确的减轻Hcy对EAhy926细胞损伤的作用。
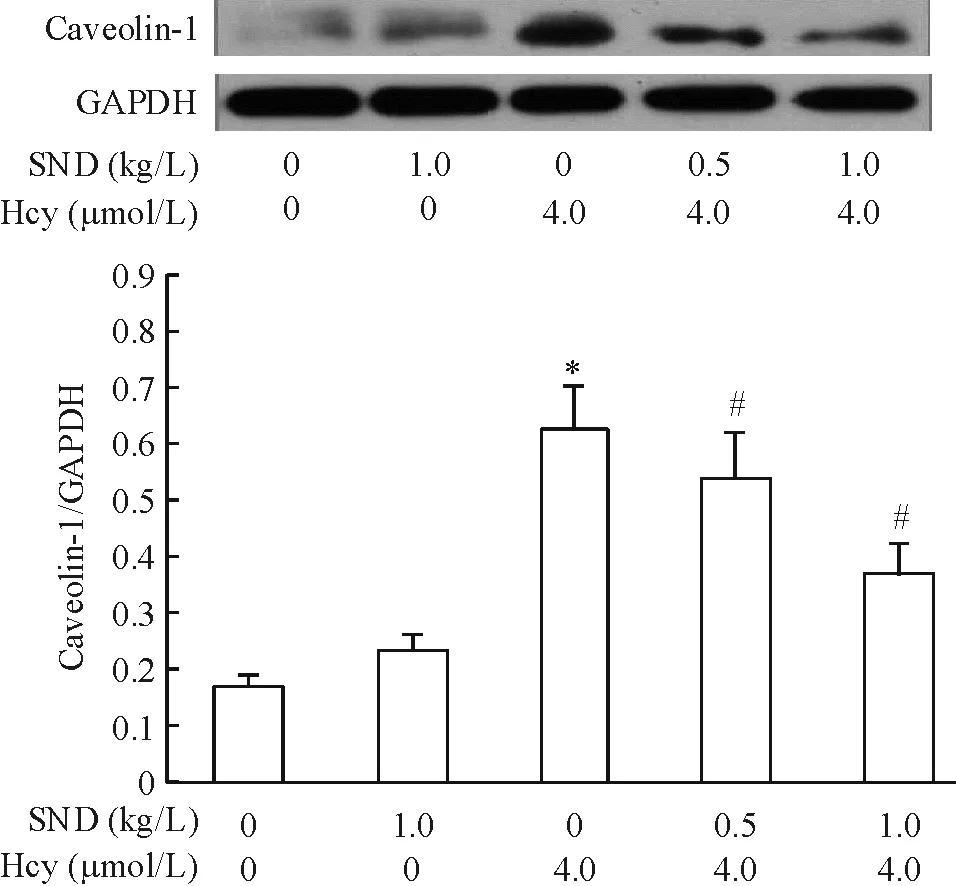
Figure 9. Effects of Sini decoction(SND) on caveolin-1 protein expression in EAhy926 cells injured by Hcy.Mean±SD.n=3.*P<0.05vsSND 0 kg/L+Hcy 0 μmol/L;#P<0.05vsSND 0 kg/L+Hcy 4.0 μmol/L.
图9四逆汤对Hcy损伤后caveolin-1蛋白表达的影响
动脉粥样硬化(atherosclerosis,AS)是血管壁慢性炎症的一个结果。其中一个主要事件是中性粒细胞的聚集和血小板对斑块之上内皮的黏附。NO是血管内平衡的一个重要生理调节因子,牵涉到动脉粥样硬化的病理生理过程。NO由NOS产生,NOS包括3种亚型,在粥样硬化斑块3种亚型均有表达,3种亚型在催化活动、基因调节和细胞腔隙不同。在正常动脉eNOS是主要的亚型,eNOS是结构型酶,产生低浓度NO,NO是血小板活化、聚集的潜在调节因子,而多种证据显示血小板促进动脉硬化[2],从某种意义上来说,AS是NO产生不足所致[3]。
动脉粥样硬化是一种血管壁的疾病,其特征是以胆固醇积聚为初始损害,接着是巨噬细胞和平滑肌细胞的积聚。与动脉粥样硬化进展有关的内皮细胞、巨噬细胞和平滑肌细胞均表达caveolae和caveolin-1。Caveolae是一种形成细胞膜烧瓶样内陷的特殊脂肪筏,caveolin-1是caveolae的主要蛋白成分,是一种具有独特构象的178个氨基酸的胞浆膜蛋白,具有肝素样结构,N端和C端均在细胞浆,中心区域在胞浆膜。大量研究显示caveolin-1在多种类型细胞如内皮细胞、巨噬细胞和平滑肌细胞等均可调节信号途径。用caveolin-1缺失小鼠进行的研究显示完全的caveolin-1缺失与主要的动脉粥样硬化发展减少有关[4],而且,几种可能的致动脉粥样硬化蛋白共同集中于内皮细胞的caveolae,其中一些蛋白涉及脂质代谢、细胞增生和迁移、炎症或各种信号途经的调节[5]。目前研究认为内皮的caveolin-1可能作为一种促动脉粥样硬化蛋白[6]。Caveolae 和caveolin-1在内皮细胞、巨噬细胞、平滑肌细胞均有表达,而这些细胞均参与动脉粥样硬化的形成和发展,caveolin-1可发挥eNOS负性变构调节剂的作用[7],研究显示在静息状态下,caveolin-1通过其结构域与eNOS结合为eNOS-caveolin-1复合物,这种结合可以干扰eNOS的还原酶活性基团和氧化酶活性基团之间的电子传递而抑制NO的合成。当钙调蛋白与Ca2+结合时,caveolin-1则从eNOS-caveolin-1复合物置换出来,形成eNOS-Ca2+复合物,这种状态下eNOS表现为酶活性形式,因而NO生成增加[8]。总之,各种资料显示caveolae 和caveolin-1可能在内皮功能的调节和动脉粥样硬化的发展中起重要作用。
四逆汤是中药经典名方,源于《伤寒论》,原方用于治疗少阴病,能温散里寒及治疗阳气虚衰,阴寒内盛的四肢厥逆,用于治疗神疲倦怠、冷汗自出、下利清谷、口淡不渴、舌淡苔白、脉沉微或迟弱及误汗或大汗淋漓之亡阳症,或真寒假热、手足厥冷等症。现代大量动物和药理实验显示四逆汤具有多种作用:(1)抗实验性动脉粥样硬化作用:四逆汤可明显减小主动脉内膜脂质斑块面积,降低血清总胆固醇、甘油三酯、低密度脂蛋白胆固醇、载脂蛋白B及血浆内皮素和MDA浓度,提高血清NO水平、载脂蛋白A含量与血浆超氧化物歧化酶活性,且四逆汤高剂量组效果最好[9]; (2)保护血管内皮细胞功能:四逆汤可明显降低血浆ET浓度,提高血清NO含量,从而保护血管内皮细胞功能[10-11];(3)改善冠状动脉循环:四逆汤可有效降低血液黏度,改善冠状动脉循环,保护缺血心肌[11];(4)抗氧化应激作用:四逆汤具有降低心肌氧自由基浓度、升高心肌超氧化物歧化酶活性、降低心肌丙二醛浓度的作用,对应激老年小鼠心脏具有显著保护作用[12]。
四逆汤由附子、干姜和甘草3味药组成,我们早先的研究证明,四逆汤具有抗氧化损伤及调节血管内皮细胞功能的作用,调节血管内皮细胞功能是四逆汤防治冠心病的可能机制,提示四逆汤具有较好的抗动脉粥样硬化作用[13-15]。
本实验证实了四逆汤具有抗Hcy损伤作用,观察到四逆汤升高细胞外液NO,增加细胞eNOS的表达,减低caveolin-1的表达,显示四逆汤抗动脉硬化的机制可能与抑制caveolin-1的表达进而增加NO系统的功能有关。
[1] 秦 鉴,吴伟康,张洁文,等.四逆汤治疗冠心病心绞痛患者生活质量的变化[J].中药材,2004,27(5):385-387.
[2] Ponnuswamy P, Schrottle A, Ostermeier E, et al. eNOS protects from atherosclerosis despite relevant superoxide production by the enzyme inapoE-/-mice[J]. PLoS One,2012,7(1): e30193.
[3] Janero DR, Ewing JF. Nitric oxide and postangioplasty restenosis: pathological correlates and therapeutic potential[J]. Free Radic Biol Med, 2000,29(12):1199-1221.
[4] Frank PG, Lee H, Park DS, et al. Genetic ablation of caveolin-1 confers protection against atherosclerosis[J]. Arterioscler Thromb Vasc Biol,2004, 24(1):98-105.
[5] von Eckardstein A, Rohrer L.Transendothelial lipoprotein transport and regulation of endothelial permeability and integrity by lipoproteins[J]. Curr Opin Lipidol,2009, 20(3):197-205.
[6] Fernandez-Hernando C, Yu J, Suarez Y, et al.Genetic evidence supporting a critical role of endothelial caveolin-1 during the progression of atherosclerosis [J].Cell Metab, 2009, 10(1):48-54.
[7] Spyridopoulos I, Isner JM, Losordo DW.Oncogenic ras induces premature senescence in endothelial cells: role of p21Cip1/Waf1[J]. Basic Res Cardiol, 2002,97(2):117-124.
[8] Garcia-Cardena G,Martasek P,Masters BS, et al. Dissecting the interaction between nitric oxide synthase (NOS) and Caveolin. Functional significance of the NOS caveolin binding domaininvivo[J].J Biol Chem,1997, 272(41): 25437-25440.
[9] 黄河清,吴伟康,程 超.四逆汤抗实验性动脉粥样硬化的作用及其机制[J].中国动脉硬化杂志,2000,8(4):302-304.
[10] 钱孝贤,陈燕铭,吴伟康,等.保心胶囊对急性心肌缺血犬一氧化氮和内皮素的影响[J].中国临床药学杂志,2000,9(5):280-283.
[11] 罗汉川,黄河清,吴伟康,等.保心胶囊对大鼠垂体后叶素性急性心肌缺血心电图及阴寒致瘀血液流变性的影响[J].深圳中西医结合杂志,2000,10(3):99-101.
[12] 吴伟康,黄河清,谭红梅,等.四逆汤对动脉粥样硬化家兔脂代谢及血管内皮功能的影响[J].第一军医大学学报,2000,20(2):141-143.
[13] 钱孝贤,刘 勇,吴伟康,等.四逆汤对兔髂动脉球囊损伤后血管狭窄和一氧化氮系统的影响[J].中山大学学报:医学科学版,2008,29(6):710-715.
[14] 刘 勇,钱孝贤,吴伟康,等.四逆汤对兔髂动脉球囊损伤病变区TGF-β1表达的影响[J].中国病理生理杂志,2006,22(11):2151-2155.
[15] 刘 勇,钱孝贤,吴伟康,等.四逆汤对兔髂动脉球囊损伤后血管狭窄和氧化应激的影响[J].南方医科大学学报,2006,26(11):1559-1562.
EffectofSinidecoctiononexpressionofcaveolin-1andeNOSinEAhy926cellsinjuredbyhomocysteine
LIU Yong1, HAO Bao-shun1, LIU Ding-hui1, SONG Zhi-ming1, YU Shu-jie1, ZHOU Bin1, WU Lin1, WANG Min1, ZHU Jie-ming1, QIAN Xiao-xian1,2, CHEN Lin1, WU Wei-kang2
(1DepartmentofCardiology,theThirdAffiliatedHospital,SunYat-senUniversity,Guangzhou510630,China;2InstituteforIntegratedTraditionalChineseandWesternMedicine,SunYat-senUniversity,Guangzhou510080,China.E-mail:xiao-xianq@tom.com)
AIM: To investigate the mechanism of Sini decoction in treating human vascular endothelial cell injury and the roles of caveolin-1 and nitric oxide (NO) system in this procedure.METHODSModel of human umbilical vein endothelial EAhy926 cells injured by homocysteine (Hcy) was established. The protective effect of Sini decoction on the injured EAhy926 cells was observed, and the expression of caveolin-1 and endothelial nitric oxide synthase (eNOS) was detected by real-time fluorescence quantitative PCR and Western blotting.RESULTSCompared with control group, the Hcy-treated EAhy926 cells showed reduced adherent cell number and NO concentration in culture supernatant, decreased expression of eNOS mRNA and protein, and increased expression of caveolin-1 mRNA and protein (allP<0.05). Compared with Hcy group, better growth of adherent cells, elevated NO concentration in culture supernatant, attenuated expression of caveolin-1 mRNA and protein, and enhanced expression of eNOS mRNA and protein in Sini decoction groups were observed (allP<0.05).CONCLUSIONHomocysteine may injure EAhy926 cells by enhancing the expression of caveolin-1 and suppressing the expression of eNOS, while Sini decoction may protect EAhy926 cells by suppressing the expression of caveolin-1 and enhancing the expression of eNOS.
Sini decoction; Endothelial cells; Caveolin-1; Endothelial nitric oxide synthase
R363.2+1
A
1000- 4718(2013)09- 1579- 06
2013- 06- 13
2013- 08- 16
广东省科技计划(No.2010B080701042)
△通讯作者Tel: 020-85252168; E-mail: xiaoxianq@tom.com
10.3969/j.issn.1000- 4718.2013.09.007
