荭草素和异荭草素抗氧化活性及对肝癌细胞增殖的影响
2013-09-19吴雨晨任骁萌刘学波
袁 莉, 吴雨晨, 任骁萌, 刘学波
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
荭草素和异荭草素抗氧化活性及对肝癌细胞增殖的影响
袁 莉, 吴雨晨, 任骁萌, 刘学波*
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
采用荭草素和异荭草素标准品,通过测定两者对DPPH·、ABTS+·、H2O2、·OH自由基的清除率,脂质过氧化,Cu2+/H2O2诱导的牛血清蛋白(BSA)和DNA氧化损伤及BSA蛋白羰基化的抑制作用来评价二者的抗氧化活性,另外用MTT法评价了二者对人肝癌(HepG2)细胞生长的影响.结果表明,荭草素和异荭草素均可清除自由基,抑制脂质过氧化、BSA和DNA氧化损伤和BSA羰基化,且一定浓度范围内异荭草素的抗氧化活性强于荭草素;另外荭草素和异荭草素可显著抑制HepG2细胞增殖,并呈浓度和时间依赖性,且异荭草素的抑制率高于荭草素,说明异荭草素是优于荭草素的有抗癌功效的天然抗氧化剂.
荭草素;异荭草素;体外抗氧化;氧化损伤;HepG2细胞
*刘学波,男,教授,主要从事营养与功能食品因子方面的研究.通讯作者.
活性氧(ROS)是一类性质非常活泼的含氧物质的总称.在需氧有机体正常代谢过程中伴随有ROS的产生,它可作为信号分子维持机体的正常生理功能.机体内ROS水平处于动态平衡状态,当机体内ROS过量或抗氧化物质不足时,会引起氧化应激,损害生物大分子(如蛋白质、核酸和脂类等)的结构和功能,最终导致机体生理和病理的改变[1].据报道,许多重大疾病的发生与机体内ROS水平失衡密切相关,如帕金森 、阿尔茨海默、肿瘤和肥胖等[2].抗氧化物质可通过阻碍自由基产生和干预自由基作用的方式而抑制自由基对机体的伤害,而天然抗氧化剂以其具有安全,高效和无毒副作用等优点而备受关注[3],所以运用天然抗氧化剂来干预氧化应激相关疾病的发生已成为目前功能食品研究的热点.
荭草素(3',4',5,7-四羟基-8-吡喃葡萄糖基黄酮)(orientin)和异荭草素(3',4',5,7-四羟基-6-吡喃葡萄糖基黄酮)(isoorientin)是黄酮类物质,互为同分异构体,广泛存在于苦菜、荞麦、山楂和竹笋等[4-7]食品中.据报道,荭草素和异荭草素具有清除DPPH自由基和抗炎的作用,但二者抗氧化性能和对癌细胞活力的影响的研究还不全面[8-9].本研究拟探讨荭草素和异荭草素清除自由基、减少蛋白羰基化、预防蛋白和DNA氧化的能力及对人肝癌(HepG2)细胞活力的影响,旨在为荭草素和异荭草素在天然抗氧化剂和功能性食品领域的开发应用提供理论依据.
1 材料与方法
1.1 材料与试剂
荭草素和异荭草素结构见图1.

图1 荭草素和异荭草素的结构Fig.1 Chemical structure of orientin and isoorientin
荭草素和异荭草素标准品,上海永恒生物技术有限公司,纯度 >98%;牛血清白蛋白(BSA)、2,2-二苯基-1-苦味肼基自由基(DPPH·)和 2,2-联氮-双(3-乙基苯并噻吡咯啉-6-磺酸)(ABTS+·),美国Sigma 公司;Anti-DNP 和 anti-rabbit,美国 Santa Cruz公司;噻唑兰(MTT)、2,4-二硝基苯肼(DNPH),美国Amresco公司;DNA(pBR322),中国碧云天生物技术研究所;人肝癌HepG2细胞株,第四军医大学细胞库;RPMI-1640培养基和胎牛血清,中国Thermo Fisher公司.
1.2 仪器与设备
UV-1700型紫外分光光度计,日本岛津公司;Model680型酶标仪,美国伯乐公司;3110型细胞培养箱,美国Thermo Scientific公司;165-8001型垂直电泳槽和Chemi Doc XRS型凝胶成像系统,美国伯乐公司.
1.3 实验方法
1.3.1 DPPH·自由基的清除实验
参照 Faller等[10]方法并修改.50 μL 不同浓度的样品溶液(样品溶液终质量浓度分别为20,40,80,100,200,400 μmol/L)与 225 μL 100 μmol/L 的DPPH-甲醇溶液避光静置反应30 min,后用紫外-可见分光光度计在517 nm波长下测定其吸光度.空白组用超纯水代替样品,对照组用甲醇代替DPPH·-甲醇溶液,同时用终浓度为400 μmol/L的Vc溶液的清除能力作对比.按式(1)计算样品对DPPH·的清除率.
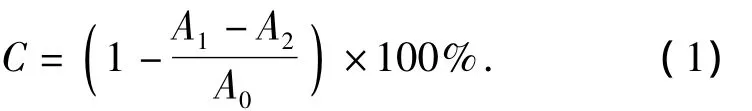
式(1)中:C为DPPH·的清除率,A1为实验组的吸光度,A2为对照组的吸光度,A0为空白组的吸光度.
1.3.2 ABTS+·自由基的清除实验
40 μL不同浓度的样品溶液(样品溶液终浓度分别为 1,5,10,20,40,80 μmol/L)与 200 μL ABTS工作液避光静置反应6 min,后用紫外-可见分光光度计在734 nm波长下测定吸光度.空白组用超纯

式(2)中:C为ABTS·+的清除率,A1为实验组的吸光度,A2为对照组的吸光度,A0为空白组的吸光度.
1.3.3 过氧化氢(H2O2)的清除实验
参照乔德亮等[11]方法并修改.取离心管,分别加入240 μL 0.1 mol/L pH值为7.4的磷酸缓冲液、60 μL 0.04 mol/L H2O2和 100 μL 不同浓度样品溶液(使得样品溶液终浓度分别为0.01,0.05,0.10,0.50,1.00,5.00 μmol/L),涡旋振荡后,室温放置10 min,用紫外-可见分光光度计在230 nm波长下测定其吸光度.同时设定空白组和对照组,空白组是用超纯水代替样品溶液,对照组是用超纯水代替H2O2.另外,按照同样方法测定终浓度为5 μmol/L的Vc溶液的清除能力用来对比.

按式(3)计算样品对H2O2的清除率.水代替样品,对照组用超纯水代替ABTS工作液.同时用终浓度为80 μmol/L的Vc溶液的清除能力作对比.按式(2)计算样品对ABTS·+的清除率.
式(3)中:C为H2O2的清除率,A1为实验组的吸光度,A2为对照组的吸光度,A0为空白组的吸光度.
1.3.4 对羟基(·OH)自由基的清除
采用Fenton 法测定·OH 自由基[12].50 μL 不同浓度样品溶液(样品溶液终浓度分别为0.1,0.5,1.0,5.0,10.0,20.0 μmol/L)、100 μL 1.8 mmol/L FeSO4、75 μL 1.8 mmol/L 水杨酸-乙醇溶液和 5 μL 0.03%H2O237℃水浴孵育30 min后,用紫外-可见分光光度计在510 nm波长下测定其吸光度.空白组用超纯水代替样品溶液,对照组用超纯水代替FeSO4、水杨酸-乙醇溶液和H2O2,同时用终浓度为20 μmol/L的Vc溶液的清除能力作对比.按式(4)计算样品对羟基自由基(·OH)的清除率.
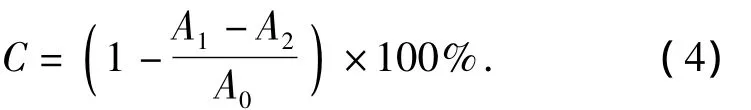
式(4)中:C为·OH的清除率,A1为实验组的吸光度,A2为对照组的吸光度,A0为空白组的吸光度.
1.3.5 对脂质过氧化的抑制实验
参照 Tsuda等[13]方法.20 μL 脂质体(20 mg卵磷脂,溶于5 mL 0.05 mol/L pH值为7.4的磷酸缓冲液中,充氮封口)和50 μL不同浓度的样品溶液(样品溶液终浓度分别为:10,100,500,1000 μmol/L)混匀后加入50 mmol/L FeSO45 μL并0.1 mmol/L pH值为7.4的磷酸缓冲液补足至体系总体积为300 μL.后37℃ 水浴温育,40 min后,分别加入10%TCA 100 μL 和 0.8%TBA 100 μL,于 100 ℃水浴中敞盖煮沸15 min,冷却后与5 000 r/min离心10 min,取上清液用紫外-可见分光光度计在532 nm波长下测定其吸光度.空白组用磷酸缓冲液代替样品溶液,对照组用磷酸缓冲液代替FeSO4溶液,同时用终浓度为1 000 μmol/L的Vc溶液的抑制能力用来对比.按式(5)计算样品对脂质过氧化的抑制率.

式(5)中:C为脂质过氧化抑制率,A1为实验组的吸光度,A2为对照组的吸光度,A0为空白组的吸光度.
1.3.6 Cu2+/H2O2诱导BSA蛋白氧化损伤实验
参照 Xiao 等[14]方法.97 μL BSA(0.6 mg/mL)蛋白溶液和1 μL荭草素或异荭草素溶液(样品溶液终浓度分别为 0.001,0.010,0.100,1.000 mmol/L)与室温孵育30 min,再分别加入1 μL Cu2+和H2O2,37℃水浴 90 min;同时以 97 μL BSA溶液与 1 μL甲醇溶液,2 μL PB混合液作阳性对照;以 97 μL BSA 溶液、1 μL 甲醇溶液、1 μL Cu2+和 1 μL H2O2的混合液作为阴性对照.反应结束后,加入25 μL SDS,95℃水浴5 min,使蛋白充分变性.同体积的蛋白样品经10%聚丙烯凝胶电泳后,0.15%的考马斯亮蓝R-250染色30 min,脱色过夜,蛋白含量由Quantity One 4.6.2软件分析.
1.3.7 Cu2+/H2O2诱导BSA蛋白羰基化实验
根据1.3.6方法制备蛋白样品,经10%聚丙烯凝胶电泳后,10 V,25 min转印,使凝胶上的蛋白转移到PVDF膜上.膜再与DNPH衍生30 min,2 mol/L HCL洗涤 3次,每次 5 min,甲醇洗涤 5次,每次5 min.5%脱脂乳室温封闭2 h,TBST洗涤.用DNP抗体4℃孵育过夜,TBST洗涤,anti-rabbit抗体室温孵育2 h,TBST洗涤,化学成像系统观察蛋白质羰基化的产生,并用Quantity One 4.6.2软件定量分析.
1.3.8 Cu2+/H2O2诱导DNA氧化损伤
氧化损伤使DNA超螺旋断裂成环形结构,参照Jung等[15]的方法测定 DNA氧化损伤程度.DNA(pBR322)与荭草素或异荭草素(样品溶液终浓度分别为10,50和100 μmol/L)于37℃孵育30 min,后与Cu2+/H2O2(0.1/1 mmol/L)于37℃水浴2 h.反应体系与上样缓冲液混合后,1%琼脂糖以0.5×TBE 缓冲液(Tris 5.4 g,硼酸 2.75 g,EDTA 0.037 2 g,双蒸水1 000 mL)水平电泳100 V 30 min后,用化学成像系统观察DNA损伤程度,并用Quantity One 4.6.2软件定量分析.
1.3.9 HepG2细胞活力测定
采用MTT法[16]测定细胞活力.消化收集细胞,细胞计数并调整细胞浓度至1×105个/mL,接种到96孔板中,每孔100 μL,同时设置对照孔,置37℃、5%CO2培养箱中培养过夜.将荭草素和异荭草素分别用无血清培养基稀释至20,40,80 μmol/L,加入到96孔板中,每孔100 μL,每组均设 6复孔,继续培养24 h和48 h后,每孔加入 100 μL 0.5 mg/mL MTT溶液(用培养基稀释),37℃作用4 h后,每孔加入100 μL二甲基亚砜(DMSO),用酶标仪于490 nm波长下测定每孔OD值.按式(6)计算细胞相对存活率:

1.4 数据统计
全部实验数据用Microsoft Excel 2003和SPSS 16.0数据处理系统进行统计处理,计算标准偏差(±SE)并进行Duncan’s多重差异显著分析.
2 结果与分析
2.1 清除自由基的活性测定结果
2.1.1 DPPH·自由基的清除作用
荭草素和异荭草素对DPPH·自由基的清除作用见图2.由图2可见,荭草素和异荭草素均具有清除DPPH·自由基的能力,并呈浓度依赖性,随着浓度的增加,清除率增加,当浓度增加到一定值时,二者的清除率趋于相当. 浓度为20,40,80,100 μmol/L时,异荭草素对DPPH·自由基的清除率显著(P≤0.01)高于相同浓度荭草素的清除率,分别高于28.03%,46.32%,73.23%和85.59%,说明异荭草素的清除能力明显强于荭草素.当浓度为200和400 μmol/L时,荭草素和异荭草素的清除能力无显著差异.与400 μmol/L Vc对DPPH·自由基的清除能力显著(P≤0.01)低于相同浓度的荭草素和异荭草素,说明异荭草素清除DPPH·自由基的能力强于荭草素,且在高浓度下,其清除能力甚至强于同等浓度Vc对DPPH·自由基清除能力.

图2 荭草素和异荭草素对DPPH·自由基的清除率Fig.2 Scavenging rate of orientin and isoorientin on DPPH·radical
2.1.2 ABTS+·自由基的清除作用
荭草素和异荭草素对ABTS+·自由基的清除作用见图3.由图3可见,荭草素和异荭草素均具有清除ABTS+·自由基的能力,且呈浓度依赖性.在低浓度范围内,二者对ABTS·+自由基的清除能力没有显著差异,当浓度为20,40 μmol/L时,异荭草素对ABTS+·自由基的清除率显著(P≤0.05)高于相同浓度荭草素的清除率,分别高于85.40%和88.08%,说明异荭草素的清除能力明显强于荭草素.80 μmol/L Vc对ABTS+·自由基的清除能力显著(P≤0.01)高于相同浓度的荭草素和异荭草素,说明高浓度范围内,异荭草素清除ABTS+·自由基的能力高于荭草素,但其清除能力仍低于同等浓度Vc的清除能力.
2.1.3 H2O2的清除作用
荭草素和异荭草素对H2O2的清除能力见图4.由图4可见,荭草素和异荭草素均有清除H2O2的能力,且异荭草素对H2O2的清除能力始终强于荭草素.当浓度小于5 μmol/L时,荭草素对H2O2的清除率呈浓度依赖性.异荭草素对H2O2的清除能力整体呈浓度依赖性,浓度为 0.05,0.10,0.50,5.00 μmol/L时,异荭草素对H2O2的清除率显著(P≤0.01)高于相同浓度荭草素的清除率,分别高于24.94%,28.14%,31.78%和28.59%.当样品浓度为0.01,1.00 μmol/L 时,二者对 H2O2的清除能力无显著差异.5.00 μmol/L Vc清除H2O2的能力显著(P≤0.01)高于相同浓度的荭草素和异荭草素,说明异荭草素清除H2O2的能力强于荭草素,但仍低于同浓度Vc对H2O2的清除能力.

图3 荭草素和异荭草素对ABTS+·自由基的清除率Fig.3 Scavenging rate of orientin and isoorientin on ABTS+·radical
2.1.4 ·OH自由基的清除作用
荭草素和异荭草素对·OH自由基的清除能力见图5.由图5可以看出,荭草素和异荭草素均具清除·OH自由基的能力,且分别在10 μmol/L和0.5 μmol/L时达到最大清除能力.低浓度范围内,异荭草素对·OH自由基的清除能力高于荭草素,当浓度为0.5 μmol/L时,异荭草素对·OH自由基的清除率较荭草素高21.29%(P≤0.01).20 μmol/L Vc清除·OH 自由基的能力显著(P≤0.01)低于同浓度下荭草素对·OH自由基的作用,而高于同浓度下异荭草素的作用.
2.2 保护大分子氧化损伤的活性测定结果
2.2.1 脂质过氧化的抑制作用

图5 荭草素和异荭草素对·OH自由基的清除率Fig.5 Scavenging rate of orientin and isoorientin on·OH radical
荭草素和异荭草素对脂质过氧化的抑制作用见图6.由图6可见,荭草素和异荭草素都具有抑制脂质过氧化的能力,并呈浓度依赖性.浓度为100,1 000 μmol/L时,异荭草素对脂质过氧化的抑制率显著(P≤0.01)高于相同浓度荭草素的抑制率,分别高于30.45%,58.84%. 当浓度为10,500 μmol/L时,荭草素和异荭草素的抑制能力无显著差异.1 000 μmol/L Vc抑制脂质过氧化的能力显著(P≤0.01)高于各浓度的荭草素和异荭草素,说明Vc抑制脂质过氧化的能力均强于荭草素和异荭草素,而异荭草素抑制脂质过氧化的能力强于荭草素.0.01,0.1,1 mmol/L时,异荭草素对 BSA的保护作用显著(P≤0.01)高于相同浓度的荭草素,分别高于 66.68% ,64.76% ,58.45% ,62.60%.

图7 荭草素和异荭草素对Cu2+/H2O2诱导的BSA氧化损伤的保护作用Fig.7 Protective effect of orientin and isoorientin on Cu2+/H2O2-induced BSA oxidative damage

图6 荭草素和异荭草素对脂质过氧化的清除率Fig.6 Scavenging rate of orientin and isoorientin on lipid oxidation
2.2.2 Cu2+/H2O2诱导的牛血清蛋白氧化损伤的保护作用
荭草素和异荭草素对BSA氧化损伤的保护作用见图7.由图7可见,荭草素和异荭草素均具有抑制BSA氧化损伤的能力,并呈浓度依赖性,且异荭草素的保护作用强于荭草素.当样品浓度为0.001,
2.2.3 Cu2+/H2O2诱导的BSA蛋白羰基化的抑制作用
荭草素和异荭草素对Cu2+/H2O2诱导的蛋白羰基化的抑制情况见图8.由图8中可以看出,荭草素和异荭草素都具有抑制蛋白羰基化的能力,并呈浓度依赖性,即随着浓度的增加,对于蛋白羰基化的抑制作用越强,且异荭草素的抑制作用强于荭草素.当样品浓度为 0.1,0.5,1,5 mmol/L 时,异荭草素对蛋白羰基化的抑制作用显著(P≤0.01)高于相同浓度的荭草素的抑制作用,分别高于1.38%,3.13%,4.32%和5.35%.
2.2.4 对Cu2+/H2O2诱导的DNA氧化损伤的保护作用
荭草素和异荭草素对DNA氧化损伤的保护作用见图9.由图9可见,荭草素和异荭草素均具有保护DNA氧化损伤的能力,并呈浓度依赖性,随着浓度的增加,剩余超螺旋形DNA的百分比越多,即对DNA保护作用越强.浓度为10 μmol/L时,荭草素和异荭草素处理组的超螺旋形DNA含量与对照组没有无显著性差异.浓度为50 μmol/L时,荭草素和异荭草素处理组的超螺旋形DNA含量显著(P≤0.01)多于对照组的含量,说明荭草素和异荭草素对DNA氧化损伤有保护作用.浓度为100 μmo/L时,异荭草素处理组的超螺旋形DNA含量高于相同浓度荭草素处理组的含量5.4%,具有显著性(P≤0.01)差异.
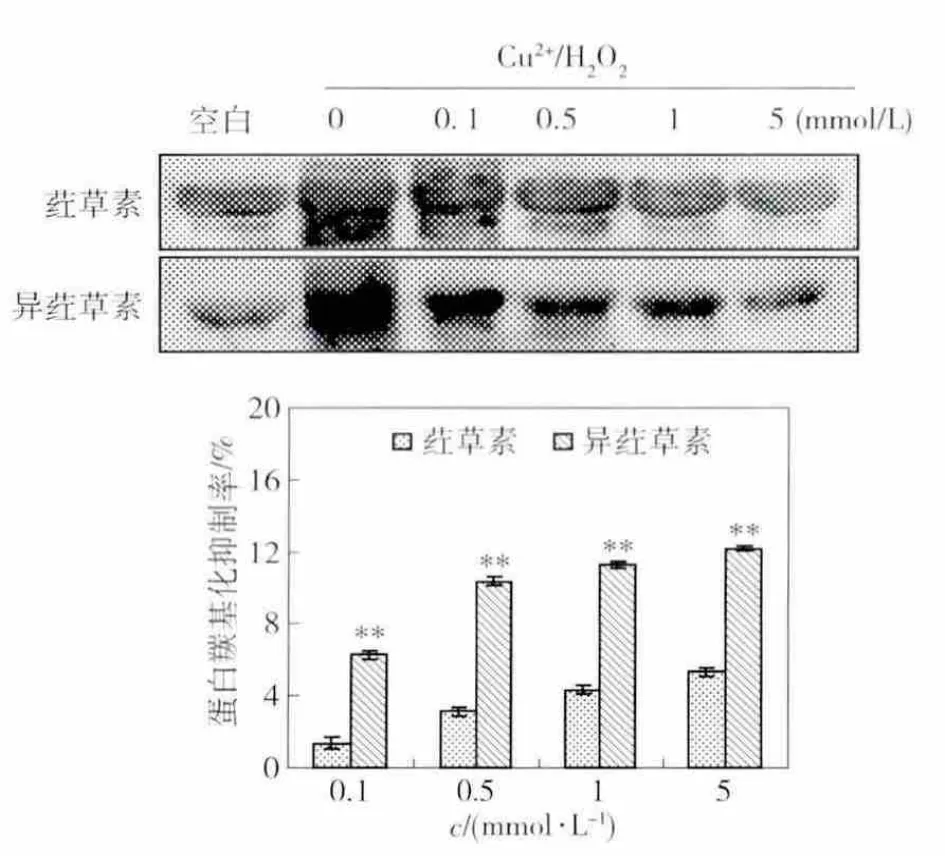
图8 荭草素和异荭草素对Cu2+/H2O2诱导的蛋白羰基化的抑制率Fig.8 Inhibition of orientin and isoorientin on Cu2+/H2O2-induced BSA protein carbonyls

图9 荭草素和异荭草素对Cu2+/H2O2诱导的DNA氧化损伤的保护作用Fig.9 Inhibition of orientin and isoorientin on Cu2+/H2O2-induced BSA protein carbonyls
2.3 对HepG2细胞活力的影响
荭草素和异荭草素对HepG2细胞活力的影响见图10.由图10可见,荭草素和异荭草素均可降低HepG2细胞活力,并呈浓度和时间依赖性,且异荭草素效果显著强于荭草素.80 μmol/L异荭草素处理细胞24 h和48 h时,细胞活力较同浓度荭草素处理相同时间后细胞活力分别低于16.57%,33.69%,存在显著性(P<0.01)差异.

图10 荭草素和异荭草素对HepG2细胞活力的影响Fig.10 Effect of orientin and isoorientin on HepG2 cell viability
3 结论
荭草素和异荭草素可显著的清除 DPPH·、ABTS+·、H2O2、·OH 自由基;并有效抑制 Cu2+/H2O2诱导的脂质过氧化、BSA氧化损伤、BSA蛋白羰基化和DNA氧化损伤;另外,荭草素和异荭草素可显著抑制HepG2细胞生长,且异荭草素抗氧化能力和抑制癌细胞增殖的效果明显优于荭草素.关于荭草素和异荭草素抑制癌细胞增殖的作用机制,以及二者的其他生物功效还需进一步研究.
[1]李勇,孔令青,高洪,等.自由基与疾病研究进展[J].动物医学进展,2008,29(4):85-88.
[2]Brieger K,Schiavone S,Miller F J Jr,et al.Reactive oxygen species:from health to disease[J].Swiss Med Wkly,2012,142:13659.
[3]Van den Ende W,Peshev D,De Gara L.Disease prevention by natural antioxidants and prebiotics acting as ROS scavengers in the gastrointestinal tract[J].Trends in Food Science Technology,2011,22(12):689-697.
[4]Tunalier Z,Koşar M,Küpeli E,et al.Antioxidant,antiinflammatory,anti-nociceptive activitiesand composition ofLythrum salicariaL.extracts[J].J Ethnopharmacology,2007,110:539-547.
[5]Watanabe W.An anthocyanin compound in buckwheat sprouts and its contribution to antioxidant capacity [J].Biosci Biotechnol Biochem,2007,71:579-582.
[6]Prinz S,Ring A,Huefner A,et al.4‴-acetylvitexin-2″-O-rhamnoside, isoorientin, orientin, and 8-methoxykaempferol-3-O-glucoside as markers for the differentiation of crataegus monogyna and crataegus pentagyna from crataegus laevigata[J].Chem Biodivers,2007(4):2920-2931.
[7]Yong-Chun J,Lin Y,Yuan K.A novel high-performance liquid chromatography fingerprint approach to discriminate Phyllostachys pubescens from China[J].Pharmacogn Mag,2012(8):42-48.
[8]Park H S,Lim J H,Kim H J,et al.Antioxidant flavone glycosides from the leaves of sasa borealis[J].Arch.Pharm Res,2007,30(2):161-166.
[9]Conforti F,Rigano D,Menichini F,et al.Protection against neurodegenerative diseases of iris pseudopumila extracts and their constituents fitoterapia [J].Fitoterapia,2009,80:62-67.
[10]Faller A L K,Fialho E.Polyphenol content and antioxidant capacity in organic and conventional plant foods[J].Journal of Food Composition and Analysis,2010,23(6):561-568.
[11]乔德亮,赵峰,黄海忠,等.双孢蘑菇多糖超声波辅助提取及体外抗氧化活性[J].中药材,2012,35(8):1340-1347.
[12]陆海峰,罗建华,蒙春越,等.蒲公英总黄酮提取及对羟自由基清除作用[J].广州化工,2009,37(3):101-103.
[13]Tsuda T,Watanabe M,Ohshima K,et al.Antioxidative activity of the anthocyanin pigments cyanidin 3-O-beta.-D-glucoside andcyaniding [J].Journal of Agricultural and Food Chemistry,1994,42(11):2407-2410.
[14]Xiao H F,Wang Y T,Xiang Q S,et al.Novel physiological properties of ethanol extracts from Eremurus chinensis Fedtsch.roots:in vitro antioxidant and anticancer activities[J].Food Function,2012,3(12):1310-1318.
[15]Jung Y J,Surh Y J.Oxidative DNA damage and cytotoxicity induced by copper-stimulated redox cycling of salsolinol a neurotoxic tetrahydroisoquinoline alkaloid[J].Free Radical BiolMed,2001,30:1407-1417.
[16]Liu X B,Yamada N,Maruyama W,et al.Formation of dopamine adducts derived from brain polyunsaturated fatty acids[J].J Biol Chem,2008,283(12):34887-34895.
Comparison of Antioxidant Activities and Cytotoxicity in HepG2 Cells of Orientin and Isoorientin
YUAN Li, WU Yu-chen, REN Xiao-meng, LIU Xue-bo*
(College of Food Science and Engineering,Northwest Agriculture and Forestry University,Yangling712100,China)
In this study,the effects of orientin and isoorientin on radical-scavenging activities(DPPH·,ABTS+·,H2O2,·OH),lipid peroxidation,Cu2+/H2O2induced BSA and DNA oxidative damage,and BSA protein carbonyls were investigated.The results showed that orientin and isoorientin exhibited high radical-scavenging activities and also effectively protected biological macromolecules including proteins,lipids,and DNA against oxidative damage induced by Cu2+/H2O2.Moreover,the MTT assay revealed that orientin and isoorientin inhibited proliferation of HepG2 cells in a dose and time dependent manner,and the antioxidant and anticancer activities of isoorientin was much better than that of orientin.These results demonstrate the remarkable potentiality of isoorientin as a valuable nature antioxidant possessing original anticancer abilities.
orientin;isoorientin;antioxidant;oxidative damage;HepG2 cells
TS201
A
2095-6002(2013)06-0021-07
袁莉,吴雨晨,任骁萌,等.荭草素和异荭草素抗氧化活性及对肝癌细胞增殖的影响.食品科学技术学报,2013,31(6):21-27.
YUAN Li,WU Yu-chen,REN Xiao-meng,et al.Comparison of Antioxidant Activities and Cytotoxicity in HepG2 Cells of Orientin and Isoorientin.Journal of Food Science and Technology,2013,31(6):21 -27.
2013-10-06
国家自然科学基金资助项目(31000757).
袁 莉,女,博士研究生,研究方向为营养与功能食品因子;
(责任编辑:叶红波)
