自身抗体阳性的药物性肝损害临床病理特点分析
2013-09-17王欣欣刘燕敏廖慧钰吕福东
王欣欣 刘燕敏 刘 晖 孙 琳 廖慧钰 吕福东▲
1.首都医科大学附属北京佑安医院病理科,北京 100069;2.首都医科大学附属北京佑安医院肝病免疫科,北京 100069
药物性肝损伤(DILI)是与用药有关的肝功能损伤。根据个体反应不同,DILI在严重程度、病情进展等方面有显著差异。自身免疫性肝炎(AIH)是由异常自身免疫反应介导的肝实质慢性炎症性病变。免疫介导的DILI(即伴自身免疫现象的DILI)是药物诱发免疫介导的具有AIH特征的肝损伤。三者之间既相互区别又相互联系,如何在初诊时予以鉴别、适当治疗和预测进展是临床上的重要任务。本研究回顾分析确诊为DILI患者的临床病理资料,总结分析其临床、病理特征,以期提高对本病的认识。
1 资料与方法
1.1 一般资料
选择2008年10月~2012年6月首都医科大学附属北京佑安医院收治,药物性肝损伤诊断标准(DDW标准,日本)评分值≥4分,血清自身抗体检测阳性,且均行肝穿刺活检的药物性肝损伤患者。血清及肝组织中病毒学检测均排除嗜肝及非嗜肝病毒感染,并排除酒精、非酒精性肝损伤及遗传代谢性肝病等。
经临床和病理确诊患者共31例,其中男6例,女24例,年龄 35~60 岁,平均(48.6±8.9)岁。31 例患者均有明确服药史或化学毒物接触史。其中急性DILI患者14例,慢性DILI患者17例;17例慢性患者中11例有长期服用治疗慢性疾病药物史,6例初次就诊以“急性肝损害”收入院,后经肝组织活检证实已发展为慢性损伤,经6~38个月随访其中3例因肝功能反复异常入院检查,1例进展为典型AIH。急性与慢性DILI患者年龄、性别的一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 方法
肝生化功能由我院临床检验中心检测,静脉采血3 mL,及时分离血清,做肝功能检测。使用酶联免疫吸附法进行血清病毒标志物检测。自身抗体检测由感染免疫研究中心采用间接免疫荧光法协同完成。仪器采用美国Beckman cx7全自动生化分析仪,试剂由北京中生生物工程高技术公司提供。
肝穿刺活检及免疫组化:B超引导下自动活检枪经皮穿刺取肝组织,穿刺肝组织长度>1.0 cm,且无破碎;标本采用10%中性福尔马林液及时固定,石蜡包埋,4 μm连续切片,分别做HE、Masson三色、Gomori网织纤维和D-PAS染色。免疫组化染色:鼠抗人HBsAg、HBcAg、CK19抗体均购自北京中山生物技术有限公司,均为即用型抗体,免疫组化步骤按SP免疫组化染色方法进行。设阴性对照,以磷酸盐缓冲液(PBS)代替一抗。
1.3 观察指标
总结患者一般情况,观察血清谷丙转氨酶(ALT),谷草转氨酶 (AST), 碱性磷酸酶 (ALP),γ-谷氨酰转肽酶(GGT),总胆红素(TBil),直接胆红素(DBil),球蛋白(GLB)变化。血清检测抗核抗体(ANA)、抗线粒体抗体(AMA)、平滑肌抗体(SMA)、肝肾微粒抗体 1型(LKM-1)、肝细胞胞溶质抗原1型 (LC-1)、 可溶性肝抗原 (SLA)/肝胰抗原(LP),以及 SS-A、SS-B、dsDNA 等多种抗体。光镜下个观察肝脏病理形态特点。
1.4 统计学方法
采用统计软件SPSS 13.0对数据进行分析,计量资料以均数±标准差(±s)表示,比较采用 Mann-Whitney秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 肝功能检测
将14例急性药物性肝损害与17例慢性药物性肝损害两组患者肝功能检测结果进行分析对比,经秩和检验分析,两组患者仅GLB水平差异有统计学意义(P=0.03),其余指标差异均无统计学意义(P>0.05)。见表1。
2.2 自身抗体检测
31例患者周围血中可检测到7种自身抗体,主要是ANA 20例(64.5%),其次是 SMA 6例(19.4%)、AMA 4例(12.9%);还有肝特异性膜脂蛋白 (LSP)、抗壁细胞抗体(APCA)、着丝点抗体(ACA),抗干燥综合征抗体(SSA)各 1例。急性DILI组自身抗体ANA、SMA滴度均≤1∶320。慢性DILI患者中ANA、AMA、SMA出现高滴度自身抗体,其中ANA 滴度≥1∶320者 15例,7例患者 ANA 为 1∶1000,出院后复查 ANA 滴度,4 例降至 1∶320,2 例降至 1∶100,1 例狼疮肾患者抗体滴度未改变。慢性肝损害患者中1例入院时ANA 滴度为 1∶320,出院复查已升至 1∶1000,二次肝组织活检提示慢性DILI特征伴自身免疫现象或自身免疫性肝炎。
表1 急性与慢性DILI患者肝生化指标比较(±s)

表1 急性与慢性DILI患者肝生化指标比较(±s)
注:与急性比较,*P<0.05;ALT:丙氨酸转氨酶;AST:门冬氨酸转氨酶;ALP:碱性磷酸酶;GGT:γ-谷氨酰转肽酶;TBil:总胆红素;DBil:直接胆红素;GLB:球蛋白;DILI:药物性肝损伤
DILI分型 ALT(U/L) AST(U/L)ALP(U/L)急性(n=14)慢性(n=17)521.1±387.5321.0±299.7352.5±280.9298.8±182.7133.4±50.1147.4±97.3 GGT(U/L)TBil(μmol/L)DBil(μmol/L) GLB(g/L)159.9±134.1180.6±227.9103.7±101.898.4±95.766.4±73.361.2±72.125.1±5.328.6±5.1*
2.3 肝穿刺病理活检
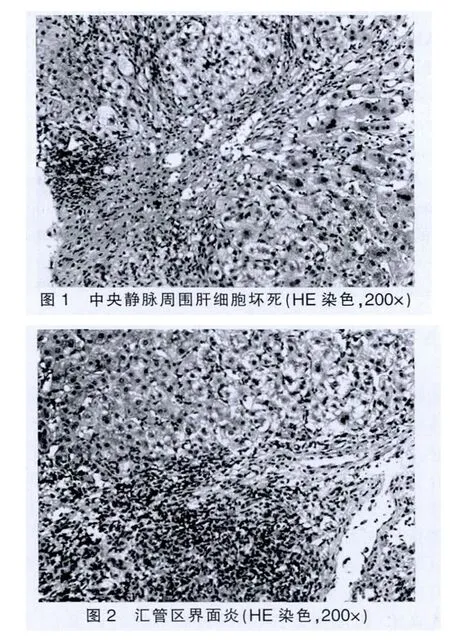
31例患者均未提示自身免疫性肝炎及原发性胆汁性肝硬化(PBC)病理特征。急性组肝活检病理主要表现为两种形式,即肝细胞型或胆管型。肝细胞型表现为小叶中心性肝细胞坏死脱失(图1),网状支架塌陷,淋巴细胞和少量浆细胞浸润,汇管区水肿,混合炎细胞(淋巴细胞、嗜酸和中性粒细胞等)浸润,可伴轻度界面炎(图2),罕见浆细胞;胆管型表现为腺泡3带为主的肝细胞内淤胆,毛细胆管胆拴形成,肝细胞坏死脱失,蜡纸样细胞浸润,汇管区水中,轻度扩大,混合炎细胞浸润,小叶间胆管破坏伴细胆管反应明显(图3)。慢性组病例主要表现为混合型,中央静脉周围肝细胞大片坏死,网状支架塌陷瘢痕形成,重者可致肝小叶结构破坏(图4),汇管区显著扩大,纤维组织增生,汇管区及塌陷瘢痕内淋巴细胞及少量浆细胞浸润,轻度界面炎伴周围细胆管反应性增生。仅靠肝穿刺小组织活检有时慢性DILI所致网状支架塌陷形成的瘢痕与病毒性肝炎肝硬化不宜鉴别,需密切结合既往临床病史和影像学检查等综合分析。
3 讨论
肝脏是药物代谢的重要器官。随着我国卫生医疗条件的改善和民众自我保健意识的提高,药物性(毒物)肝损害近年来呈上升趋势。DILI大致可以分为可预测性和不可预测性两种。可预测性DILI通常是由药物的直接毒性作用引起;不可预测性DILI常发生在一些过敏或代谢特异体质的患者,由机体免疫机制介导,病变程度与用物剂量或疗程无关。临床上患者可以出现转氨酶升高、黄疸、自身抗体出现等类似急、慢性病毒性肝炎或自身免疫性肝病表现的不同临床症状。
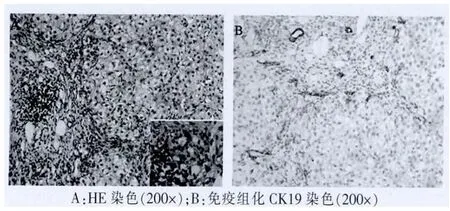
图3 小叶间胆管损伤,上皮空泡变性,周围细胆管反应性增生

图4 大片坏死后网状支架塌陷,纤维瘢痕分割肝小叶
最近,有学者将AIH和DILI的关系分为3类:免疫介导的DILI即伴自身免疫现象的DILI,指药物引发的具有AIH特征的肝损伤,临床表现为自身抗体阳性、免疫球蛋白高、肝组织界面炎明显;第二类是药物介导的AIH:指患者本身没有或有轻度的AIH,使用可疑药物后能诱导出现或加重AIH;第三类是合并DILI的AIH,指明确诊断为AIH患者同时并发DILI,鉴别诊断需要靠肝组织活检[1]。免疫介导的DILI与普通型DILI不同,也不同于AIH,部分患者经短期或锥形免疫抑制剂治疗效果好,停药后不会复发,也有一部分患者进展为典型的AIH[2]。以上病例具有以下共同特点:①患者为中老年女性,发病前有明确的用药史。②实验室检查方面,肝功异常在先,自身抗体出现在后,且自身抗体滴度可因反复用药而逐渐升高,血清球蛋白轻度升高。③肝损害起病急缓不一,停药后经保肝降酶等一般性治疗肝功能恢复快,但慢性DILI却不易降到正常。④再次用药时,短时间内即可出现类似症状,呈自身免疫介导的特异体质性肝损害表现。特异体质性DILI属于个体特异性的,动物模型不能复制,临床上缺乏过敏反应征象,发病率为 1/(103~105)[3]。有研究显示在引起 DILI的相关药物中抗生素、解热镇痛类药、中药、抗肿瘤药和降糖药占到约70%[4-6]。国内学者胡锡琪[7]借鉴慢性肝炎评分系统,非酒精性脂肪性肝病活动度评分和国际自身免疫性肝炎评分方法,总结出药物性肝炎病理学5阶评估法,将DILI的病理诊断分为不可能、可能、很可能和明确的DILI,并于今年3月重新修正,为DILI的病理诊断提供重要依据。AIH与免疫介导的DILI在组织学上有一定的相似之处,均表现为界面性肝炎、淋巴细胞、浆细胞、嗜酸粒细胞浸润,小叶中心性坏死等,但Suzuki等[8]的研究结果显示两者在组织学上仍有显著差异性。Ju等[9]研究了29例肝功异常且有用药史患者的血清学和组织学特点,其中组织学诊断DILI 21例和AIH 8例,发现两组间血清AST、GLB和凝血酶原时间有显著差异,7例 (30%)DILI伴 ANA抗体阳性,8例(100%)AIH患者ANA抗体阳性,提示肝功能异常且有用药史的患者,不能除外AIH的可能,肝活检对鉴别诊断有重要作意义。
特异质性肝细胞毒素的许多机制现已阐明:包括有药物代谢性个体遗传变异,以及出现对药物及其代谢产物产生免疫反应[10]。这类DILI主要是药物引发免疫介导的肝损伤,细胞色素450酶(CYP450)是参与药物代谢的主要酶系,包括各种同工酶,如抗-LKM1和抗-LKM2、ANA和SMA等,药物活性代谢产物可能通过对肝脏细胞色素P450系统酶的绑定产生新生抗原诱导免疫反应。而自身抗体是AIH诊断的重要指标,临床根据ANA、SMA、LKM1和LKM2不同阳性抗体的出现分为Ⅰ、Ⅱ、Ⅲ型AIH。本研究显示,DILI中最常出现的抗体是 ANA (66.7%)、SMA(16.7%)和 AMA(19.4%)[11]。
由于伴自身免疫现象的DILI在诊断时缺乏特异性,DILI的药物中毒因果关系评价困难[12],容易被漏诊或误诊,尤其是与非典型性自身免疫性肝病的鉴别。对本病的早期诊断主要在于详细的询问病史,提高对本病的警惕性,及时的肝穿刺活检对诊断和鉴别诊断具有重要意义。除此之外,关于糖皮质激素在这类患者中的治疗时机及治疗疗程,因缺乏指导治疗和疗效评判的客观指标,目前临床仍有困惑和争论。总之,药物诱导的肝损伤个体差异大,临床表现不一,甚至可以成为各种原发性肝病的诱因,因此对DILI的认识还有待提高。
[1]Weiler-Normann C,Schramm C.Drug induced liver injury and its relationship to autoimmune hepatitis[J].J Hepatol,2011,55(4):747-749.
[2]Wree A,Dechene A,Herzer K,et al.Steroid and ursodesoxycholic acid combination therapy in severe drug-induced liver injury[J].Digestion,2011,84:54-59.
[3]Uetrecht J.Immunoallergic drug-induced liver injury in humans[J].Semin Liver Dis,2009,29(4):383-392.
[4]Andrade RJ,Lucena MI,Fernandez MC,et al.Drug-induced liver injury:an analysis of 461 incidences submitted to the Spanish registry over a 10-year period[J].Gastroenterology,2005,129:512-521.
[5]Shigeto E.Survey of anti-tuberculosis drug-induced severe liver injury in Japan[J].Kekkaku,2007,82:467-473.
[6]王淑珍,刘燕敏,闫惠平,等.儿童反复肝功能异常伴肝肾微粒体抗体阳性[J].中华检验医学杂志,2012,35(3):280-282.
[7]胡锡琪.药物性肝损伤组织病理学评分探讨[J].中华肝脏病杂志,2012,20(3):176-177.
[8]Suzuki A,Brunt EM,Kleiner DE,et al.The use of liver biopsy evaluation in discrimination of idiopathic autoimmune hepatitis versus drug-induced liverinjury[J].Hepatology,2011,54(3):931-939.
[9]Ju HY,Jang JY,Jeong SW,et al.The clinical features of drug-induced liver injury observed through liver biopsy:focus on relevancy to autoimmune hepatitis[J].Clin Mol Hepatol,2012,18(2):213-218.
[10]Ohira H,Takahashi A.Current trends in the diagnosis and treatment ofautoimmunehepatitisinJapan[J].HepatolRes,2012,42(2):131-138.
[11]杨建轩,闫惠平,檀玉芬.药物性肝损伤患者的自身抗体分析[J].临床荟萃,2008,23(14):992-995.
[12]刘燕敏.药物性肝损害伴自身抗体阳性患者临床特征及转归[J].临床肝胆病杂志,2012,28(5):335-338,342.
[13]戴维佳,赖荣陶,王晖,等.113例药物性肝损害临床特征及影响因素分析[J].临床肝胆病杂志,2011,27(10)1058-1061,1065.
[14]Rolf T,Christian F,Johannes S,et al.Herbal hepatotoxicity:Challenges and pitfalls of causality assessment methods[J].World J Gastroenterol,2013,19(19):2864-2882.
