顺铂预处理对C I K杀伤非霍奇金淋巴瘤细胞的影响
2013-09-17陈慧玲李志虎张连生
王 昊 柴 晔 陈慧玲 李志虎 张连生
兰州大学第二医院血液科,甘肃兰州 730000
非霍奇金淋巴瘤作为一种恶性肿瘤日益危害着人类的健康,如何治疗和提高治疗效果成为临床医务工作者的研究关键。大量的临床和临床前期研究表明顺铂 (cisplatinum-diamino-dichloride,DDP)和细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)具有显著的抗肿瘤作用[1-2],且治疗非霍奇金淋巴瘤具有良好效果[3]。DDP预处理可以增强CIK细胞对部分癌细胞的杀伤作用[4-6]。本文研究目的主要是通过细胞体外培养的方法研究经顺铂预处理后,是否可以增强CIK细胞杀伤淋巴瘤细胞的杀伤活性,为临床应用化疗联合CIK细胞治疗非霍奇金淋巴瘤提供实验依据。
1 材料与方法
1.1 材料
DDP购自齐鲁制药(海南)有限公司(批号:A1A1212052);重组人白介素-2(IL-2)购自山东泉港药业有限公司(批号:201207003);γ 干扰素(IFN-γ)购自上海凯茂生物有限公司(批号:20121110);抗CD3单克隆抗体购自Bioscience公司(批号:E06304-1633);CellTraceTMCFSE Cell Proliferation Kit(C34554)购自 Invitrogen 公司(批号:1255942);碘化丙啶 (PI)购自碧云天生物技术研究所 (编号ST511);RPMI1640购自GIBCO公司(批号:1161726);胎牛血清购自浙江天杭生物科技有限公司(批号:121122);淋巴细胞分离液购自MP公司(批号:V0711A);流式细胞仪为美国BD产品。
1.2 实验细胞
人类非霍奇金淋巴瘤细胞株Namalwa(Burkitt淋巴瘤细胞株)、SU-DHL-4(弥漫大B淋巴瘤细胞株)均购自上海交通大学医学院附属仁济医院白血病研究室。实验细胞株于含10%胎牛血清的RPMI1640培养液中,在37℃、5%CO2、饱和湿度培养箱中培养,每3天传代1次,取对数生长期细胞进行实验。
1.3 CIK细胞体外培养
抽取健康人外周血50 mL,使用密度梯度离心方法分离外周血取得单个核细胞,把细胞浓度调整为1×106/mL进行后续培养,第1天加入IFN-γ 1000 U/mL,置于37℃,5%CO2,饱和湿度条件下培养24 h,然后分别加入重组人白介素-1(IL-1)100 U/mL、重组人 IL-2(IL-2)500 U/mL、抗CD3单克隆抗体50 ng/mL,在37℃、5%CO2、饱和湿度培养箱中进行培养。以后每3天半量更换新鲜培养液,并补加重组人IL-2,细胞密度调整至1×106/mL,培养期间用流式细胞仪监测细胞免疫表型变化。
1.4 四种DDP浓度预处理后CIK杀伤效果影响
分别向Namalwa细胞、SU-DHL-4细胞中加入浓度为0、25、50、75 μg/L 的 DDP 培养 18 h,再加入 CIK 细胞,CIK细胞与淋巴瘤细胞的效靶比为20∶1,用CFSE/PI双标法测CIK细胞对靶细胞的杀伤作用。
1.5 三种DDP时间预处理后CIK杀伤效果
分别向Namalwa细胞、SU-DHL-4细胞中加入浓度为25 μg/L 的 DDP,再分别培养 18、24、36 h 后,加入 CIK 细胞,CIK细胞与淋巴瘤细胞的效靶比为20∶1,用CFSE/PI双标法测CIK细胞对靶细胞的杀伤作用。
1.6 流式细胞仪监测CIK细胞免疫表型变化并检测CIK细胞对靶细胞的杀伤效果
CIK培养期间用流式细胞仪监测细胞免疫表型变化。细胞样本采用CFSE/PI双标法进行检测。分别收集处理后的细胞样本上流式细胞仪进行检测,取30000~50000个细胞进行分析。CFSE的荧光强度在流式检测时是用FL1荧光通道检测,PI的荧光强度则是通过FL2荧光通道检测。CFSE,PI双阳性的细胞为被杀伤的靶细胞,除以靶细胞总分数,即为杀伤率。实验重复4次,取4次实验平均值进行分析。
1.7 统计学方法
采用统计软件SPSS 15.0对实验数据进行分析,计量资料数据以均数±标准差(±s)表示,采用方差分析,两两比较采用LSD-t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 CIK细胞的培养
细胞换液时进行无菌检测(细菌、真菌、支原体、病毒等),并取少量CIK细胞培养物加入相应检测抗体混匀,避光放置25 min后,上流式细胞仪进行检测,结果显示CIK细胞在培养 21 d 左右时,CD3+、CD56+和 CD3+CD8+的细胞比例均较理想,细胞活性可保持96%以上,可持续至25 d左右,所以本实验选择培养21 d时的CIK细胞进行实验,见图1。

图1 杀伤细胞的免疫表型
2.2 四种DDP浓度预处理后CIK杀伤效果影响
细胞生长达70%融合时,分别向Namalwa细胞、SU-DHL-4细胞中加入浓度为 0、25、50、75 μg/L 的 DDP 培养 18 h,Namalwa 细胞死亡率为 0、(2.70±0.35)%、(7.03±1.40)%、(8.450±0.93)% ,SU-DHL-4 细 胞 死 亡 率 为 0、 (2.30±0.60)%、(5.03±0.84)%、(8.15±0.88)%。加入 CIK 细胞(与淋巴瘤细胞的效靶比为20∶1),CIK联合四种浓度的DDP杀伤 Namalwa 细 胞的 杀伤 率为 (14.18±2.38)%、(30.73±2.63)%、(43.78±2.52)%、(51.53±1.98)%,杀伤 SU-DHL-4细胞的 杀伤 率为 (13.00±3.34)%、(29.00±2.28)%、(41.75±2.62)%、(50.03±0.90)%(图 2)。结果显示,DDP 预处理浓度增加,CIK杀伤靶细胞效应增强。
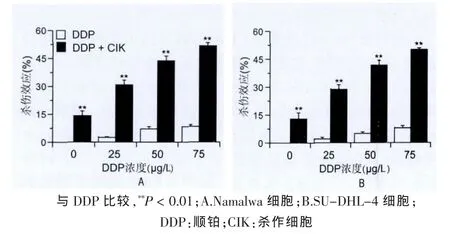
图2 不同浓度顺铂预处理,杀伤细胞对淋巴瘤细胞的杀伤作用
2.3 三种DDP时间预处理后CIK杀伤效果影响
在两种淋巴瘤细胞中分别加入25 μg/L的DDP分别培养 18、24、36 h,DDP 对 Namalwa细胞杀伤率分别为(2.70±0.35)%、(4.47±1.02)%、(5.83±0.78)%,DDP 对 SUDHL-4细胞的杀伤率分别为(2.30±0.60)%、(3.50±1.17)%、(5.43±0.66)%。加入 CIK 细胞(与淋巴瘤细胞的效靶比为20∶1),在不同时间点,DDP联合CIK对Namalwa细胞的杀伤效应为 (30.73±2.63)%、(40.75±2.33)%、(46.70±3.74)%,对 SU-DHL-4 细胞的杀伤效应为(29.00±2.28)%、(39.35±1.79)%、(42.40±3.04)%。结果显示,DDP 作用靶细胞24 h后,有显著的靶细胞死亡。随着DDP预处理时间延长,再联合CIK细胞,靶细胞的死亡率增加(图3)。

图3 不同时间DDP预处理,CIK对淋巴瘤细胞的杀伤作用
3 讨论
DDP被广泛应用于临床,但需很高剂量,顺铂的药理作用才能发挥,治疗过程中会出现许多不良反应,例如恶心、呕吐、食欲减退、肾及泌尿系损害等[7]。怎样使化疗增效,成为研究者的难题。1991年,一类由多种细胞因子诱导的杀伤细胞由斯坦福大学的Schmidt等[8]首先报道。长期大量研究表明CIK细胞具有可大量增殖、对多种肿瘤细胞杀伤活性强大、非MHC限制性、对自身组织无细胞毒作用等优点[9-10]。CIK为多种细胞混合体,其杀伤机制为,CIK细胞在受到刺激时,会释放以CD3+CD56+双阳性细胞为最大颗粒释放量的具有细胞毒性的胞质颗粒物,作为外源性局部定向的细胞溶解毒素,通过细胞膜渗透,直接杀伤肿瘤细胞。CIK细胞活化后产生大量炎症细胞因子,如TNF-α、IL-2、GM-CSF等,既可直接抑制肿瘤细胞,又可通过调节机体免疫系统反应,间接杀伤肿瘤细胞。许多肿瘤细胞表达FasL,诱导免疫效应细胞凋亡,使免疫治疗成功性减低。体外培养过程中,CIK细胞表达FasL,可以通过对FasL阳性肿瘤细胞的诱导凋亡,长期慢性杀伤肿瘤细胞,也对FasL阳性肿瘤所致的凋亡有对抗作用[11-13]。
近年来,已有化疗联合CIK细胞协同治疗肿瘤的相关报道,可提高肺癌、乳腺癌、胃癌、恶性黑色素瘤等的治疗效果[4-5,14]。本实验研究经顺铂预处理后对CIK细胞杀伤非霍奇金淋巴瘤细胞的影响。实验选取人类NHL细胞Namalwa细胞、SU-DHL-4细胞,经不同DDP浓度及时间预处理后,发现CIK杀伤靶细胞效应随DDP浓度增加、时间延长均增强。实验显示低浓度、短时间DDP对靶细胞的杀伤效果欠佳,但联合CIK后可使靶细胞明显死亡。据文献报道,其增效作用可能依赖于机体T淋巴细胞。内源性T淋巴细胞群包含两部分,即肿瘤抑制性及促进性亚群。肿瘤抑制性T淋巴细胞亚群可与CIK细胞共同抑制肿瘤细胞生长。DDP预处理后,可促进发生免疫调节性肿瘤抑制作用,并可增强CIK免疫治疗疗效。Treg为重要肿瘤促进性T淋巴细胞亚群细胞,DDP预处理后,肿瘤微环境中的比例下降,促进免疫应答发生,抑制肿瘤生长[15]。
综上所述,与单用CIK细胞治疗相比,DDP预处理后联合CIK对淋巴瘤细胞更具杀伤作用,可大幅提高肿瘤细胞的杀伤率。本实验可进行进一步研究,更好地为化疗联合免疫治疗的临床应用提供依据。
[1]姜文奇,何友谦,管忠震,等.铂单药和联合化疗治疗恶性肿瘤529例报告[J].癌症,1993,12(3):22.
[2]李淑艳,邢淑贤.CIK细胞的特点及其在肿瘤生物治疗中的作用[J].癌变畸变突变,2007,19(5):424-426.
[3]石朝生,王俊生,祁文彬,等.顺铂为主治疗非何杰金型恶性淋巴瘤32 例近期疗效分析[J].河南肿瘤学杂志,1991,4(4):41-42.
[4]陈景,黄香,宋海珠,等.顺铂预处理化疗通过免疫调节增强CIK细胞对B16恶性黑色素瘤的抑制作用[J].癌症进展,2011,9(6):631-638,645.
[5]朱正秋,范凡,蔡红星,等.CIK细胞联合顺铂对胃癌SGC-7901/DDP细胞的体外杀伤作用[J].江苏医药,2011,37(23):2747-2750.
[6]吴霞.化疗对肿瘤免疫治疗的增益作用[J].中国肿瘤生物治疗杂志,2007,14(1):90-93.
[7]柳萌,杨迪生.顺铂耐药机制的研究进展[J].现代中西医结合杂志,2007,16(6):856-858.
[8]Schmidt IG,Lefterova P,Mehta BA,et al.Phenotypic characterization and identification of effector cells involved in tumor cell recognition of cytokine-induced killer cells [J].Exp Hematol,1993,21 (13):1673-1679.
[9]任欢,邢淑贤,李殿俊,等.CIK的体外增殖及体内外杀瘤活性的实验研究[J].中国肿瘤生物治疗杂志,1999,6(1):17-21.
[10]Schmidt IG,Lefterova P,Negrin RS,et al.Sensitivity of multidrug-resistant tumor cell lines to immunologic effector cells[J].Cell Immunol,1996,169(9):85-90.
[11]于津浦,任秀宝.CIK细胞-肿瘤过继免疫治疗的新希望[J].中国肿瘤临床,2001,28(7):557-560.
[12]Margolin KA,Negrin RS,Forman SJ,et al.Cellular im-munotherapy and autologous transplantation for hematologic malignancy[J].Immunol Rev,1997,157:231-240.
[13]杨永红,李慧芳.细胞因子诱导的杀伤细胞的研究进展[J].白血病·淋巴瘤,2003,12(2):116-119.
[14]徐本玲,高全立,袁龙,等.顺铂预处理对CIK杀伤肺癌细胞的影响[J].肿瘤防治研究,2011,38(7):756-760.
[15]黄香,黄桂春,宋海珠,等.顺铂以T细胞依赖性方式增强CIK细胞的抗肿瘤作用[J].癌症进展,2011,9(6):639-645.
