奶牛体细胞核移植胚胎产业化生产条件优化
2013-09-13孙伟巴特尔郭继彤李荣凤王建国李明胡树香王春生李喜和
孙伟 巴特尔 郭继彤 李荣凤 王建国 李明胡树香 王春生 李喜和,3
到目前为止,绵羊[1]、山羊[2]、牛[3]、猪[4]、小鼠[5]、]马〔6〕、骆驼[7]及马鹿[8]等多种动物通过体细胞核移植技术获得了健康成活的后代。体细胞克隆技术是利用供体动物细胞的DNA作为基因表达的模板,可以使克隆后代与供体动物的遗传性状完全相同,从而使动物品种的优良性状得以复制,所利用该技术进行良种动物遗传资源的扩繁产业前景广阔。
伴随着国内乳品企业规模的迅速扩张,对抗病力强、生产性能优秀的高产奶牛的遗传资源需求量增加,同时由于美加系高产活体奶牛进口的限制,只有通过引进高产奶牛细胞系,利用体细胞克隆技术与胚胎移植技术结合是实现高产奶牛快速扩繁的捷径,达到高效组建高产奶牛核心群的目的。目前,奶牛克隆胚胎重构存在技术操作繁琐,生产效率低等问题,要想实现产业化,必须简化操作程序,提高整体效率。本试验拟对高产奶牛克隆胚胎生产关键环节进行系统优化,以达到简化操作程序和提高效率为目的,为获得批量、高质量的高产克隆奶牛后代奠定了技术基础。
1 材料与方法
1.1 材料
1.1.1 试剂、仪器及配方 TCM199(Gibco,11150-059),FSH(Sigma,F8174),17-β-E2(Sigma,E8-875),FBS(Gibco,16000-036),Cytochalasin-B(Sigma,C6762),Hyaluronidase(Sigma,H4272),Sodium pyruvate(Sigma,P3662),D-Mannitol(Sigma,M9546),6-DMAP(Sigma,D2629),Ionomycin(Sigma,10634),Peni/Strep(100×)(Gibco,150-70),BSA(Austrilian,ICP/biologicals AVIVP-100G),99.999%混合三气(5%CO2-5%O2-90%N2)(北京普莱克斯适用气体有限公司)。
体视显微镜(NIKON,SMZ1500),显微操作仪(日本NIKON,TE2000),细胞融合仪(澳大利亚公司生产,IP-1)。
成熟液组成 :TCM199+10% FBS+1μg/mL 17-β-E2+10mmol/L Hepes+0.12mg/mL Pyruvate+0.1mg/mL Strepolin+0.125mg/mL penicilla-mine+10μg/mL FSH)。
融合液组成:0.25mmol/L D-C6H14O6,0.5mmol/L Hepes,0.05mmol/L(C2H3O2)Mg·4H2O,0.01%BSA,0.1mmol/L Ca(C2H3O2)2。
发育液组成:107.7mmol/L NaCl,7.15mmol/L KCl,0.3mmol/L KH2PO4,25mmol/L NaHCO3,3.32mmol/L sodium lactate,0.04mmol/L kanamycinmonosulfate,0.33mmol/L pyruvate,1.71mmol/L CaCl2·2H2O,6mmol/L fatty-acid free bovine albumin,0.001mmol/Lheparin,0.2mmol/L penicillamine,0.1mmol/L Strepolin。
1.1.2 卵巢采集 卵巢采集于呼和浩特市郊区清真屠宰场。采集的卵巢保存于25-30℃灭菌生理盐水保温瓶中,在4h内运至实验室。
1.1.3 奶牛耳组织的采集 供体成纤维细胞采自旭日牧场620#高产奶牛(第1胎,3岁,产量12 t/年)和昭君牧场001#高产奶牛(第5胎,9岁,产量15 t/年)耳皮组织。
1.2 方法
1.2.1 卵母细胞的采集 在无菌条件下用灭菌生理盐水冲洗卵巢3-5次,常规16号针头的10mL注射器先吸少量PBS溶液,抽吸卵巢表面2-6mm卵泡,将抽吸的卵泡液注入15mL的离心管中,在37℃水浴锅中静置10min,然后在体视显微镜下捡卵。选择A、B级卵丘卵母细胞复合体(COCS)进行成熟培养。
1.2.2 卵母细胞的体外成熟 将A、B级COCs在成熟液中洗涤3遍,移入预先在CO2培养箱中平衡好的含有成熟液的4孔板中。每个孔中80-100枚COCs,放入培养条件为38.5℃、5%CO2、饱和湿度的培养箱中进行成熟培养。成熟培养17h后把卵母细胞移入含0.25%透明质酸酶的H-M199中作用3-5min,用200μL的移液器轻轻反复吹吸去除卵球细胞,然后用含10%FBS的TCM199清洗卵母细胞。在显微镜下检查成熟情况,以排出第一极体为成熟的标志,用于克隆胚胎重构。
1.2.3 成纤维细胞系的建立和核移植前准备 将耳部皮肤组织块放入含40μg/mL庆大霉素的PBS缓冲液中,带回实验室在超净台中洗涤和清理后,用眼科剪切成1mm3大小的组织块,接种在细胞培养瓶。倒置培养瓶后在培养箱内静置4h,然后加入5mL含10%FBS的DMEM/F12的培养液,放入37℃、5%CO2、饱和湿度培养箱内静置培养10-12d,每3d换一次新鲜培养液。成纤维细胞汇合并铺满瓶底,这时可传代进行纯化。根据上皮细胞与成纤维细胞对酶消化敏感性不同及二者贴壁速度的差异,可将二者分离纯化。在混合生长的原代或传代细胞培养中,吸掉培养瓶中的培养液,加入无血清DMEM/F12清洗,再用1.5mL胰蛋白酶(TE)消化液覆盖细胞,37℃消化3-5min。在倒置显微镜下观察细胞回缩时立即加入10%FBS的DMEM/F12培养液3mL终止细胞消化,然后用移液器吹打分离悬浮细胞并在1500r/min条件下离心5min,加入培养液把细胞的密度调整到(5-10)×104个/mL,再接种培养,通过2-3 次选择传代,可完全纯化成纤维细胞与上皮样细胞,建立成纤维细胞系。
供体成纤维细胞采用两种处理方法。血清饥饿法是当细胞长到70%-80%汇合时,用含0.5% FBS的DMEM/F12饥饿处理3d后,胰酶消化成单细胞悬液待用。非血清饥饿法是细胞长到70%-80%汇合时,直接利用胰酶消化获得细胞悬液,离心后用含HEPES的操作液50μL悬浮细胞并置于4℃保存用于移核。
1.2.4 体细胞核移植 采用盲吸法和荧光染色辅助两种方法去核。盲吸法是先用7.5μg/mL CB液处理卵母细胞5min,然后用TCM-199清洗3遍置于覆盖石蜡油的10%FBS的H-M199的操作滴中,同时加入供体细胞。在显微操作系统下,用持卵针吸住卵母细胞,去核针插入卵内吸去第一极体及其附近少量胞质,将供体成纤维细胞直接注射到去核卵母细胞透明带下,并用针轻轻触压使供体细胞与细胞膜紧密接触。荧光染色辅助去核法是用10μg/mL Hoechst 33342染色处理卵母细胞5min,然后置于操作滴中在UV的照射下,卵母细胞的细胞核被激发荧光,可用去核针彻底吸除细胞核物质,再把供体细胞注入卵母细胞透明带下进行卵子的重构。
1.2.5 重构胚胎融合 细胞核移植后的重构胚胎置于融合液中平衡2min,然后转入充满融合液的融合槽(规格-0.5mm),用封闭的毛细管调整方向,使细胞接触面与电极平行,设定电压2.5 kV/cm,脉冲时间为20 μs。待融合完毕,用含10% FBS的H-M199洗3遍,再置于成熟液中,继续在CO2培养箱培养15-20min后镜检融合情况。
1.2.6 克隆胚胎的激活与体外培养 将融合的重构胚胎用5μmol/L离子霉素处理5min、2mmol/L 6-DMAP联合激活处理4h,然后将重构胚置于覆盖石蜡油的SOFaa培养液的4孔板中培养,每孔放入30枚重构胚/0.5mL。培养气相条件一种是置于38.5℃、5%CO2饱和湿度;另一种是38.5℃、5%CO2-5%O2-90%N2饱和湿度。48h后检查卵裂情况,连续培养7d检查囊胚发育情况。
1.2.7 数据处理 利用卡方检验对试验数据进行统计学处理。
2 结果
2.1 两种去核方法对牛重构胚胎发育的影响
试验结果见表1。荧光染色辅助和盲吸法两种去核方式去核率(100%,92.44%)、融合率(57.09%,61.61%)、卵裂率(75.17%,76.81%)以及囊胚率(24.83%,28.26%)之间均无显著差异(P>0.05)。但是荧光染色法辅助去核增加了核移植的操作步骤,而且UV照射对克隆囊胚的后期发育及克隆动物产生的影响尚具有不确定性,故本研究认为采用盲吸法有利于重构胚胎的发育,简化了操作程序,同时提高了效率(图1)。
2.2 不同年龄供体牛细胞系对牛重构胚胎发育的影响
分别以第一胎620#高产奶牛成纤维细胞系A和高产第5胎001#成纤维细胞系B为供体进行核移植,比较这两种不同年龄供体牛的细胞对核移植重构胚胎发育的影响。结果见表2,成纤维细胞系A和成纤维细胞系B为供体的重构胚的融合率分别为61.95%、71.15%,卵裂率分别为81.43%、67.57%,囊胚发育率分别为31.43%、25.68%两者之间均无显著差异(P>0.05)。结果表明供体牛的年龄对核移植后重构胚的融合以及发育的影响均不显著,但以成纤维细胞A有一定的升高的趋势(图2)。

表1 不同去核方式对牛重构胚胎发育的影响

图1 Hoechst 33342染色的MII卵母细胞(A)及Hoechst 33342染色的MII卵母细胞辅助去核(B)

表2 不同年龄牛的供体细胞对重构胚胎发育的影响
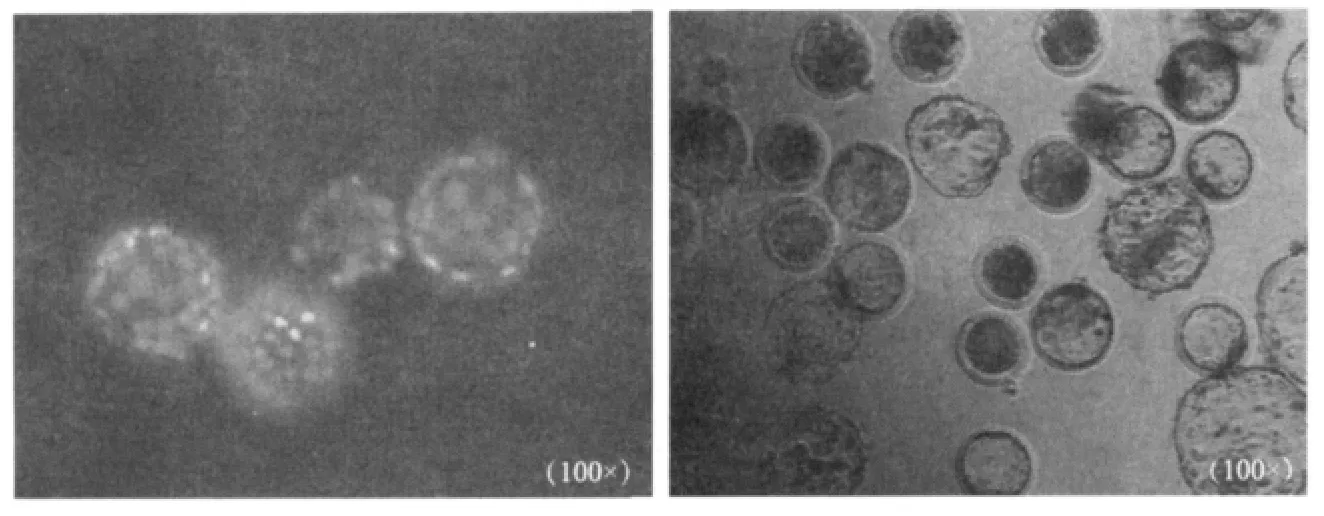
图2 Hoechst 33342荧光染色的牛克隆孵化囊胚(A)及发育7d的牛克隆囊胚(B)
2.3 供体细胞同期处理与否对牛重构胚胎发育的影响
用血清饥饿3d和未经血清饥饿的牛耳成纤维细胞为供体细胞进行核移植重构克隆胚胎,比较供体细胞同期处理对克隆胚胎发育的影响结果,见表3。以血清饥饿3d的细胞和未经血清饥饿的细胞为供体的重构胚融合率分别为74.63%、58.62%,卵裂率分别为71.33%、80.88%,囊胚发育率分别为24.00%、29.90%两者之间均无显著差异(P>0.05)。结果表明供体细胞的血清饥饿与否对核移植后重构胚的融合以及发育的影响均不显著,但就其卵裂率及囊胚率未饥饿处理组效果较好。

表3 供体细胞的血清饥饿处理对牛重构胚胎发育的影响
2.4 不同气相组成条件对牛重构胚胎发育的影响
形态良好的重构胚分别在5% CO2-5%O2-90%N2和5%CO2-AIR两种气相中进行发育培养,第2天记录卵裂情况,第7天统计囊胚率。结果见表4,重构胚在5%CO2-5%O2-90%N2和5%CO2-AIR气相中进行发育的卵裂率分别为82.35%、75.22%,囊胚发育率分别为31.55%、28.26%两者之间均无显著差异(P>0.05)。两种气相组成对重构胚后期发育的影响差异并不显著,但从试验数据看5%CO2-5%O2-90%N2对牛重构胚的后期发育有一定的促进作用。

表4 体外培养不同气相组成对牛重构胚胎发育的影响
3 讨论
体细胞核移植受体卵母细胞去核是克隆胚胎构建的关键步骤。在牛克隆胚胎的构建过程中通常采用盲吸法和荧光染色进行去核处理。一般认为荧光染色去核是通过荧光染料(Hochest33342)染细胞核DNA后在UV紫外光照射下引导去核,操作时间比较长,不利于去核效率的提高,而且UV照射对克隆胚胎的发育也可能会产生不利的影响。而盲去核法操作效率高、避免了UV照射对后期克隆胚胎发育的负面影响,如果处理时卵子成熟的时间太长会降低去核效率。本研究为了准确把握极体与卵母细胞核的对应位置关系,达到盲吸准确去核的目的,控制卵母细胞成熟时间在17h内。同时,在成熟培养前对卵母细胞进行了严格的筛选。试验结果证明,成熟17h后多数卵子的极体刚排出,极体基本与核相毗邻,随着成熟时间的延长会出现第一极体与核相对位置的偏移,则不利于盲吸法去核。 因此,在进行牛克隆胚胎重构时,选择17h的卵母细胞成熟时间进行盲吸法去核,可以更有效地重构克隆胚胎。
目前,动物克隆存在孕期流产率与围产期胎儿死亡率高,胎儿过度的发育和出生后生长发育异常等问题,推测其主要原因是在核移植重构克隆胚胎的发育过程中供体细胞核的不完全重编程[9]。细胞核重编程包括分化(differentiation)、去分化(dedifferentiation)以及转分化(transdifferentiation)3个方面[10]。去核卵胞质为已分化的供体细胞提供表观遗传修饰的环境,激活对胚胎早期发育是有重要作用的基因,并抑制与分化相关的基因的表达,使单个分化的细胞发育成一个正常的胚胎和个体。有关研究指出,可能由于供体细胞在细胞更新过程中,某些特定的基因会随着个体的生长而出现选择性的表达,因此选用“年龄大”的供体细胞,在重构胚发育过程中会受到供体细胞基因本身活性的影响,某些对胚胎发育至关重要的基因在个体发育生长过程中处于低活性时期,对供体细胞的重编程不利[11]。对于奶牛的克隆,目前供体细胞的来源主要通过采集产奶牛的耳皮组织或超排活体采卵获得卵球细胞两种现实可行的途径。本试验采集了年龄差异较大的奶牛耳皮组织建立成纤维细胞系,并利用这两种细胞系构建了克隆胚胎,尽管在统计学上没有显著差异,但是利用年龄较小的成年牛细胞系为供体的囊胚发育率相对高些。是否是由于年龄的差异可能导致细胞的分化程度不同,以及对细胞重编程效率的差异还有待于进一步研究证实。
在动物克隆研究中,供体细胞的周期对克隆效率的影响众说不一,普遍认为位于细胞周期的G0/G1期的二倍体细胞对于核移植中供体细胞的重编程是必需的。主要通过血清饥饿将细胞诱导至G0/G1期,世界首例体细胞克隆绵羊Dolly就是通过血清饥饿诱导供体细胞到G0/G1期获得健康后代。Cibelli和 Vignon等[3,12]不经饥饿同样得到了克隆动物。本研究中贴壁培养的细胞经过3-4d无血清饥饿,细胞的形态和大小发生了变化,经血清饥饿的细胞在胰蛋白酶消化以后细胞的大小比较一致,但细胞在操作时细胞的膜的耐受性差易破膜,而且融合效果和胚胎发育率都不是很理想。由于第一次融合率低,导致重构的胚胎进行第二次融合,克隆胚胎在融合液中滞留的时间增长,可能影响了克隆胚胎后期的发育。也就是说,细胞同期化处理对于重构胚胎效率并没有显著作用。Beyhan 等[13]认为,长时间低血清浓度处理可能破坏核细胞内DNA结构,影响核移植成功率。目前,由于S期细胞处于DNA合成阶段,重构胚易形成2倍化和4倍化之间的非整倍体动物,而没有克隆动物个体的报道以外,其它G1、G2和M期[14]的细胞都被证明可作为供体用于克隆研究。本研究认为细胞同期与否对克隆胚胎发育没有显著的影响,可以采用非血清饥饿的方法处理供体细胞进行克隆胚胎构建。
目前,多数实验室用于培养牛克隆胚胎的气相条件都是饱和湿度的培养箱中5%CO2和空气的混合气体,但也有使用标准气相(5%CO2-5%O2-90%N2)组成进行体外胚胎的培养取得了良好的效果。在生理环境下,生殖管道并非与外界空气相交通。根据不同的研究报道,兔输卵管腔内的氧气浓度为2%-6%,仓鼠和猕猴输卵管内氧的浓度为8%。而子宫内的氧浓度显然低于输卵管,仓鼠和兔为5%,猕猴为1.5%。对于多数哺乳动物的研究表明,降低氧气浓度可以促进胚胎在体外的发育,这种现象在反刍动物中更明显。降低氧气浓度至5%-8%会促进多种动物胚胎发育至囊胚阶段[15]。Varisangal等[16]对培养的气相条件进行了探索,他们使用一种负压气相条件(5% CO2、8%-10% O2、300mmHg)培养重构克隆胚胎,比常压气相条件可显著地提高囊胚发育率。该研究说明其原因可能是牛发情时子宫和输卵管处于紧张状态,子宫官腔中产生一定程度的负压,该环境对初期胚胎的减数分裂具有支持作用。Machaty等[17]比较了两种气体对猪胚胎体外发育的影响,结果表明,5%CO2-Air更有利于猪胚胎的发育。本研究的结果表明,虽然两种气相组成对牛克隆胚胎囊胚发育率的影响差异不显著,但是5%CO2-5%O2-90%N2气相组成更有利于囊胚发育。同时这种标准气相采用密闭的充气袋进行体外培养,其优点是使用方便、用量少,而且在封闭的环境中不受培养箱内气体浓度的变化而影响胚胎的发育,更接近体内胚胎发育的气相组成。
4 结论
供体组织来源、供体细胞同期与否以及受体去核方式对核移植胚胎发育没有显著的影响。培养的供体细胞直接注入到成熟17h后的盲吸去核后的受体卵子透明带下构建克隆胚胎,克隆胚胎在密封的混合三气(5%CO2-5%O2-90%N2)的气相组成下进行体外培养,能保持稳定的囊胚发育率。即简化了核移植的程序,同时有利于奶牛克隆技术产业化应用。
[1] Wilmut I, Schnieke AE, McWhir J, et al.Viable offspring derived from fetal and adultmammalian cells[J].Nature, 1997, 385(6619):810-813.
[2] Baguisi A, Behboodi E, Melican AD, et al.Production of goats by somatic cell nuclear transfer[J].Nature Biotech, 1999, 17(5):456-461.
[3] Cibelli JB, Stice SL, Golueke PJ, et al.Cloned transgenic calves produced from nonquiescent fetalfibroblasts[J].Science, 1998,280(5367):1256-1258.
[4] Betthauser J, Forsberg E, Augenstein M, et al.Production of cloned pigs from in vitro systems[J].Nature Biotech, 2000, 18(10):1055-1059.
[5] Wakayama T, Yanagimachi R.Cloning ofmalemice from adult tailtip cells[J].Nat Genet, 1999, 22(2):127-128.
[6] Galli C, Lagutina I, Crotti G, et al.Pregnancy:a clonedhorse born to its dam twin[J].Nature, 2003, 424(6949):635.
[7] Wani NA, Wernery U, Hassan FA, et al.Production of the first cloned camel by somatic cell nuclear transfer[J].Biology of Reproduction, 2010, 82(2):373-379.
[8] Berg DK, Li CY, Asher G, et al.Red Deer cloned from antler stem cells and their differentiated progeny[J].Biology of Reproduction,2007, 77(3):384-394.
[9] RideoutIII WM, Eggan K, Jaenisch R.Nuclear cloning and epigenetic reprogramming of the genome[J].Science, 2001, 293(5532):1093-1098.
[10] 郝振华, 伊璐, 刘红林, 等.哺乳动物细胞核编程方法学研究进展[J].畜牧与兽医, 2007(12):71-75.
[11] 张小建, 李键, 王蕊, 等.供体细胞对哺乳动物体细胞核移植的影响[J].动物医学进展, 2007, 28(3):82-85.
[12] Vignon X, LeBourshis D, Chesne P, et al.Development of bovine nuclear transfer embryos reconstituted with quiescent and proliferative skin fibroblasts[J].Heriogenology, 1999, 51:216.
[13] Dominko T, Mitalipova M, Haley B, et al.Bovine oocyte cytoplasm supports development of embryos produced by nuclear transfer of somatic cell nuclei from variousmammalian species[J].Biol Reprod, 1999, 60:1496-502.
[14] Blelloch R, Wang Z, Meissner A, et al.Reprogramming efficiency following somatic cell nuclear transfer is influenced by the differentiation andmethylation state of the donor nucleus[J].Stem Cell, 2006, 24:2007-213.
[15] 黄国宁, 孙海翔.体外受精-胚胎移植实验室技术[M].北京:人民卫生出版社, 2012:208-209.
[16] Varisanga MD, Dong YJ, Mtango NK, et al.Comparison of the effects of using standard and simple portable CO2incubators on the in vitro developmental competence of bovine embryos reconstituted by somatic cell nuclear transfer[J].Theriogenology, 2002, 58:77-86.
[17] Machaty Z, Day BN, Prather RS.Development of early porcine embryos in vitro and in vivo[J].BiloReprod, 1998, 59(2):451-455.
