山羊Klf4基因克隆、原核表达和His-Klf4融合蛋白纯化
2013-09-13辛桂瑜王丽霞叶新慧申魁魁符欣蕙李恭贺张明2卢晟盛卢克焕郑喜邦
辛桂瑜 王丽霞 叶新慧 申魁魁 符欣蕙 李恭贺 张明,2卢晟盛,2 卢克焕,2 郑喜邦
Klf4(Krüpple like factor 4,Krüpple 样 因 子 4)是一类含3个锌指结构的双向转录因子。长期以来,由于Klf4在细胞增殖、分化、生长特别是与肿瘤的发生、发展有密切关系而备受关注。Klf4可以促进胚胎干细胞的自我更新[1];Sikora 与 Ghosh[2,3]的研究还表明,Klf4具有促进表皮的增殖分化以及抑制膀胱癌等恶性肿瘤发生等多种功能。Klf4在许多类型的肿瘤中特异性过表达或者缺失,例如,在结肠癌、小肠癌、膀胱癌、前列腺癌和食道癌等肿瘤中Klf4低表达[4-8],胃癌中Klf4有杂合性缺失的表现[9],而在原发性乳腺导管癌以及口腔鳞癌中Klf4高表达[10,11]。近年来对干细胞的相关研究表明,Klf4等因子参与体细胞重编程,并发挥重要作用[12]。Takahashi 等[13]将 Klf4、 Sox2、Oct4、c-Myc 四 个转录因子导入小鼠成纤维细胞中,获得了iPS细胞(induced pluripotent stem cells),这一突破为患者自身遗传特性的ES细胞获取提供了新的途径,也为临床治疗提供了新的研究方向。此后,Takahashi 等[14]用同样的方法获得了人类iPS 细胞 。 Hanna 等[15]利用人类镰状细胞性贫血的小鼠动物模型,对其导入Klf4、Sox2、Oct4及c-Myc基因,将小鼠皮肤成纤维细胞重编程为自体iPS细胞,并对iPS细胞进行诱导分化,从而得到造血功能正常的前体细胞,进而起到了治疗作用。迄今为止,已相继获得了猕猴、猪、大鼠和绵羊等物种的iPS细胞[16-19],但是尚未见有关山羊体细胞重编程的报道。王春生等[20]、杨越飞等[21]对小鼠和绵羊Klf4基因分别进行了原核及真核表达的研究,但山羊Klf4基因的研究未见报道。
本研究旨在克隆山羊Klf4基因,并构建其原核表达载体,在大肠杆菌中诱导表达,纯化His-Klf4融合蛋白,从而为其多克隆抗体制备奠定基础,也为进一步研究山羊多能干细胞创造良好条件。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒 大肠杆菌BL21(DE3)和DH5α,质粒pET-30a由本实验室保存。
1.1.2 主要试剂 TRIzol LS®Regent RNA提取试剂盒购自Invitrogen公司(美国);反转录试剂盒、T4 DNA连接酶、限制性内切酶EcoR I和Hind Ⅲ、pMD18-T载体、IPTG,胶回收试剂盒均购自宝生物工程有限公司(大连);蛋白预染Marker购自Fermentas公司(立陶宛);DNA Marker 2000购自百维信生物科技有限公司(厦门);EB替代染料(GeneFinder核酸染料),购自康为公司(北京);质粒小量提取试剂盒,购自Omega Bio-Tek公司(美国);鼠源His标签抗体、山羊抗鼠IgG购自TIANGEN公司(北京)。
1.2 方法
1.2.1 目的片段的克隆与测序 根据GenBank中牛Klf4mRNA序列(NM.001105385.1)设计一对引物,在引物5'端分别引入EcoR I和Hind Ⅲ酶切位点。引物由Invitrogen公司合成,预计扩增片段为1 434bp。从山羊生殖脊提取总RNA,再反转录为cDNA,以cDNA 为模板,进行PCR 扩增。25μL PCR 反应体系为 :2×GC Buffer I 12.5μL,dNTPmix 2.5μL,上下游引物各0.5μL,Ex Taq DNA 聚合酶0.15μL, 模 板 cDNA0.75μL, 加 双 蒸 水 7.25μL。反应条件为:94℃预变性3min;94℃变性30s,61.6℃退火 90s,72℃延伸1min,共30个循环;72℃延伸10min。PCR产物经1%琼脂糖凝胶电泳、切胶后,用胶回收试剂盒纯化。目的片段与pMD18-T载体16℃连接过夜,转化DH5α感受态细菌,涂板。挑斑、增菌、小提质粒,分别用EcoR I和Hind Ⅲ进行双酶切鉴定,阳性质粒送宝生物工程有限公司测序。
1.2.2 信号肽预测 用DNAStar软件比较山羊与绵羊、牛、中国水牛、野猪Klf4核苷酸序列同源性;借助SignalP4.0在线软件(http://www.cbs.dtu.dk/services/SignalP/)预测Klf4编码蛋白是否存在信号肽。
1.2.3 山羊Klf4原核表达载体构建和鉴定 选择测序正确的pMD18-T-Klf4阳性质粒,用EcoRI和HindⅢ分别将pMD18-T-Klf4与表达载体pET-30a进行双酶切,胶回收Klf4目的片段和线性化的pET-30a载体,用T4DNA连接酶16℃连接过夜。连接产物转化DH5α感受态细菌,挑斑、增菌、小提质粒和双酶切鉴定。阳性质粒送宝生物工程有限公司测序。
1.2.4 重组质粒在大肠杆菌中的诱导表达 经鉴定与测序,将阅读框正确的重组质粒pET30a-Klf4转化至大肠杆菌BL21感受态细胞,涂板、挑斑并加入含氨苄青霉素(终浓度100μg/mL)的LB培养基中,37℃摇床振荡培养过夜,取重组菌按1∶100体积比转接入含氨苄青霉素的5mL LB 培养基中,220r/min,37℃ 振荡培养至 OD600nm=0.4-0.6时,加入终浓度为1mol/L 的 IPTG,37℃诱导表达4h。收集2mL菌液以12000r/min离心4min,沉淀用80μL PBS(pH7.4)悬浮,加入 5×SDS-Loading Buffer 20μL,混匀后置冰上10min,煮沸10min,12000r/min离心5min,取10μL上清进行SDS-PAGE电泳,考马斯亮蓝染色确定目的蛋白是否表达。
1.2.5 融合蛋白Western blotting检测 取上述蛋白样品进行SDS-PAGE电泳。以湿转法将目的蛋白转到NC(硝酸纤维素)膜上,用TBST配制的5%脱脂奶粉室温封闭2-3h。加入鼠源His标签抗体(1∶2000)4℃孵育过夜后用TBST漂洗3次,每次10min。加入山羊抗鼠IgG(1∶2000),室温孵育1-1.5h,用TBST 漂洗3次,每次10min。洗膜后用化学发光剂A、B各250μL滴至保鲜膜上混匀,将NC膜的蛋白面朝下,覆盖在显色剂上作用5min,吸取多余的显色剂,NC膜蛋白面朝上,包裹后固定在暗盒内,压X光胶片,曝光。经显影、定影,用预染蛋白Marker判定目的蛋白的相对分子质量。
1.2.6 融合蛋白的纯化 将诱导表达成功的重组菌液按1∶100比例转接5mL LB液体培养基中,37℃振摇培养过夜。活化的菌液按1∶200比例转接500mL含氨苄青霉素的LB培养基中,37℃培养至OD600nm值达到0.4-0.6时,加入IPTG,37℃继续诱导4h。以5000r/min 4℃离心8min,收集菌体沉淀并称重。随后的蛋白纯化按照 Ni-NTA argrose使用说明进行。每1g湿重沉淀加5mL的Buffer B 制成悬浮液;置于室温下180r/min摇床振摇1h后超声波破碎10min,以12000r/min 4℃离心20min,取其上清,用0.45μm滤器过滤后缓慢加入含Ni-NTA argrose的纯化柱中,室温下慢速摇动混匀2h,静置后过柱;用2倍柱床体积Buffer C洗涤3次,用2倍柱床体积 Buffer E洗脱His-Klf4融合蛋白。分别收集少量裂解液上清、沉淀、过柱液、Buffer C和Buffer E洗脱液进行SDS-PAGE分析。纯化的蛋白冷冻干燥保存于-80℃冰箱待用。
2 结果
2.1 PCR电泳检测
提取的山羊生殖脊总RNA经反转录,以cDNA为模板,PCR扩增后,产物用1%琼脂糖凝胶电泳进行检测。在紫外灯下观察,可发现在约1500bp处有一特异性条带(图1),与预期结果相符。
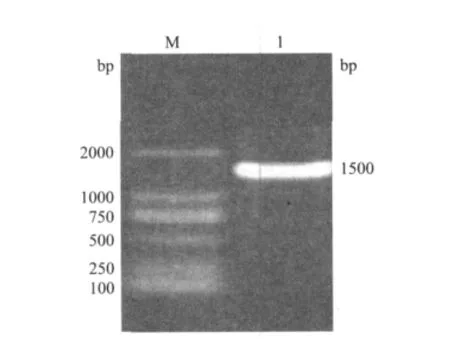
图1 山羊Klf4 RT-PCR产物凝胶图
2.2 重组质粒pMD18-T-Klf4的酶切鉴定与测序
将重组质粒pMD18-T-Klf4用EcoR I和Hind Ⅲ进行双酶切以及1%琼脂糖凝胶电泳,得到约1500bp目的条带(图2),与预期结果相符。测序结果表明Klf4基因的阅读框由1 434 个核苷酸组成,共编码478个氨基酸(图3)。用DNAStar软件将该基因核苷酸序列分别与绵羊、牛、中国水牛、野猪Klf4进行核苷酸序列同源性比较,结果(表1)分别为98.5%、98.2%、98.0%和 94.2%。 经 过 SignalP 4.0在线分析,山羊Klf4编码蛋白不存在信号肽(图4),全长序列可用于原核表达。
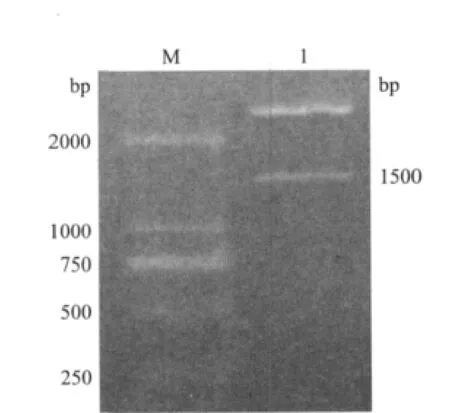
图2 山羊pMD18-T-Klf4双酶切鉴定

图3 山羊Klf4基因的测序结果
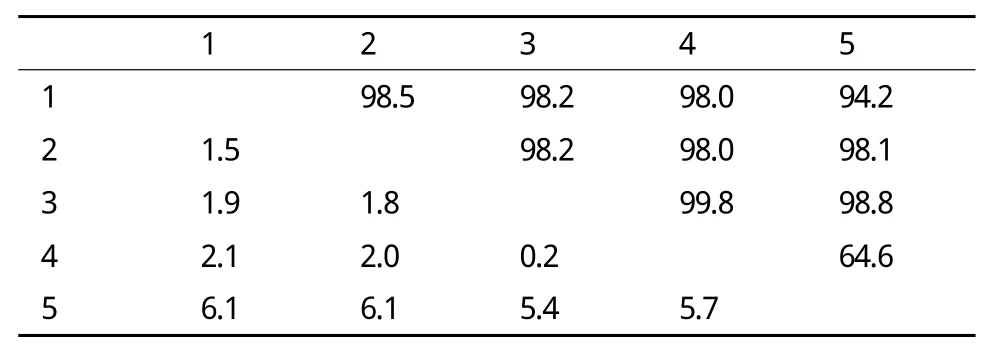
表1 山羊Klf4基因核苷酸序列与其他物种的Klf4序列同源性比较(%)

图4 山羊Klf4基因信号肽分析
2.3 重组质粒pET30a- Klf4的酶切鉴定
将原核表达质粒pET30a-Klf4进行EcoR I和Hind Ⅲ双酶切以及1%琼脂糖凝胶电泳鉴定,得到目的片段约为1500bp(图5),与预期结果相符。结果表明pET30a-Klf4重组质粒构建成功。
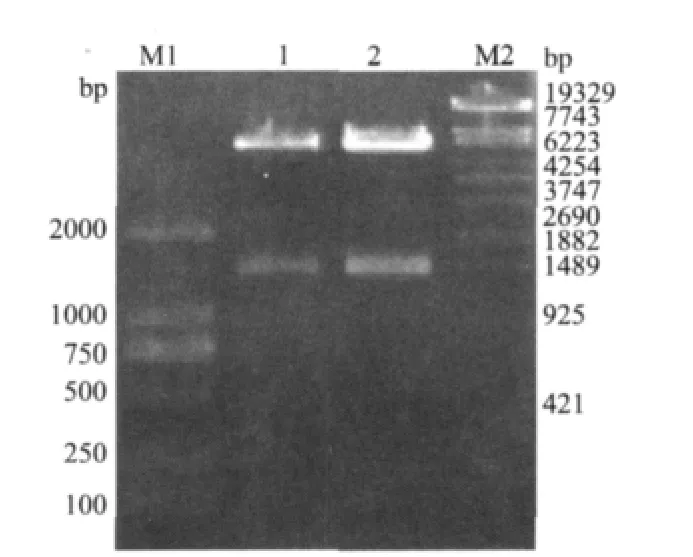
图5 重组质粒pET30a-Klf4酶切鉴定
2.4 pET30a-Klf4在大肠杆菌中的诱导表达与His-Klf4融合蛋纯化
SDS-PAG电泳表明,重组质粒pET30a-Klf4在大肠杆菌BL21中得到表达,表达的His-Klf4融合蛋白分子量约为52kD(图6),与理论值相符。免疫印迹检测结果(图7)也与SDS-PAGE电泳结果相一致,在分子量约52kD 处有特异性条带,说明目的蛋白确实为His-Klf4融合蛋白,融合基因阅读框正确。在变性条件下,用镍离子金属螯合亲和层析法纯化His-Klf4融合蛋白,经SDS-PAGE分析(图8),纯化产物呈单一条带,与上述预期结果一致,证明获得了His-Klf4融合蛋白。
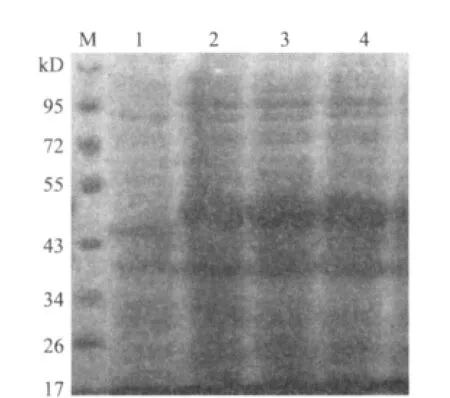
图6 pET30a-Klf4表达产物SDS-PAGE分析
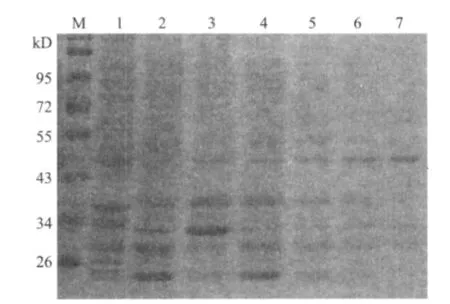
图8 His-Klf4纯化产物SDS-PAGE分析
3 讨论
获得纯化的Klf4转录因子蛋白,必须要建立最佳的原核表达体系,而表达载体的选择又是关键的因素之一。在本研究中,我们之前选用pRSET-A作为表达载体,但最终获得的重组蛋白表达量不高,改用pET-30a后,获得了表达效率较高的重组蛋白。这是因为pET-30a具有功能强大的T7启动子,而T7 RNA聚合酶具有较高的选择性与活性,大多数的细胞资源在诱导充分时都可被用于目的基因的表达,因此可以获得高效表达的重组蛋白[22,23]。另外,pET-30a载体含有的6×His Tag可作为纯化的标志,His融合蛋白经过Ni-NTA argrose层析柱可以进一步纯化。
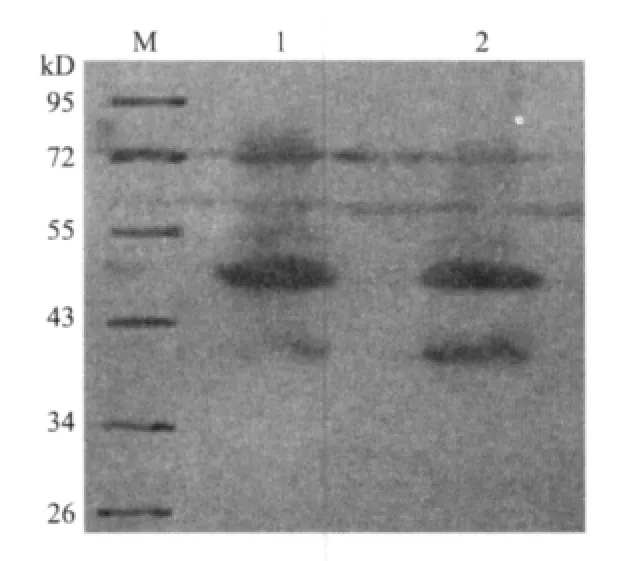
图7 融合蛋白His-Klf4的Western blotting检测
本研究构建的重组质粒pET30a-Klf4在宿主菌BL21中经IPTG诱导获得高效表达。本研究表明,1mmol/L IPTG 37℃诱导4h,表达效果较好。经可溶性分析,目的蛋白以包涵体的形式存在,用8mol/L尿素在变性条件下进行纯化,结果比较满意。但在进行His-Klf4融合蛋白的纯化过程中,目的蛋白与镍离子亲和层析柱结合不稳定。针对此种情况,改变了多种条件,最终发现在裂解液中加入10%甘油并把pH调至7.4后蛋白能与镍离子亲和层析柱较好地结合,这是由于菌液进行超声裂解之后pH有所下降,当pH在4.5-5.3时组氨酸残基质子化,蛋白无法与镍离子进行结合。在目的蛋白的洗脱过程中,目的蛋白洗脱量过低,洗脱液中含有大量杂蛋白。在裂解液中加入吐温、Triton等表面活性剂,减少了杂蛋白与层析柱的非特异性结合,并且根据目的蛋白等电点(pH8.0)改变杂蛋白洗脱液pH值,最终用pH值5.0的洗脱液洗脱目的蛋白,获得了较好的纯化效果。
总之,本研究克隆了山羊Klf4基因,成功构建原核表达载体,通过诱导表达和纯化获得了山羊His-Klf4的融合蛋白,为山羊多能干细胞的研究奠定了基础。
4 结论
利用RT-PCR方法从山羊原始生殖嵴中成功克隆了Klf4基因,构建了原核表达质粒pET30a-Klf4,通过原核表达技术成功获得了纯化的山羊His-Klf4融合蛋白。
[1] Nakatake Y, Fukui N, Iwamatsu Y, et al.Klf4 cooperates with Oct3/4 and Sox2 to activate the Lefty1 core promoter in embryonic stem cells.Mol Cell Biol, 2006, 26(20):7772-7782.
[2] Sikora JP.The role of cytokines and reactive oxygen species in the pathogenesis of sepsis.Pol Merkur Lekarski, 2000, 7(43):47-50.
[3] Ghosh S, May MJ, Kopp EB.NF-kappa B and Rel proteins:evolutionarily conservedmediators of immune responses.Annu Rev Immunol, 1998, 16(4):225-260.
[4] Zhao W, Hisamuddin IM, Nandan MO, et al.Identification of Krüppel-like factor 4 as a potential tumor suppressor gene in colorectal cancer.Oncogene, 2004, 23:395-402.
[5] Ton TH, Kaestner KH, Shields JM, et al.Expression of the gutenriched Krüppel-like factor gene during development and intestinal tumorigenesis.FEBS Lett, 1997, 49(2-3):239-243.
[6] Ohnishi S, Ohnami S, Laub F, et al.Downregulation and growth inhibitory effect of epithelial-type Krüppel-like transcription factor KLF4, bue not KLF5, in bladder cancer.Biochem Biophys Res Commun, 2003, 308(2):251-256.
[7] Schulz WA.Hatina J.Epigenetics of prostate cancer:beyond DNAmethylation.Cell Mol Med, 2006, 10(1):100-125.
[8] Yang Y, Goldstein BG, Chao HH, et al.KLF4 and KLF5 regulate proliferation, apoptosis and invasion in esophageal cancer cells.Cancer Biol Ther, 2005(4):1216-1221.
[9] Wei D, Gong W, Kanai M, et al.Drastic down-regulation of Krüppellike factor 4 expression is critical inhuman gastric cancer development and progression.Cancer Res, 2005, 65:2746-2754.
[10] Foster KW, Frost AR, McKie BP, et al.Increase of GKLFmessenger RNA and protein expression during progression of breast cancer.Cancer Res, 2000, 60(22):6488-6495.
[11] Foster KW, Ren S, Louro ID, et al.Oncogene expression cloning by retroviral transduction of adenovirus E1A immortalized rat kidney RK3E cells:transformation of ahost with epithelial features by c MYC and the zinc finger protein GKLF.Cell Growth Differ, 1999,10(6):423-434.
[12] Li YM, Clintick J, Zhong L, et al.Murine embryonic stem cell differentiation is promoted by SOCS-3 and inhibited by the zinc finger transcription factor Klf4.Blood, 2005, 105:635-637.
[13] Takahashi K, Yamanaka S.Induction of pluripotentstem stem cells frommouse embryonic and adult fibroblast cultures by defined factors.Cell, 2006, 126:663-676.
[14] Takashi K, Tanabe K, Ohnuki M, et al.Induction of pluripotent stem cells from adulthuman fibrblasts by defined factors.Cell,2007, 131(5):861-872.
[15] Hanna J, Wernig M, Markoulaki S, et al.Treatment of sickle cell anemiamousemodel with iPS cells generated from autologous skin.Science, 2007, 318:1920-1923.
[16] Liu H, Zhu F, Yong J, et al.Generation of induced pluripotent stem cells from adult rhesusmonkey fibroblasts[J].Cell Stem Cells,2008, 3(5):475-479.
[17] Wu Z, Chen JJ, Ren J, et al.Generation of pig induced pluripotent stem cells with a drug-inducible system[J].Journal of Moleculat Cell Biology, 2009, 1:87-98.
[18] Liao J, Cui C, Chen S, et al.Generation of induced pluripotent stem cell lines from adult rat cells.Cell Stem Cell, 2009, 4(1):11-15.
[19] Liu J, Balehosur D, Murray B, et al.Generation and characterization of reprogrammed sheep induced pluripotent stem cells.Theriogenology, 2012, 77:338-346.
[20] 王春生, 罗芳, 杜文敬, 等.小鼠klf4基因的克隆及原核表达分析[J].中国实验动物学报, 2009, 17(2):103-107.
[21] 杨越飞, 王春生, 宁方勇, 等.绵羊klf4编码区的克隆、序列分析与原核表达[J].中国兽医学报, 2011, 31(4):529-532.
[22] Davanloo P, Rosenberg AH, Dunn JJ, et al.Cloning and expression of the gene for bacterio a Phage T7 RNA polymerase.Proceedings of the National Academy of Sciences of the USA, 1984, 81:2035-2039.
[23] 赵华, 杨照海, 刘平, 等.山羊c-Myc 原癌基因克隆、原核表达和GST-Myc 融合蛋白纯[J]. 农业生物技术学报, 2010,18(5):931-937.
