采后BTH处理及粉红单端孢(Trichothecium roseum)挑战接种对厚皮甜瓜果实苯丙烷代谢活性的诱导
2013-09-06邓惠文葛永红任亚琳刘瑶瑶
邓惠文,毕 阳,葛永红,任亚琳,刘瑶瑶
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
厚皮甜瓜(Cucumis melo L.)是我国西北地区的主要经济作物,外形美观、风味独特,深受广大消费者喜爱。然而,由于产期集中,且正值高温季节,加之缺乏有效的采后处理和必要的冷链,烂损颇为严重[1]。甜瓜在采后贮运过程中易受 Trichothecium roseum侵染而发生粉霉病,给生产者和经营者造成了巨大的经济损失[1]。该病原物可在采后贮运期间通过伤口进入产品体内,进而引起腐烂[2]。化学杀菌剂虽然可以有效控制甜瓜粉霉病[3],但存在杀菌剂残留、环境污染和病原物产生抗药性等问题[4]。近年来利用物理、化学和生物的方法诱导植物抗病性逐渐成为果蔬采后病害控制的研究热点[5]。苯丙噻重氮(Acibenzolar-S-methyl,ASM or BTH)是第一个人工合成的诱抗剂,属水杨酸类似物。其本身对病原菌生长没有直接的抑制,而是通过激发植物体内的系统抗性来增强对病原菌侵染的抵抗而减轻采后腐烂[6]。有报道表明,BTH处理可有效提高多种果实的采后抗病性,果实的抗病性的提高与苯丙烷代谢活性的增强相关,例如,采前BTH(ASM)多次喷洒处理及采后 BTH 处理可分别诱导甜瓜[7]、鸭梨[8]、桃子[9]以及香蕉[10]果实苯丙氨酸解氨酶(PAL)活性提高,BTH还能诱导甜瓜中4-香豆素-辅酶A连接酶(4CL)活性的增强[11]。此外,BTH处理能促进草莓和芒果中的总酚、类黄酮及木质素的积累[12-13]。但上述报道均未研究病原物损伤接种BTH处理果实苯丙烷代谢关键酶和产物积累的变化。本文拟研究采后BTH处理及Trichothecium roseum挑战接种对PAL和4CL活性,以及总酚、类黄酮及木质素积累的影响,以期为BTH对果实的采后诱抗提供理论依据。
1 材料与方法
1.1 材料与仪器
供试‘玉金香’甜瓜 2010年7月采自于甘肃省民勤县收成乡露天栽培大田(果实可溶性固形物含量9.29%,硬度7.9kg/cm2),单果套发泡网袋后入包装箱(20个/箱),第2d运抵甘肃农业大学食品学院采后生物学与技术实验室,于常温(22±2)℃、相对湿度55%~60%下贮藏待用。果实经BTH处理后24h挑战接种T.roseum;BTH(a.i50%)澳大利亚悉尼大学提供;粉红单端孢(Trichothecium roseum)分离自典型自然发病果实,PDA上保存待用。
GY-B型果实硬度计 杭州托普仪器有限公司;WYA型手持糖量计 上海立光精密仪器有限公司;UV-2450型 岛津分析仪器;H-1850R型台式高速冷冻离心机 长沙湘仪离心机有限公司。
1.2 实验方法
1.2.1 孢子悬浮液的配制 参照参考文献[14]的方法。取25℃下培养10d的带菌PDA平皿一个,加入含0.05%Tween20的无菌水约10mL,用玻璃棒刮下平板上的病原菌孢子,然后转入50mL三角瓶中,在WYX-A微型旋涡混合器上振荡15s,再用双层纱布过滤,滤液用血球计数板计数算出孢子悬浮液的浓度后,最后稀释至所需浓度(1×105孢子/mL)。
1.2.2 BTH浸泡处理果实 参照曹建康的方法[15]并修改。将表面用自来水冲洗干净并晾干的果实浸入0.1g/L BTH溶液中10min(内含0.05%的Tween 20),取出晾干后入包装箱,于常温条件下(22±2)℃;RH 55%~60%贮藏待用,以清水(内含0.05%的Tween 20)处理作为对照。
1.2.3 损伤接种果实 参照毕阳和张维一方法[16]选取BTH处理后常温贮藏48h的果实,经75%酒精表面消毒后,用灭菌打孔器在果实表面等距离刺孔6个(深3mm,直径3mm)。分别取10μL孢子悬浮液接入孔内。稍作晾干后入包装箱,室温(22±2)℃;RH 85%~90%条件下贮藏,并定期测定病斑直径。
1.2.4 取样 参照Bi Y等的方法[17]。BTH处理后第 0、2、4、6、8、10d 取皮下 1~3mm 处果肉组织 3g。挑战接种样品则取接种 T.roseum 后第2、4、6、8、10d取外皮下1~3mm处果肉组织3g。组织用锡箔纸包好,液氮冷冻,在-80℃超低温冰箱中保存待测。
1.2.5 苯丙氨酸解氨酶(PAL)活性的测定 参照Koukol等的方法[18]并修改。称取3g果肉组织,加入3mL经4℃预冷的、0.2mol/L、pH8.8的硼酸缓冲液(含10%PVPP,1mmol/L EDTA 和 50mmol/L β-琉基乙醇),在冰浴条件下研磨成匀浆,于4℃、15000×g离心20min,上清液立即用于酶活测定。PAL酶促反应体系包括:2mL,pH8.8的硼酸缓冲液(0.2mol/L),300μL粗酶液和1mL 0.02mol/L的 L-苯丙氨酸。24℃下反应2min时,在UV-2450型紫外可见分光光度仪上测其OD290。空白以硼酸缓冲液代替酶液。酶活以每分钟内OD290变化0.01为1个活性单位(U),酶活性以U/mg protein表示。实验重复3次。
1.2.6 香豆酰-辅酶A连接酶(4CL)活性的测定参照朱明华等的方法[19]并修改。取3g冷冻果肉,加入3mL,0.2mol/L Tris-HCl缓冲液(pH8.0,含25%甘油、0.1NDTT),匀浆,四层纱布过滤,10000×g离心20min,上清液即为粗酶液,4CL反应体系包括0.45mL 15μmol/L Mg2+;0.15mL 15μmol/L p-香豆酸;0.15mL ATP(50μmol/mL)、0.15mL CoA(1μmol/mL)以及0.5mL酶液(对照不加香豆酸)。在40℃下反应10min,于333nm处测定吸光值。以每分钟吸光值变化0.01为1个活性单位(U)。实验重复3次。
1.2.7 木质素含量的测定 参照Morrison等的方法[20]。取3g果肉组织与预冷的3mL 95%乙醇研磨,4℃下12000×g离心10min,沉淀物用95%乙醇冲洗3次,再用乙醇∶正己烷=1∶2(V/V)冲洗3次,收集沉淀使其干燥,干燥物溶于1mL 25%溴化乙烷冰醋酸溶液中,70℃恒温水浴30min,然后加1mL 2mol/L NaOH终止反应。再加2mL冰醋酸和0.1mL 7.5mol/L羟铵盐酸,离心,取上清液0.5mL,用冰醋酸定容至9mL,280nm下测定样品吸光值,实验重复3次。木质素含量以OD280/g FW表示。
1.2.8 总酚和类黄酮含量的测定 参照Pirie和Mullins方法[21]并修改。称取3g果肉组织于预冷的5mL 1%HCl-甲醇溶液中,在冰浴条件下充分研磨提取,然后于4℃下12000×g离心10min,上清液直接于280、325nm下比色。总酚含量以OD280/g FW表示。类黄酮含量单位表示为 OD325/g FW。实验重复3次。
1.2.9 蛋白含量的测定 参照Bradford的方法[22],以牛血清蛋白(BSA)为标准曲线,计算蛋白含量。
1.3 数据统计
全部实验数据用 Microsoft Excel 2007和DPS 7.55数据处理系统进行统计处理。计算标准偏差(±SE)或进行Duncan’s多重差异显著分析。
2 结果与讨论
2.1 BTH处理对果实损伤接种T.roseum病斑直径的影响
随着贮藏时间的延长,处理和损伤接种果实的病斑直径均逐渐扩大,但处理果实病斑直径显著低于对照,处理后第6d和7d病斑直径分别比对照低17.11%和31.85%(图1)。
2.2 BTH处理对果实PAL和4CL活性的影响
贮藏期间对照及处理果实PAL活性整体呈先升高后降低的趋势,且均在第8d出现峰值(图2A)。BTH处理诱导了PAL活性的提高。损伤接种进一步提高了PAL活性高峰的提前出现,第6d达到高峰值;在第6d,BTH+挑战较CK+挑战高但效果不明显;随着贮藏时间的延长,对照和处理果实的4CL活性总体呈现升高后降低再升的趋势,且处理果实4CL活性在贮藏期间均高于对照(图2B)。损伤接种明显促进了果实4CL活性的升高,在第6d,BTH+挑战较CK+挑战高出18.59%;BTH较对照高出12.04%。

图1 BTH处理对T.roseum损伤接种果实病斑直径的影响Fig.1 Effect of BTH treatment on the lesion diameter of fruits inoculated with T.roseum
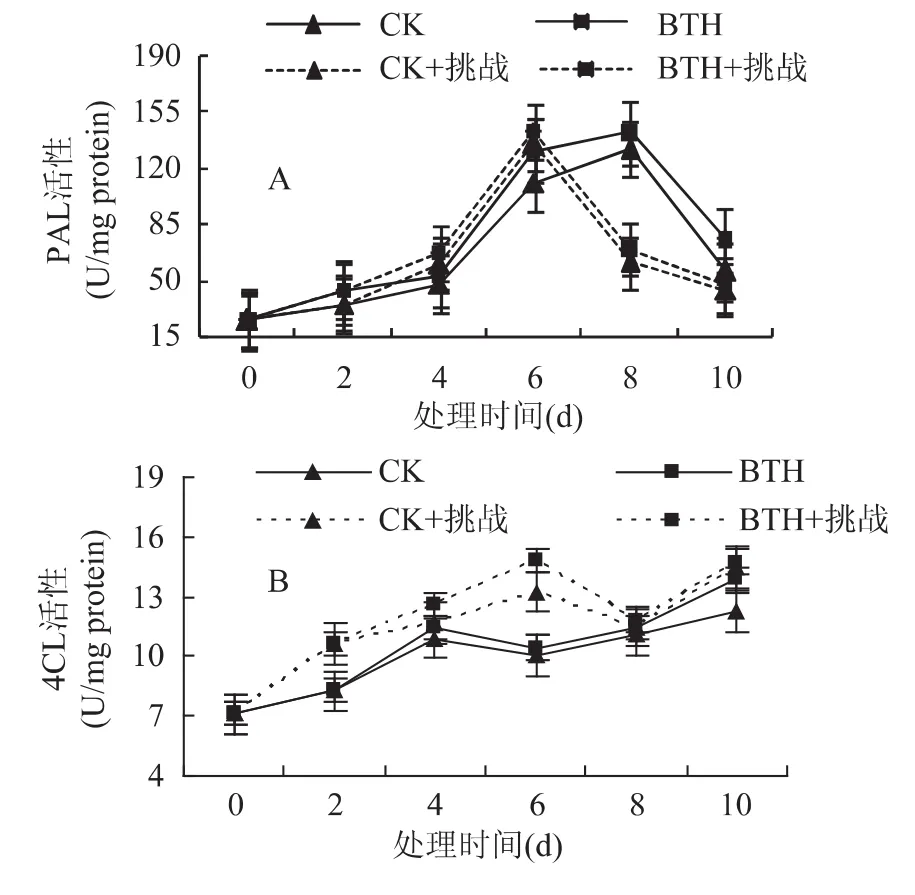
图2 BTH处理及挑战接种对厚皮甜瓜PAL(A)、4CL(B)酶活性的影响Fig.2 Effect of BTH treatment on activity of PAL(A)and 4CL(B)in muskmelon fruits
2.3 BTH处理对果实木质素、总酚和类黄酮含量的影响
贮藏期间对照及处理果实的木质素含量整体呈现先增后降的趋势,在第8d达到最大,且处理果实的木质素含量高于对照果实(图3A)。挑战接种进一步提高了果实木质素含量的提高,在第8d,BTH+挑战较CK+挑战差异不大;对照和BTH处理果实总酚和类黄酮含量总体呈现先增后降的趋势并在第6d达到高峰值。在整个贮藏过程中BTH处理果实中的总酚和类黄酮含量都高于对照果实。挑战接种促进了果实中总酚和类黄酮的积累。第8d,BTH+挑战总酚含量较CK+挑战总酚含量高出16.13%;BTH较对照差异不大(图3B);第6d,BTH+挑战类黄酮含量较CK+挑战类黄酮含量高,但不存在显著差异(图3C)。
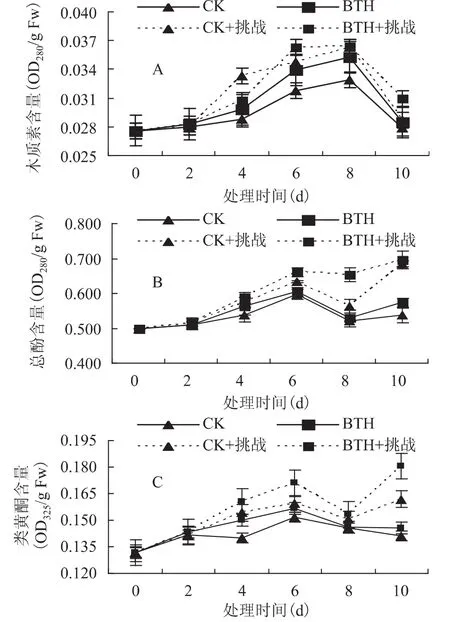
图3 BTH处理及挑战接种对厚皮甜瓜果实木质素(A)、总酚(B)和类黄酮含量(C)的影响Fig.3 Effect of BTH treatment on content of lignin,total phenolic and flavonoids in muskmelon fruits
3 结论
本研究结果表明,0.1g/L BTH处理可以有效抑制处理后损伤接种T.roseum果实的病斑直径,从而增强采后果实的抗病性。该结果与BTH处理有效控制香蕉炭疽病[10]、甜樱桃炭疽病[23]、沙糖桔绿霉病[24]、以及枇杷炭疽病[25]的结果类似。BTH 对甜瓜粉霉病的抑制与其激活防御酶和积累抗菌物质密切相关。据报道,多种防御酶和抗菌物质在果蔬的抗病反应中具有积极的作用[26]。本研究中,4CL活性显著增加及总酚类黄酮的积累也证明了这一点,并且挑战接种进一步促进其抗性的增加。PAL是苯丙烷类代谢途径的关键酶和限速酶,参与了多种激发子诱导的抗性[27],增强了植物对病原物侵染的抵抗能力[28]。本研究结果显示,BTH处理甜瓜果实诱导抗病性与PAL酶活性增加有一定相关性,这与前人在鸭梨[8]、桃子[9]以及香蕉[10]上的研究类似;挑战接种使得PAL酶活峰值提前,可能是由于挑战接种激活了活性氧代谢,其中产生的H2O2可能作为一种信号分子诱导了PAL的基因表达。此外,BTH或病原物侵染也可作为诱导抗病性的信号[29]。4CL是控制苯丙烷主途径向分支途径转折的关键酶,在植物与外界环境互作过程中发挥重要作用。其代谢产物总酚、类黄酮以及木质素的积累可以抵抗病原物的侵染、增强果实的表皮结构,从而提高其抗病性。本实验结果表明,BTH处理及挑战接种后果实4CL活性及总酚、类黄酮含量迅速增加,证明了4CL以及总酚和类黄酮参与了甜瓜果实的抗病过程。总之,采后BTH及T.roseum挑战接种能够明显增强甜瓜果实的苯丙烷代谢,但BTH及挑战接种如何在生化和分子水平系统诱导苯丙烷代谢活性的增强尚需进一步研究。
[1]Bi Y,Ge Y H,Wang C L,et al.Melon production in China[J].Acta Horticulturae,2007,731(1):493-500.
[2]张维一,毕阳.果蔬采后病害与控制[M].北京:中国农业出版社,1996:156-158.
[3]马凌云,毕阳,张正科,等.采前嘧菌酯处理对‘银帝’甜瓜采前及采后主要病害的控制[J].甘肃农业大学学报,2004,39:14-17.
[4]Terry L A,Joyce D C.Elicitors of induced resistance in postharvest horticultural crops:a brief review[J].Postharvest Biology and Technology,2004,32:1-13.
[5]Bi Y,Li Y C,Ge Y H,et al.Induced resistance in melons by elicitors for the control of postharvest diseases[J].Plant Pathology in the 21st Century,2010,2:31-41.
[6]Edreva A.A novel strategy for plant protection:Induced resistance[J].Journal of Cell and Molecular Biology,2004(3):61-69.
[7]Zhang Z K,Bi Y,Ge Y H,et al.Multiple pre-harvest treatments with acibenzolar-S-methyl reduce latent infection and induce resistance in muskmelon fruit[J].Scientia Horticulturae,2011,130:126-132.
[8]Cao J,Jiang W,He H.Induced resistance in Yali pear(Pyrus bretschneideriRehd.)fruitagainstinfection by Penicillium expansum by postharvest infiltration of acibenzolar-S-methyl[J].Phytopathology,2005,153:643-644.
[9]Liu H X,Jiang W B,Bi,Y.Postharvest BTH treatment induces resistance of peach(Prunus persica L.cv.Jiubao)to infection by Penicillium expansum and enhances activity of fruit defense mechanisms[J].Postharvest Biology and Technology,2005,35:263-269.
[10]麻宝成,朱世江.苯并噻重氮和茉莉酸甲酯对采后香蕉果实抗病性及相关酶活性的影响[J].中国农业科学,2006,39:1220-1227.
[11]Vogt T.Phenylpropanoid biosynthesis[J].Molecular Plant,2010,3:2-20.
[12]Cao S F,Hu Z C,Zheng Y H,et al.Effect of BTH on antioxidant enzymes,radical-scavenging activity and decay in strawberry fruit[J].Food Chemistry,2011,125:145-149.
[13]Zhu X,Cao J,Wang Q,et al.Postharvest infiltration of ASM reduces infection of mango fruits(Mangifera indica L.cv.Tainong)by colletotrichum gloeosporioides and enhances resistance inducing compounds[J].Journal of Phytopathology,2008,156:68-74.
[14]周德庆.微生物学实验教程[M].第二版.北京:高等教育出版社,2006.
[15]曹建康.SA、ASM、INA和柠檬酸对鸭梨果实采后抗病性和品质的影响[D].北京:中国农业大学,2005.
[16]毕阳,张维一.感病甜瓜果实呼吸、乙烯及过氧化物酶变化的研究[J].植物病理学报,1993,23:69-73.
[17]Bi Y,Tian S P,Zhao J,et al.Harpin induces local and systemic resistance against Trichotherium roseum in harvested hami melons[J].Postharvest Biology and Technology,2005,38:183-187.
[18]Koukol J,Conn E E.The metabolism of aromatic and properties of the phenylalanine deaminase of Hordeum vulgare[J].Biology Chemical,1961,10:2692-698.
[19]朱明华,欧阳观察,薛应龙.黄瓜免疫诱导过程中G6PD、PAL、4CL、PO活性和木质素含量的变化[J].上海农业学报,1990,6:21-26.
[20]Morrison I M.A semi-micro method from the determination of lignin and its use in predicting the digestibility of forage crops[J].Sci Food Agric,1972,23:455-463.
[21]Pirie A,Mullins M G.Changes in anthocyanin and phenolic content of grapevine leaf and fruit tissue treated with sucrose,nitrate and abscisic acid[J].Plant Physiol,1976,58:468-472.
[22]Bradford M N.A rapid and sensitive method for the quantitation of microgram quantities of protein using the principle of protein2dye binding[J].Annal Biochem,1976,72:248-254
[23]刘敏,彭建清,李建中,等.BTH对南山甜樱桃采后生理和炭疽病的影响[J].中国南方果树,2010,39:23-25.
[24]徐兰英,汪跃华,庞学群,等.BTH和BABA处理对采后沙糖桔病害和品质的影响[J].广东农业科学,2010(8):256-258.
[25]张紫微,朱世江.苯并噻重氮对采后枇杷果实病害及品质的影响[J].食品科学,2009,30:264-267.
[26]Cao J K,Jiang W B.Induction of resistance in Yali pear(Pyrus bertschneideri Reld.)fruit against postharvest diseases by acibenzolar-S-methyl sprays on trees during fruit growth[J].Scientia Horticulturae,2005,110:181-186.
[27]Mauch-Mani B,Slusarenko A J.Production of salicylic acid precursors is a major function of phenylalanine ammonia-lyase in the resistance of Arabidopsis to Peronospora parasitica[J].The Plant Cell,1996,8:203-212.
[28]Whetten R,Sederoff R.Lignin biosynthesis[J].The Plant Cell,1995,7:1001-1013.
[29]Lin T C.Accumulation of H2O2in xylem fluids of cucumber stems during ASM-induced systemic acquired resistance(SAR)involves increased LOX activity and transient accumulation of Shikimic acid[J].Plant Pathol,2009,125:119-130.
