右美托咪啶对瓣膜置换术患者血中炎症介质的影响
2013-08-24崔国庆滕金亮王培培
崔国庆,滕金亮,王 丽,王培培
(河北北方学院:1.研究生院;2.附属第一医院麻醉科,河北 张家口 075000)
体外循环(cardiopulmonary bypass,CPB)可通过多种因素诱发全身性炎性反应,大量炎症介质释放入血可损伤心、肺、脑、肾等重要脏器,易引起器官衰竭和全身炎症反应综合征[1]。实验表明,右美托咪啶作为一种新型的α2受体激动剂具有较强的抗炎作用[2]。本研究旨在评价右美托咪啶对CPB所致机体炎症反应的影响,探讨抑制CPB所致机体炎症反应的新方法。
1 资料与方法
1.1 一般资料 经医院伦理委员会批准,选择2011年10月至2012年7月于河北北方学院附属第一医院住院需择期在CPB下行瓣膜置换术的风湿性心脏病患者30例。年龄34~63岁,平均(49.4±7.3)岁;体质量45~78kg,平均(60.3±9.8)kg;心功能分级(NYHA)Ⅱ~Ⅲ级,左室射血分数大于35%。其中,男10例,女20例。二尖瓣置换19例,主动脉瓣置换8例,联合瓣膜置换3例。所有患者无冠心病、高血压,无感染性疾病、恶性肿瘤,肝肾功能、常规及生化检查均正常。按随机数字表法分为实验组和对照组,每组15例。
1.2 麻醉方法 所有患者于术前1d晚口服地西泮2.5mg,麻醉诱导前30min肌注东莨菪碱0.3mg。入手术室后开放液路,监测血氧饱和度、心电图、桡动脉血压、血气、尿量、体温、红细胞压积、凝血功能等。以芬太尼15μg/kg静脉注射进行麻醉诱导,患者眼睑反射消失后给予罗库溴铵0.8mg/kg进行气管插管,连接麻醉机机械通气,设置吸入氧流量2L/min,潮气量8~10mL/kg,吸呼比I∶E=1∶2.0,呼吸频率10~12次/分,维持二氧化碳分压(PaCO2)在35~45mm Hg。诱导完成后实验组以0.2μg·kg-1·h-1的速度静脉泵注右美托咪啶,对照组泵注等容积的生理盐水。行中心静脉穿刺,测量中心静脉压。于切皮前、胸骨锯开前分别追加芬太尼5μg/kg。以异丙酚2~5mg·kg-1·h-1、瑞芬太尼0.25μg·kg-1·min-1、罗库溴铵4~8μg·kg-1·min-1静脉泵注维持麻醉。
表1 两组患者一般临床资料比较
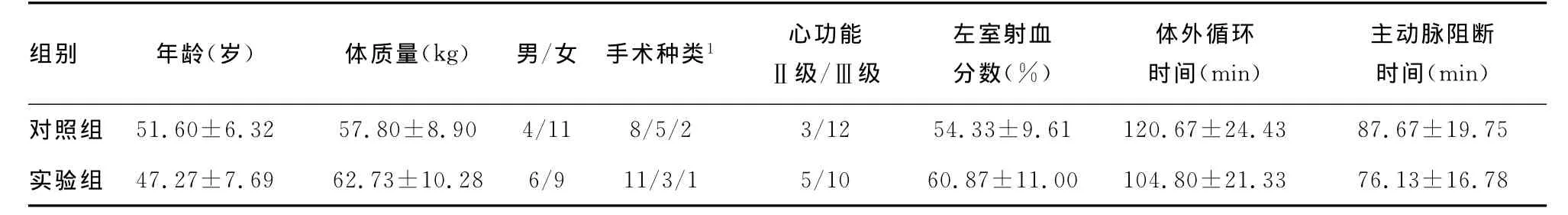
表1 两组患者一般临床资料比较
1:二尖瓣置换/主动脉瓣置换/联合瓣膜置换。
组别 年龄(岁) 体质量(kg) 男/女 手术种类1 心功能Ⅱ级/Ⅲ级左室射血分数(%)体外循环时间(min)主动脉阻断时间(min)对照组 51.60±6.32 57.80±8.90 4/11 8/5/2 3/12 54.33±9.61 120.67±24.43 87.67±19.75实验组 47.27±7.69 62.73±10.28 6/9 11/3/1 5/10 60.87±11.00 104.80±21.33 76.13±16.78
表2 两组患者术中各时间点血清标志物浓度比较,pg/mL)
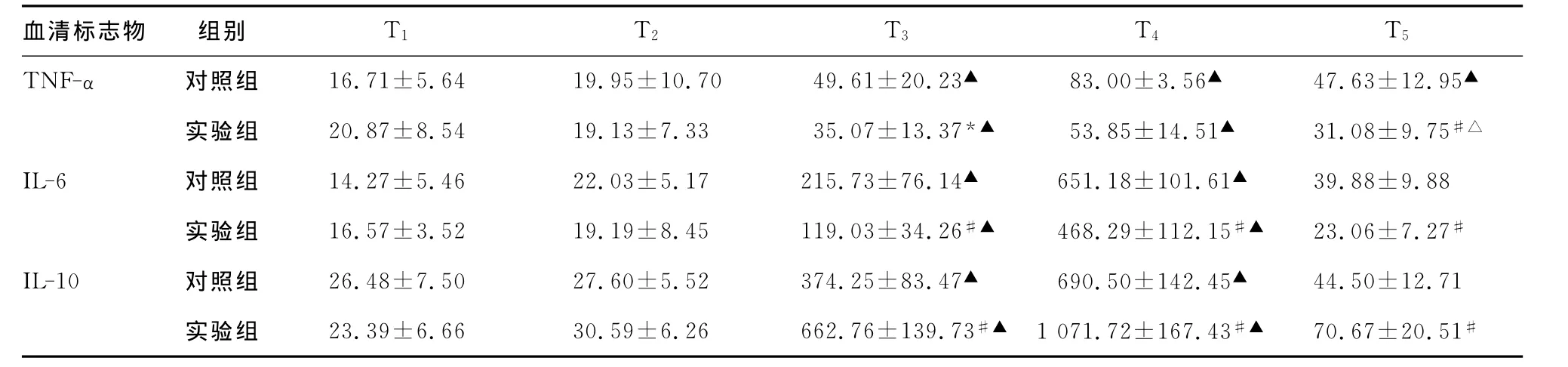
表2 两组患者术中各时间点血清标志物浓度比较,pg/mL)
*:P<0.05,与对照组比较;#:P<0.01,与对照组比较;△:P<0.05,与T1 时间点比较;▲:P<0.01,与T1 时间点比较。
血清标志物 组别 T1 T2 T3 T4 T5 TNF-α 对照组 16.71±5.64 19.95±10.70 49.61±20.23▲ 83.00±3.56▲ 47.63±12.95▲实验组 20.87±8.54 19.13±7.33 35.07±13.37*▲ 53.85±14.51▲ 31.08±9.75#△IL-6 对照组 14.27±5.46 22.03±5.17 215.73±76.14▲ 651.18±101.61▲ 39.88±9.88实验组 16.57±3.52 19.19±8.45 119.03±34.26#▲ 468.29±112.15#▲ 23.06±7.27#IL-10 对照组 26.48±7.50 27.60±5.52 374.25±83.47▲ 690.50±142.45▲ 44.50±12.71实验组 23.39±6.66 30.59±6.26 662.76±139.73#▲ 1 071.72±167.43#▲ 70.67±20.51#
1.3 CPB方法 采用天津汇康 WEL-1000HA型人工心肺机,MAQUET膜肺;预充液含有乳酸林格氏液、5%碳酸氢钠、羟乙基淀粉130/0.4氯化钠注射液、20%甘露醇等;切开心包时静脉注射肝素3mg/kg。常规插升主动脉和上、下腔静脉插管以及停跳液灌注管,激活全血凝固时间(activated clotting time of whole blood,ACT)>480s时开始CPB转机,体外循环停止机械通气。在浅低温(32~35℃),中度血液稀释、中高流量灌注下运行,期间血/氧流量比为1∶(0.5~0.8)。灌注含钾停跳液(20mL/kg)进行心肌保护。术中维持收缩压在80~100mm Hg之间,平均动脉压在60~80mm Hg之间。
1.4 标本采集与测定 分别于麻醉诱导后切皮前(T1)、CPB开始时(T2)、CPB开始后40min(T3)、停机2h(T4)、CPB结束后24h(T5)共5个时间点采集挠动脉血5mL,低温离心10 min后取上清液置于抗凝管中,-70℃冻存备测。ELISA法检测血清标志物 TNF-α、IL-6、IL-10的水平。
1.5 统计学处理 以CPB转流前红细胞压积(hematocrit,HCT)为标准矫正数据,公式为:矫正值=测量值×(转流前HCT/对应采血点HCT)。采用SPSS19.0软件对所得数据进行分析处理。数据用表示,组间对比用t检验,组内对比用重复测量的方差分析,计数资料用Fisher确切概率法分析,以P<0.05为差异有统计学意义。
2 结 果
两组患者年龄、体质量、性别比例、心功能分级、左室射血分数、手术类型、主动脉阻断时间、体外循环时间等方面比较,差异均无统计学意义(P>0.05),见表1。两组患者术中各时间点血清标志物浓度比较见表2。
3 讨 论
体外循环技术的应用使心脏直视手术得以开展,但与非体外循环手术相比,CPB可诱发更为明显的炎症反应[3]。其原因为CPB时血液-材料接触、机械剪切作用、缺血再灌注损伤、血液稀释、内毒素的入侵、肝素鱼精蛋白复合物的形成等[4]。
炎症介质介导炎症发生、发展,是炎症反应的主要分子机制,其血中含量影响CPB术后器官功能、并发症及死亡率[5]。TNF-α在炎症反应的早期出现,被认为是炎症反应的始动因素[6],其可促进炎细胞的黏附、迁移和外渗,引起炎症反应和肺部损伤[7]。IL-6是主要的炎症介质,能够激活急性期炎症反应,促进多种免疫细胞的分化和激活,是反映组织损伤的早期的敏感性指标[8]。本实验中,各组血清 TNF-α、IL-6在 CPB开始后均显著增高,于停机2h时达峰值,IL-6在CPB结束后24 h恢复至手术开始水平,而TNF-α仍保持较高水平,说明CPB下瓣膜置换术可激活机体炎症反应,引起机体促炎介质释放,并持续至术后。IL-10属抗炎因子,在炎症反应中其表达和生成可抑制 TNF、IL-1β、IL-6、IL-8等促炎因子的释放,减轻机体炎症反应。本实验中,各组血清IL-10在CPB开始后同样均显著增高,说明体外循环在诱发机体炎症反应的同时亦诱发机体的抗炎反应,CPB术后炎症反应的程度是促炎因子与抗炎因子共同作用的结果,这与之前的研究结果一致[3]。
众多试验证明新型α2受体激动剂右美托咪啶具有较强的抗炎作用[9-11]。在本实验中,实验组 TNF-α、IL-6在 CPB开始后显著低于对照组,而IL-10显著高于对照组,说明泵入右美托咪啶可有效地降低CPB瓣膜置换术时促炎介质的释放,同时增加抗炎介质的释放,通过调节促炎/抗炎介质的比值,减轻瓣膜置换术时炎症反应的程度,进而可能对炎症反应导致的器官损害产生保护作用,改善患者的预后。但是,右美托咪啶这种抗炎作用的原因尚不明确,可能与以下因素有关:首先,核因子κB(NF-κB)是多种细胞因子和炎症介质的基因转录和联级放大过程的共同通路和作用位点,在CPB心肌缺血再灌注时被激活,导致局部和全身炎症反应[12],右美托咪啶可下调NF-κB的表达,并抑制Toll样受体2/4-核因子-促分裂素原活化蛋白激酶(TLR-2,4/NF-κB/MAPK)炎症通路[2]。另外,高迁移率族蛋白1(high mobility group box-1protein,HMGB1)作为“晚期”炎性因子参与CPB术后器官损伤的病理过程[13],右美托咪啶可降低CPB时HMGB1的含量[14],从而抑制HMGB1对巨噬细胞、单核细胞、中性粒细胞的刺激作用,减轻炎症介质的释放。
综上所述,术中泵入右美托咪啶可有效地调节CPB瓣膜置换术中炎症介质的释放,从而抑制由此引起的炎症反应的程度。进一步探讨在CPB时右美托咪啶的抗炎机制及由此产生的器官保护作用均为今后值得研究的课题。
[1] Baehner T,Boehm O,Probst C,et al.Cardiopulmonary bypass in cardiac surgery[J].Anaesthesist,2012,61(10):846-856.
[2] 全承炫,欧阳文.右旋美托咪啶的抗炎作用研究进展[J].现代医药卫生,2011,27(11):1665-1666.
[3] 李叙,范士志,李志平,等.体外循环围手术期白细胞、中性粒细胞与细胞因子变化关系研究[J].重庆医学,2005,34(8):1167-1170.
[4] Levy JH,Tanaka KA.Inflammatory response to cardiopulmonary bypass[J].Ann Thorac Surg,2003,75(2):S715-720.
[5]Jouan J,Golmard L,Benhamouda N,et al.Gene polymorphisms and cytokine plasma levels as predictive factors of complications after cardiopulmonary bypass[J].J Thorac Cardiovasc Surg,2012,144(2):467-473.
[6] Xie GQ,Jiang JX,ChenYH,et al.Induction of acute hepatic injury by endotoxin in mice[J].Hepatobiliary Pancreat Dis Int,2002,1(4):558-564.
[7] Li T,Luo N,Du L,et al.Early and marked up-regulation of TNF-αin acute respiratory distress syndrome after cardiopulmonary bypass[J].Front Med,2012,6(3):296-301.
[8] Mojcik CF,Levy JH.Aprotinin and the systemic inflammatory response after cardiopulmonary bypass[J].Ann Thorac Surg,2001,71(2):745-754.
[9] Pandharipande PP,Sanders RD,Girard TD,et al.Effect of dexmedetomidine versus lorazepam on outcome in patients with sepsis:an a priori-designed analysis of the MENDS randomized controlled trial[J].Crit Care,2010,14(2):R38.
[10]Hofer S,Steppan J.Central sympatholytics prolong survival in experimental sepsis[J].Critical Care,2009,13(1):R11.
[11]Can M,Gul S,Bektas S,et al.Effects of dexmedetomidine or methylprednisolone on inflammatory responses in spinal cord injury[J].Acta Anaesthesiol Scand,2009,53(8):1068-1072.
[12]尹光明,喻田,余志豪.核因子Kappa B与体外循环炎症反应[J].国外医学:麻醉与复苏分册,2004,25(6):353-356.
[13]Ueki M,Kawasaki T,Sata T,et al.Elevation of HMGB1 level during cardiac surgery using cardiopulmonary bypass[C].American Society of Anesthesiologists annual meeting 2010.USA:American Society of Anesthesiologists,2010.
[14]Ueki M,Kawasaki T,Hamada K,et al.Dexmedetomidine reduces HMGB1level during cardiac surgery using cardiopulmonary bypass[C].American Society of Anesthesiologists annual meeting 2011.USA:American Society of Anesthesiologists,2011.
