芦笋老茎堆肥中嗜热细菌的分离与鉴定
2013-07-23王丽芳陈婷婷韩建荣
王丽芳,陈婷婷,王 琪,韩建荣*
(1.山西大学 生命科学学院,山西太原 030006;2.山西大学 生物技术研究所,山西 太原 030006)
芦笋(Asparagus officinalisL.)为百合科天门冬属植物,原产欧洲南部地中海沿岸及小亚细亚,已有2 000多年的栽培历史。在西方,芦笋被视为珍贵上等、药食兼用的蔬菜,有“菜中之王”的誉称[1]。我国从美国引种芦笋以来,现种植面积已达6.67万 hm2以上[2],主要分布于福建、江苏、浙江、河南、安徽和山西等省[3],尤其山西省永济市,目前已成为年采收面积近2万hm2的全国最大芦笋生产基地。芦笋的可食部分是其嫩茎,嫩茎的采收有严格的季节限制和采收标准。每年在收获季节过后,芦笋的地上茎仍要继续生长,高度可长到1.5 m以上,有时甚至达到2 m以上,芦笋的这部分茎称之为芦笋老茎。与嫩茎相比,芦笋老茎由于木质纤维化程度较高,失去了食用价值,每年的产量要远大于可食用的芦笋嫩茎的量。大量的芦笋老茎收割后没有加以充分利用,只能任其自然腐败,或直接焚烧,这样既造成资源的极大浪费,也带来了严重的环境污染。因此,如何有效利用芦笋老茎是芦笋产地种植农户和加工企业急需解决的问题。由于多种农业废弃物可以用来栽培食用菌,所以作为食用菌培养料是利用芦笋老茎的有效途径之一。针对如何利用芦笋老茎资源的问题,本实验室开展了一系列的研究工作,已经证明了芦笋老茎经堆制发酵后可以用来栽培姬松茸(Agaricus blazei)[4]。蘑菇堆肥是一个复杂而又独特的微生态系统,是一种由群落结构演替非常迅速的多个微生物群体共同作用,有效分解有机物的动态生化过程[5-6]。国内外关于蘑菇培养料堆制发酵期间微生物的生物量、群落结构变化的研究已有大量报道[7-8]。由于芦笋老茎是一种不同于稻草、麦秆等秸秆的原料,所以其堆制发酵期间的微生物群落及其演替变化规律也必然不同于其他原料的堆料。要建立和完善针对芦笋老茎的堆制发酵工艺,进而得到一种高质量的蘑菇培养料,对于芦笋老茎堆制发酵期间微生物多样性的研究是非常必要的。研究表明,嗜热微生物(包括细菌、放线菌和真菌)是蘑菇堆肥高温期的主要优势菌群[9-10]。本研究对芦笋老茎堆肥中的嗜热细菌进行了初步的分离鉴定研究,旨在为下一步制备芦笋老茎堆料发酵菌剂以及调控堆料过程提供理论依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂药品 试剂盒:Real Times琼脂糖凝胶回收试剂盒和质粒小量提取试剂盒,购自中科瑞泰(北京)生物科技有限公司;Trans EasyTaqDNA polymerase(5 units/μL)、dNTP(10 mmol/L)、DNA相对分子质量标准品、FastDigestEcoRⅠ限制性内切酶(FD0274)、克隆载体pEASY-T3、宿主感受态细胞Trans 1-T1 Phage Resistant Chemically Competent Cell,均购自北京全式金生物技术有限公司;氨苄青霉素、IPTG、X-gal均购自上海生工生物工程有限公司;引物:细菌16S rDNA序列的通用引物(27F-1541R),由上海生工生物工程有限公司合成。
1.1.2 培养基 牛肉膏蛋白胨培养基[11]:用于细菌分离,使用前加入制霉菌素(30 U/mL培养基)。
1.2 方法
1.2.1 样品处理 堆肥配方(质量分数,%):芦笋老茎70,棉籽壳20,豆饼7.5,过磷酸钙1,石膏粉1,尿素0.5。按照二次发酵法进行堆料发酵,前发酵18 d,共翻堆4次,移入室内进行后发酵,60℃保持10 h,50℃保持4 d。以芦笋老茎堆料堆体四周及中心处为采样点,采样深度约20 cm左右,四分法采样。在前发酵每次翻堆前和后发酵前后共采样6次,采样时间分别为建堆后第4天、第6天、第9天、第11天、第15天和第22天,采集的样品依次编号为A、B、C、D、E和F,每次取样量为500 g,按每袋100 g装入无菌牛皮纸袋,该样品必须在0~4℃保存,并尽快进行后续实验。
1.2.2 菌株分离 准确称取1 g堆肥样品于99 mL装有玻璃珠的无菌水中,充分振荡后,静置,采用倍比稀释法将样品稀释至10-3、10-4、10-5、10-6稀释度。分别吸取10-4、10-5、10-6稀释度悬液0.2 mL,涂布于牛肉膏蛋白胨平板,每个稀释度涂3个,45℃培养12 h后观察,并挑取单菌落。将分离到的菌株分别编号。
1.2.3 菌株鉴定 ①细菌16S rDNA PCR扩增模板的制备:采用菌落PCR方法[9]制备细菌的16S rDNA片段。具体步骤:每株菌取10个单菌落,加1 mL ddH2O煮沸5 min后,12 000 r/min离心2 min,取上清液作为模板进行PCR扩增;②16S rDNA片段的PCR扩增:为了获得高质量的16S rDNA PCR产物,对模板量和菌落煮沸时间进行了比较。模板量设计如下5个梯度:2.5、5.0、7.5、10.0和12.5 μL。煮沸时间设计如下5个梯度:1、3、5、7和9 min。反应体系(25 μL):10×Trans EasyTaqBuffer,2.5 μL;dNTP,1 μL;引物(20 μmol/L)各2.5 μL;Trans EasyTaqDNA polymerase,0.5 μL;DNA 模板,0.5 μL;ddH2O 补至25 μL。各试剂加好后,轻轻混匀。阴性对照不加模板。反应条件:预变性94℃、5 min;变性94℃、30 s;退火55℃、30 s;延伸72℃、90 s;35个循环后,72℃保温10 min。扩增产物和回收产物均经1%的琼脂糖凝胶电泳分离,UV凝胶成像系统检测;③16S rDNA片段PCR产物的连接、转化、测序:1)连接:向无菌离心管中加入目的片段16S rDNA回收产物4 μL和载体1 μL,混匀后于25℃反应30 min,4℃反应16 h;2)转化(无菌操作):a.取感受态细胞(100 μL),将5 μL 连接产物全部加入其中,温和混匀,冰浴放置30 min;b.迅速转入42℃水浴,热激30 s,再迅速冰浴冷却2 min后,加入900 μL LB培养基,37℃下90 r/min振荡培养50 min;c.取上述菌液,12 000 r/min离心2 min,弃去上清液900 μL,剩下的100 μL,加入10 μL IPTG(质量分数 20%)和20 μL X-gal(20 mg/mL),混匀后,轻轻涂到LB平板(含有氨苄青霉素,其终浓度为50 μg/mL),涂匀。37℃培养12~16 h后可见蓝色或浅黄色菌落;3)重组子的扩大培养:a.挑取连接转化体单菌落接种于LB液体培养基(含有氨苄青霉素,其终浓度为50 μg/mL)中,37℃下200 r/min过夜培养;b.将培养好的菌液分成2管,1管提取质粒DNA作酶切筛选用,另1管留作测序用。EcoRⅠ限制性内切酶酶切筛选:向无菌EP 管中依次加入8 μL ddH2O、0.5 μLEcoR Ⅰ Buffer、1 μL 质粒DNA、0.5 μLEcoRⅠ,于37℃反应2 h。反应结束后,产物经0.7%琼脂糖凝胶电泳检测,含有目的片段重组子的大小总共约为4 600 bp;4)重组子测序:选取含目的片段的重组子进行测序。测序由华大基因研究中心完成。克隆编号方法:因为本实验样品来自于芦笋老茎堆料(Asparagus old stem compost),所以克隆编号方法为“ASC+重组子号”;④菌株16S rDNA序列的同源性分析:将测序获得的阳性克隆的16S rDNA序列运用CHECK_CHIMERA程序在线进行嵌合体检验并去除明显的Chimera序列。在GenBank数据库(http://www.ncbi.nlm.gov/)中用VECTOR SCREEN程序剔除载体序列,经BLAST比对后对菌株进行同源性分析。将本实验获得的序列与GenBank数据库中最相似的序列一起使用软件Clustal X 1.8和MEGA 3.1,采用邻近法(Neighor Joining)法,在Kimura双参数模型(Kimura 2-parameter)下,绘制相关菌株的系统发育树,Bootstrap检验系统树;⑤16S rDNA序列在GenBank数据库中的登录号:本实验所获得的16S rDNA序列均已提交GenBank数据库,登录号分别为JQ795996~JQ796008。
2 结果与分析
2.1 菌株的分离
45℃条件下,采用稀释涂布法和划线分离法从芦笋老茎堆肥6个样品中共分离出菌落形态有明显区别的22株细菌,其中A样品6株,B样品6株,C样品4株,D样品2株,E样品2株,F样品2株。
2.2 菌株16S rDNA的PCR扩增
实验结果表明:模板生物量对PCR扩增效果影响不大,只要在2.5~12.5 μL 范围内即可得到理想的PCR产物(图1);煮沸时间对PCR结果有影响,煮沸时间不能太长,1、3、5 min都可以得到较理想的PCR产物,而7 min和9 min的目的产物较少而非特异性产物较多(图2)。
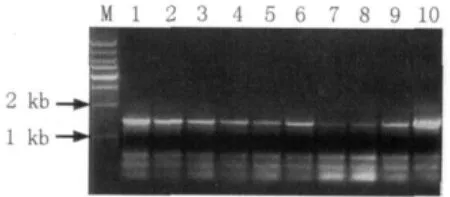
图1 模板量对16S rDNA PCR扩增的影响Fig.1 Effect of amounts of template on PCR-amplified 16S rDNA
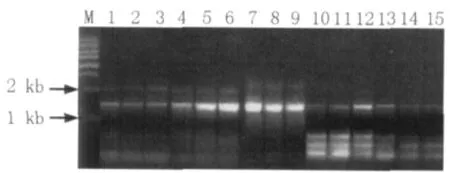
图2 煮沸时间对16S rDNA PCR扩增的影响Fig.2 Effect of boiling times on PCR-amplified 16S rDNA
2.3 菌株16S rDNA序列的测定和比对
分离到的22株嗜热细菌的16S rDNA测序结果经BLAST比对结果见表1,同源性分析结果如下:A样品中,6株均属于芽胞杆菌属(Bacillus),分别与地衣芽胞杆菌Bacilluslicheniformis(GU191905)、Bacillus massilliensis(DQ350816)、枯草芽胞杆菌枯草亚种Bacillus subtilissubsp.subtilis(GU191916)、芽胞杆菌Bacillussp.(EU362153)、蜡状芽胞杆菌Bacilluscereus(FJ189786)、嗜热淀粉芽胞杆菌Bacillus thermoamylovorans(HM030742)的同源性最高。

表1 样品中的细菌菌株16S rDNA序列的比对结果Table1 Identification of the bacteria strains isolated from six samples by the 16S rDNA
B样品中,1株属于假黄色单胞菌属(Pseudoxanthomonas),1株属于肠杆菌属(Enterobacter);4株属于芽胞杆菌属,分别与地衣芽胞杆菌Bacillus licheniformis(GU191905)、Bacillus massilliensis(DQ350816)、蜡状芽胞杆菌Bacillus cereus(FJ189786)、嗜热淀粉芽胞杆菌Bacillus thermoamylovorans(HM030742)的同源性最高。C样品中,1株属于芽胞杆菌属,1株属于假黄色单胞菌属(Pseudoxanthomonas),1株属于类芽胞杆菌属(Paenibacillus),1株与短短芽胞杆菌Brevibacillus brevis(AP008955)的同源性最高。D样品中,1株与地衣芽胞杆菌Bacillus licheniformis(GU191905)的同源性最高,菌株D-b2在Gen-Bank数据库中未找到与其相似的已知细菌序列,分类地位待定。E样品中,1株与嗜热淀粉芽胞杆菌Bacillus thermoamylovorans(HM030742)的同源性最高,1株与Pseudoxanthomonassp.(HQ912776)的同源性最高。F样品中,1株与Pseudoxanthomonassp.(HQ912776)的同源性最高,1株与副球菌Paracoccussp.(EF070124)的同源性最高。从鉴定结果可以看出样品间菌株有重复,根据同源性分析的结果将6个样品中的12株细菌的16S rDNA序列和同源性最高的已知菌株的序列构建系统发育树(图3)。从本实验的结果可以看出,芦笋老茎堆肥中的嗜热细菌主要是芽胞杆菌(Bacillusspp.)和假黄色单胞菌(Pseudoxanthomonasspp.)。
3 讨论
常规PCR扩增前需要制备、纯化模板DNA,其方法主要有酸酚法、碱酚法、碱性SDS裂解法、煮沸裂解法和氯化铯-溴化乙锭密度梯度离心法等[12]。这些方法各有其优缺点:有的操作繁琐、难度大,有的成本较高。例如,作为一种经典的方法,酚-氯仿抽提法是通过蛋白酶K的消化及有机试剂酚、氯仿的抽提获得基因组DNA。这种方法获得的DNA虽然质量较高,但试剂昂贵,操作繁琐,需要一些特殊处理,因此DNA的产率较低,需要大量的菌种材料。另外,酚、氯仿等试剂不仅对DNA有害,而且其残留还会抑制PCR反应中Taq酶的活性[13]。菌落PCR方法最早是由Güssow和Clackson[14]提出的。用无菌牙签挑取单个菌落到TE缓冲液中,煮沸5 min,漩涡振荡后短暂离心,用1~2 μL裂解液作为DNA模板。该方法省去抽提模板DNA这一步,不失为一种准确、快速、经济的好方法[15]。
本实验尝试采用菌落PCR方法,不提取基因组DNA,而是直接以菌体煮沸后暴露的DNA为模板进行PCR扩增。实验对模板生物量和煮沸时间分别设计了5个梯度,结果证明该方法可以很好地大规模地对芦笋老茎堆料中分离到的多个菌株进行鉴定。不仅提高了实验效率、降低了实验成本,还可减少或避免因操作步骤过多产生污染所带来的假阳性等问题,是一种切实可行的检测和监测方法。
国内外有大量关于蘑菇堆肥中微生物的研究报道[16-19]。在前发酵阶段,料温升至60℃以上时,细菌大量繁殖,降解掉原料中简单的易被降解的糖类物质[20]。从本实验的结果可以看出,芦笋老茎堆肥中的嗜热细菌主要是芽胞杆菌(Bacillusspp.)、假黄色单胞菌(Pseudoxanthomonasspp.),这与文献报道的其他秸秆堆肥中的优势嗜热可培养细菌基本相符[16-19]。值得注意的是本实验分离得到的细菌中有1株在GenBank数据库中未找到与其相似的已知菌株的序列,分类地位待定,这为下一步从芦笋老茎堆料中筛选分离有价值的新嗜热可培细菌提供了可能。
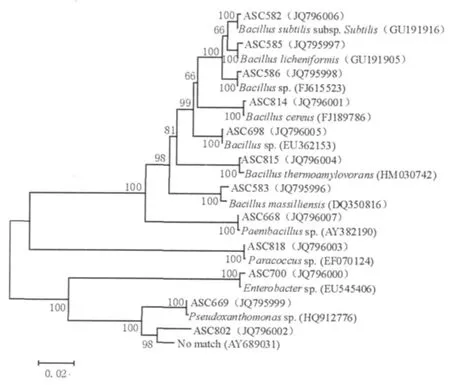
图3 样品中12株细菌的16S rDNA序列系统发育树Fig.3 Phylogenetic tree based on the 16S rDNA sequences of 12 strains from the samples
[1]龙全江,杨韬.芦丁的研究概况及展望[J].中国中医药信息杂志,2002,9(4):39-41.
[2]顾振新,张建惠.芦笋弃料的营养价值和开发利用研究[J].南京农业大学学报,1994,17(2):111-117.
[3]孙春艳,赵伯涛,郁志芳,等.芦笋的化学成分及研究进展[J].中国野生植物资源,2004,23(5):1-5.
[4]Wang Q,Li B B,Li H,et al.Yield,dry matter and polysaccharides content of the mushroomAgaricus blazeiproduced on asparagus straw substrate[J].Scientia Horticulturae,2010,125:16-18.
[5]万水霞,郭熙盛,朱宏赋,等.自然堆肥过程中微生物群落的动态变化[J].安徽农业科学,2009,37(28):13710-13711,13749.
[6]李世贵,王飞,顾金刚,等.微生物菌剂在农业废弃物堆肥腐熟过程中的应用及其田间试验效果[J].微生物学杂志,2011,31(6):62-65.
[7]Song J,Weon H Y,Yoon S H,et al.Phylogenetic diversity of thennophilic actinomycetes andThermoactinomycesspp.isolated from mushroom composts in Korea based on 16S rRNA gene sequence analysis[J].FEMS Microbiology Letters,2001,202(1):97-102.
[8]Yang H,Hang X M,Li D T,et al.Analysis of fungi in the mushroom compost using PCR and TGGE of ribosomal DNA[J].Journal of Shanghai Jiaotong University,2002,E-7(1):119-122.
[9]Mitali D,Todd V R,Laura G L.Diversity of fungi,bacteria and actinomycetes on leaves decomposing in a stream[J].Applied and Environmental Microbiology,2007,73(3):756-767.
[10]Xi B D,Liu H L,Zeng G M,et al.Composting MSW and sewage sludge with effective complex microorganisms[J].Journal of Environmental Sciences,2002,14(2):264-268.
[11]范秀容,李广武,沈萍.微生物学实验[M].北京:高等教育出版社,1989.
[12]萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T.分子克隆实验指南(第2版)[M].北京:科学出版社,1999,19-30.
[13]刘伏玲,倪晓燕,马咸成.基因DNA制备方法的探讨[J].中国现代医学杂志,2002,12(9):70-76.
[14]Güssow D,Clackson T.Direct clone characterization from plaques and colonies by the polymerase chain reaction[J].Nucleic Acids Research,1989,17(10):4000.
[15]唐晔盛,李英.菌落PCR在大规模基因组测序中的应用[J].生物化学与生物物理进展,2002,29(2):316-318.
[16]Sparling G P,Fermor T R,Wood D A.Measurement of the microbial biomass in composted wheat straw and the possible contribution of the biomass to the nutrition ofAgaricus bisporus[J].Soil Biology and Biochemistry,1982,14(6):609-611.
[17]Hayes W A.Microbiological changes in composting wheat straw/horse manure mixture[J].Mushroom Science,1968,7:173-186.
[18]Fergus C L.Thermophilic and thermotolerant molds and actinomycetes of mushroom compost during peak-heating[J].Mycologia,1964,56:267-284.
[19]Adams J D W,Frostick L E.Investigating microbial activities in compost using mushroom(Agaricus bisporus)cultivation as an experimental system[J].Bioresource Technology,2008,99(5):1097-1102.
[20]Strom P F.Effect of temperature on bacterial diversity in thermophilic solid waste composting[J].Applied and Environmental Microbiology,1985,50(4):899-905.