低能离子诱变烃降解菌所产表面活性剂的研究
2013-07-23向廷生郭晓博张祥胜
向廷生,郭晓博,张祥胜
(1.长江大学油气资源与勘探技术教育部重点实验室,湖北荆州 434023;2.长江大学地球环境与水资源学院,湖北荆州 434023;3.盐城师范学院生命科学与技术学院,江苏盐城 224002)
大量的研究表明,生物表面活性剂可以通过胶束来渗透、润湿、乳化、消泡等作用促进石油的利用,有效提高石油烃的降解,加快油污土壤的修复过程。生物表面活性剂分子结构一般包括亲水性离子基团和长链疏水基团2个部分,表面活性剂分子的2个部分的基团通常是不对称的,亲水基可以是酯、羟基、磷酸盐、羧酸盐基团或者是糖基,憎水基可以是蛋白质,或者是含有憎水性支链的缩氨酸等,此种结构上的两亲特点,决定了表面活性剂的许多物理化学性质,不同结构的生物表面活性剂有不同的表面活性,因此为了发挥生物表面活性剂的功能,就必须对其物理化学性质进行系统的研究[1-3]。
1 材料与方法
1.1 材料
1.1.1 出发菌 烃降解菌8-11,本实验室由大庆油田污染土壤中分离并保存。
1.1.2 培养基 ①无机盐培养基:MgSO4·7H2O 0.2 g,K2HPO41.0 g,KH2PO41.0 g,NH4NO31.0 g,FeSO40.05 g,CaCl20.02 g,水 1 000 mL,pH 7.0~7.2;②油平板培养基:无机盐培养基+18 g琼脂+2 g原油;③烃降解摇瓶培养基:无机盐培养基+2 g原油;④葡萄糖发酵培养基:无机盐培养基+13 g葡萄糖;⑤实验用油:大庆油田南6-40-丙619井。
1.2 方法
1.2.1 样品处理及离子注入 ①样品制备:菌株活化培养24 h后,菌液用生理盐水稀释至相应倍数后,取0.1 mL涂布于90 mm平皿上,置超净工作台吹干,并设真空对照;②N+离子注入处理:离子注入在中国科学院等离子体物理研究所离子束生物工程学重点实验室采用离子束生物工程装置进行。注入参数:20 keV N+,脉冲式注入,间隔10 s,每个脉冲30个单位,每个单位注入剂量为2.6×1013个离子/cm2,注入速度约为每秒2个单位,靶室真空度约为10-2Pa,束流400 μA。注入剂量分别为0、30、60、90、120、150个单位,每个剂量均设真空对照(即注入剂量为0),并做3个平行样;③N+离子注入菌株存活率及突变率测定:存活率是通过注入前后活菌计数来测定的,注入结束时,用1 mL生理盐水将平皿中的菌体洗下,稀释后涂于肉胨培养基,37℃培养48 h后计算存活率,存活率=各处理剂量的总单菌落数/真空对照的总单菌落数。各剂量处理菌的发酵液表面张力值分别与真空对照组比较,统计出正突变率(表面张力值比出发菌株降低≥5.0%)和负突变率(表面张力值比出发菌株提高≤5.0%);④发酵液表面张力测定:采用上海衡平仪器仪表厂生产的BZY-1表面张力仪测定发酵液表面张力;⑤生物表面活性剂排油活性测定:取一培养皿,加50 mL去离子水,水面上加0.1 mL石蜡形成油膜,在油膜中心滴入10 μL摇瓶发酵液,中心油膜被挤向四周形成一圆圈,圆圈直径与表面活性剂活性成正比[4-5],测量圆圈直径大小;⑥产物特性分析:取出培养168 h的发酵液,8 000 r/min离心30 min,去除发酵液里的菌体和杂质。上清液用6 mol/L HCl调pH至2.0,出现絮状沉淀,4℃静置12 h;10 000 r/min、4℃离心30 min收集沉淀;用少量的pH 2.0的HCl洗涤沉淀,1 mol/L NaOH将沉淀调至pH 7.0,然后用CH2Cl2萃取,振荡20 min后静置12 h,取出下层溶液即产物。旋转蒸发仪减压蒸干即得表面活性剂粗品[4]。二氯甲烷抽提后烘干称重,用傅立叶变换红外光谱仪分析产物成分;⑦石油烃降解率测定:发酵液过滤除去菌体和培养基,将二氯甲烷洗脱的残油液用活化的颗粒状无水硫酸钠脱水,过滤后用旋转蒸发仪蒸干,转置预先恒重的小瓶中。氮气吹脱至恒重,采用重量法测定培养液中残油含量,与对照培养液比较计算烃降解率。石油降解率的计算公式:
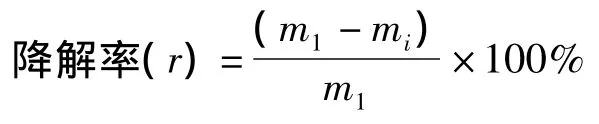
其中,m1为初始培养基中石油质量,mi为培养id后剩余的石油质量[7]。烃降解菌8-11,筛选出的诱变菌23,系本实验室由大庆油田污染土壤中分离并保存。
1.2.2 样品处理及离子注入 ①样品制备:菌株活化培养24 h后,菌液用生理盐水稀释至相应倍数后,取0.1 mL涂布于90 mm平皿上,置超净工作台吹干,并设真空对照;②N+离子注入处理:离子注入在中国科学院等离子体物理研究所离子束生物工程学重点实验室采用离子束生物工程装置进行。注入参数:20 keV N+,脉冲式注入,间隔10 s,每个脉冲60个单位,每个单位注入剂量为2.6×1013个离子/cm2,注入速度约为每秒2个单位,靶室真空度约为10-2Pa,束流400 μA。注入剂量分别为0、30、90、150个单位,每个剂量均设真空对照(即注入剂量为0),并做3个平行样;③N+离子注入后的突变菌筛选:经过油平板的筛选,筛选出3株能产生较大噬油斑的突变株。根据排油能力和表面张力的测定,最终筛选出1株产表面活性剂能力强且能较好降解原油的诱变菌23。经过测定,诱变菌23发酵液的表面张力值从空白对照的56.1 mN/m降低为29.3 mN/m,比出发菌降低了3.4 mN/m,排油圈直径为7.3 cm,表明发酵液中有较多的生物表面活性剂产生。
2 结果与分析
2.1 菌株产表面活性剂与菌体生长的关系
本实验采用分光光度计测定不同培养时间细菌的菌量,在恒定的培养条件下,绘制菌株的生长曲线,由此来反映菌株在发酵培养基中的生长情况。由图1可见,初始阶段发酵液的表面张力随菌体量的增加而降低,一段时间内菌量缓慢增加,表面张力也慢慢开始降低,在45 h时细菌生长达到最高峰,发酵液的表面张力也降到最低;继续发酵,菌数和表面活性剂的量都有所降低,可见,菌株产表面活性剂的方式为生长相关型。
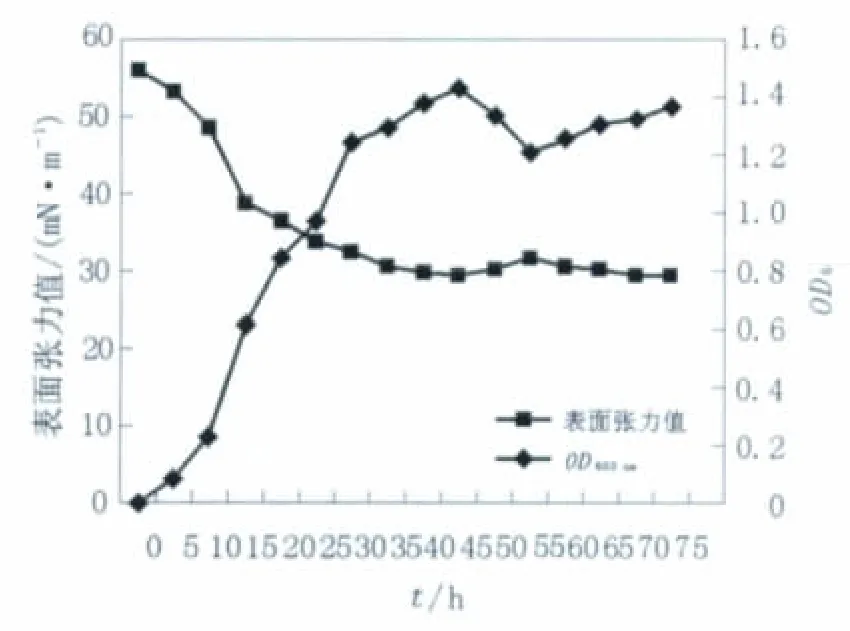
图1 菌浓度和表面张力随时间的变化Fig.1 The changes of the strain concentration and the surface tension in optimized culture medium
2.2 生物表面活性剂的提取、纯化与定性
生物表面活性剂的提取、纯化见1.2.1⑥。
2.2.1 离子型分析 采用亚甲基蓝-氯仿试验鉴别离子型表面活性剂。取上清液,加入三氯甲烷和亚甲基蓝溶液,剧烈振荡后,充分混匀,静置并观察。如果氯仿层呈蓝色证明有阴离子存在,则该菌产生的生物表面活性剂为阴离子型[4-5,7]。在亚甲基蓝-氯仿实验,氯仿层明显变蓝,所以判断该菌所产出的表面活性剂为阴离子型,见图2。
2.2.2 定性分析 薄层色谱(TLC)分离:取发酵液离心,上清用等体积氯仿/甲醇(2/1,体积比)混合,静置,离心,取上清进行薄层层析,以氯仿/甲醇/水为展开剂,待展开剂最前沿移至硅胶板上缘时,取出,干燥后对产生的表面活性剂进行分析结果表明,本实验所筛选得到的菌株所产生物表面活性物质主要成分为糖脂类物质[8-10]。图3红外光谱的分析表明,3 200/cm处是由分子链间氢键引起的N—H键的伸缩振动;2 860、1 375/cm处吸收带为脂肪族肽链中C—H键的强振动;1 700~1 730/cm是内酯羰基C=O的伸缩振动;1 000~1 100/cm为芳基烷基中—C—O—C—的伸缩振动;说明分子中有一个五元环状内酯和糖苷键存在。上述结果表明,本实验所筛选得到的菌株所产生物表面活性物质主要成分为糖脂类物质。

图2 亚甲基蓝-氯仿实验Fig.2 Ethylene blue-Chloroform experiment
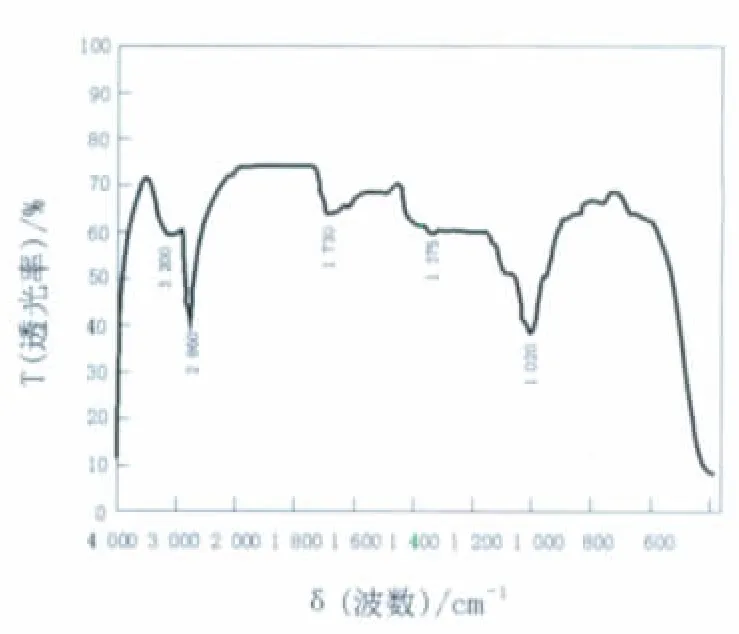
图3 生物表面活性物质红外光谱图Fig.3 The IR chart of biosurfactants
2.3 生物表面活性剂的临界胶束浓度测定
表面活性剂是一种两性分子,既含有亲水基,又含有憎水基,通常2个基团是不对称的[11],结构上的两亲性决定了其能定向的吸附于两相界面,聚集形成单分子层以表面活性剂浓度为横坐标,溶液表面张力为纵坐标作图,曲线的转折点所对应的浓度即为临界胶束浓度。
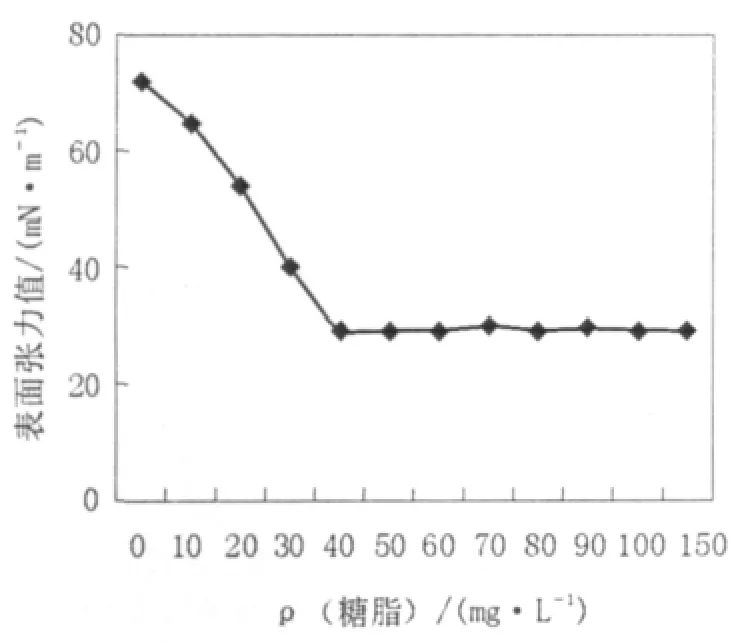
图4 表面张力法测定菌株产生的表面活性剂的临界胶束Fig.4 Determination by surface tension for CMC of strain 23
实验结果(如图4)表明,由菌株产生的生物表面活性物质在很低的浓度时就可以达到临界胶束浓度,从而使表面张力降到最低,这说明表面活性物质是非常有效的,也说明表面活性剂的应用潜力是很大的。
2.4 不同因素对生物表面活性剂表面活性的影响
2.4.1 温度的影响 为了测定温度对糖脂类生物表面活性剂表面活性的影响,取纯化得到的表面活性剂样品溶于pH 7.0的蒸馏水,制备浓度大于CMC的50 mg/L的糖脂溶液,分别加热至30、40、50、60、70、80、90、100℃并保持2.5 h,待冷却至室温后测定溶液的表面张力值经实验结果如图5糖脂类表面活性剂对温度并不敏感,有很好的稳定性,表现出较强的高温耐受性。
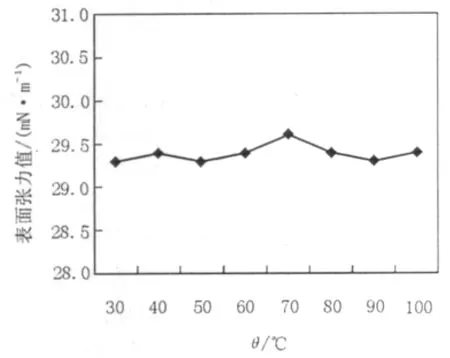
图5 温度对表面活性剂表面活性的影响Fig.5 The effect of temperature on surface tension of biosurfactant
为了进一步考察糖脂对热的稳定性,结果如图6可以看到该糖脂表面活性剂对热较稳定,100℃水浴10 h后仍保留原活性的60%,但14 h后几乎完全失去活性,该糖脂类表面活性剂的这一特点对其在高温条件下的使用是较好的。
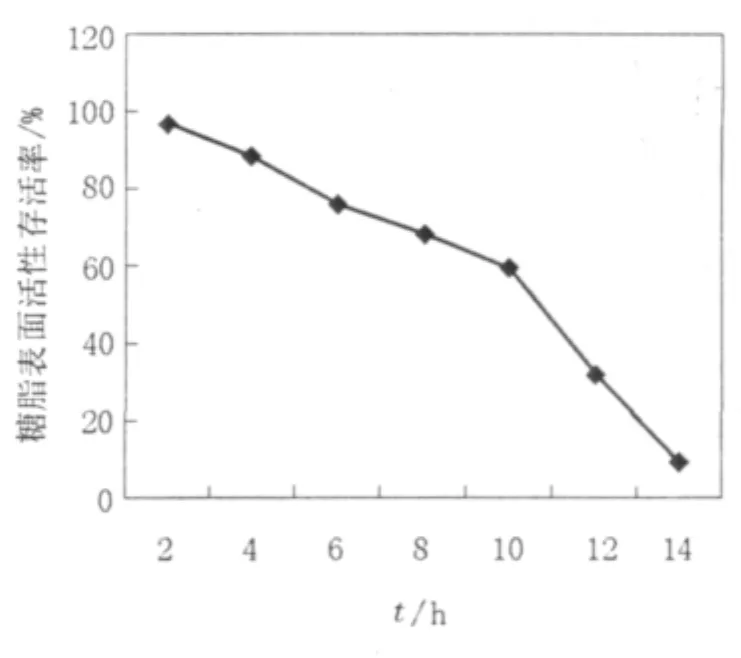
图6 糖脂表面活性剂的热稳定性Fig.6 The influence of temperature to surface tension of biosurfactant solution
2.4.2 pH值的影响 取纯化得到的表面活性剂样品溶于pH 7.0的蒸馏水,制备浓度大于CMC的50 mg/L的糖脂溶液,分别用NaOH和HCl将pH值调为2、3、4、5、6、7、8、9、10、11、12,放置24 h后,测定不同pH值下的糖脂水溶液的表面张力值,考察其对酸碱的耐受度。由图7看出,在pH 2.0~5.0范围内,该糖脂表面活性剂溶液的表面张力值基本不受影响,在pH 5.0之后随着pH的升高,其表面张力逐渐升高;当pH大于8.0后表面张力明显增高,表面活性下降,由此可以看出,该糖脂类表面活性剂在碱性条件下不稳定,但在酸性条件下较稳定。
2.4.3 盐度的影响 取纯化得到的表面活性剂样品溶于pH 7.0的蒸馏水,制备浓度大于CMC的50 mg/L的糖脂溶液,加入一定量的NaCl搅拌均匀,使其浓度为0、2%、4%、6%、8%、10%、12%、14%、16%、20%、30%,放置24 h,待其充分溶解后在30℃下测不同NaCl浓度的糖脂溶液的表面张力值,考察其对盐的耐受度。实验结果表明,该糖脂类生物表面活性剂对盐有极高的耐受性,浓度高达14%的盐对糖脂表面活性剂溶液表面张力没有明显影响,这种良好的抗盐性为其在不同条件下进行环境生物修复的应用创造了较好的基础,见图8。
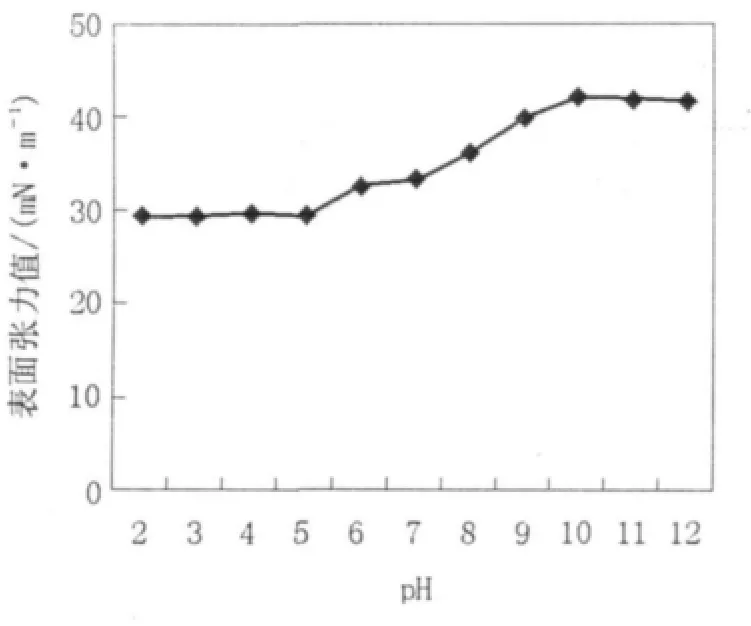
图7 pH对表面活性剂表面活性的影响Fig.7 The effect of pH on surface tension of biosurfactant
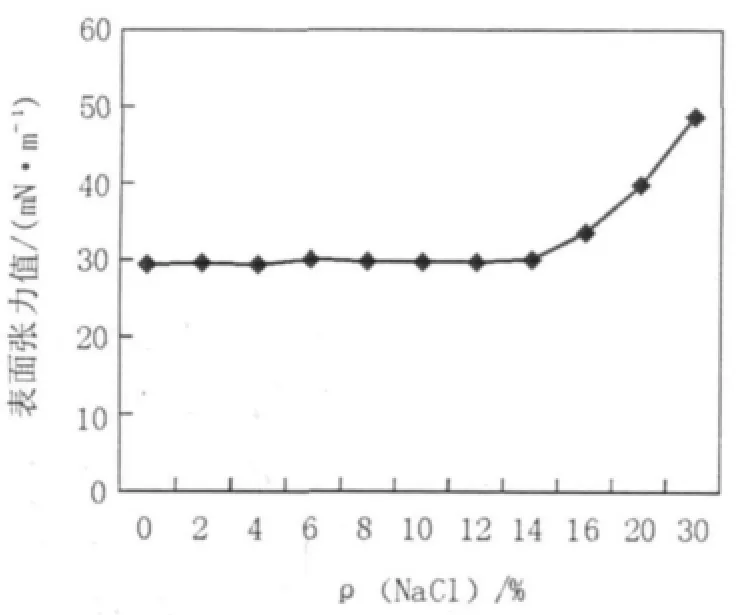
图8 NaCl浓度对表面活性剂表面活性的影响Fig.8 The effect of NaCl concentration on surface tension of biosurfactant
2.5 生物表面活性剂对烃的乳化性能分析
许多微生物在以烃为碳源的培养基中生长可诱导细胞产生生物表面活性剂,这些生物表面活性剂有助于培养基中烃基质的乳化,并能刺激微生物对烃的摄取,促进菌体细胞生长,继而提高烷烃的降解率[12-13]。将发酵液与石蜡各5 mL混合,充分振荡3 min后,油水形成均匀的白色乳化液,将乳化液倒入量筒中于室温条件下静止放置,待出现清晰的水油界面时开始观察乳化层的体积,每隔12 h测定两相体积数,室温下连续观察20 d,并计算乳化指数,绘出生物表面活性剂对石蜡的乳化指数随时间变化的关系图,见图9。实验结果说明该糖脂类生物表面活性剂具有很好的乳化活性,在微生物采油、环境生物修复和食品工业等领域将有广阔的应用前景。

图9 生物表面活性剂的乳化性能Fig.9 The biosurfactants the emulsifying properties
2.6 生物表面活性剂对原油降解率的影响
2.6.1 添加量的影响 将生物表面活性剂配制成100 mg/L的溶液,设置不加生物表面活性剂的原油培养基为空白,分别取2、4、6、8和10 mL加入原油培养基中,原油培养基中烃降解菌的接种量为2 mL,25℃,180 r/min培养7 d后测定原油的降解率,见图10。
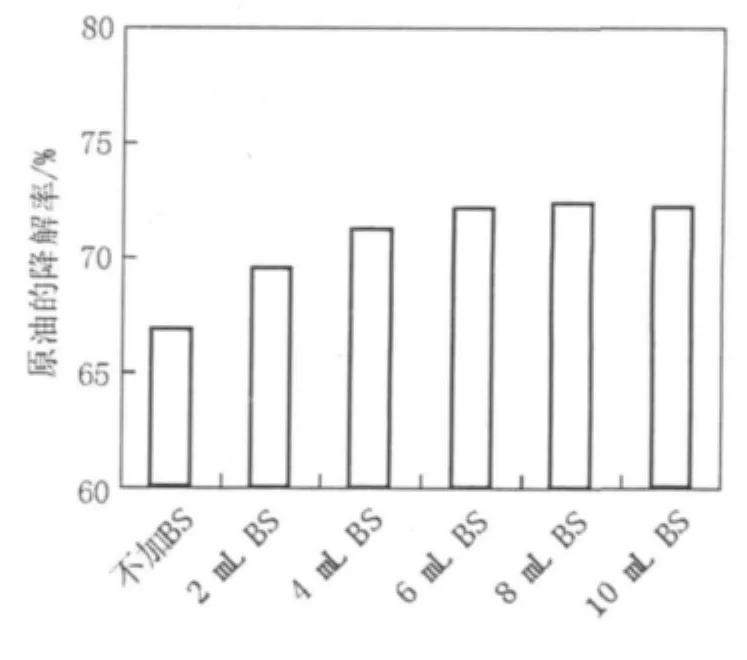
图10 生物表面活性剂的添加量对原油降解率的影响Fig.10 The affection of adding amount of biosurfacants on oil degradation
从图10看出,添加生物表面活性剂后原油的降解率显著增加,但当生物表面活性剂加到一定量时,原油的降解率并没有显著增加。
2.6.2 添加时间的影响 取2 mL 100 mg/L的生物表面活性剂溶液加入原油培养基中,添加时间分别为加菌前8、4 h,和菌同时加入,加菌后4、8 h,25℃,180 r/min振荡培养7 d后测定原油的降解率。从图11可以看出,先加生物表面活性剂再加烃降解菌有利于更大程度的提高原油的降解率。
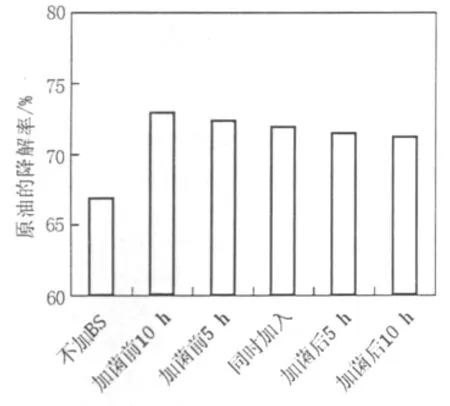
图11 生物表面活性剂的添加时间对原油降解率的影响Fig.11 The affection of adding time of biosurfacants on oil degradation
3 讨论
菌株产生物表面活性剂的方式为生长相关型,菌株发酵液初提后得到棕黄色粉末状物质,经薄层层析和红外光谱分析,初步判断为糖脂类生物表面活性剂,亚甲基蓝-氯仿实验显示该离子型为阴离子型,菌株所产生物表面活性剂的CMC为40 mg/L,对其乳化特性进行研究发现,在起始的48 h内,乳化体积呈下降趋势,但下降速度很慢,72 h后,发酵液的乳化体积仍能达到75%,并能持续较长时间,说明该生物表面活性剂对石蜡乳化性能稳定,増溶效果良好。对高温,高盐和酸有较强的耐受力,在温度20~100℃,盐浓度0%~14%,pH 2~14显示出较好的表面活性。
随着生物表面活性剂添加量的增加,原油的降解率增加,但当生物表面活性剂添加到一定量时,原油的降解率趋于平缓,在使用中考虑到生物表面活性剂的制备提纯较复杂,成本较高,因此其最佳添加量为60 mL/L,原油降解率可显著提高。先添加生物表面活性剂将原油乳化后有利于烃降解菌对原油的摄取,从而提高原油的降解率。
[1]傅时波,李尔炀.生物表面活性剂检测方法的研究[J].江苏工业学院学报,2007,19(2):23-25.
[2]宁长发,沈薇,孟广荣.产生物表面活性剂菌种的一种快速筛选模型[J].微生物学通报,2004,31(3):55-58.
[3]梁为,李奕松,王有年,等.产生生物表面活性剂相关菌的分离及鉴定[J].北京农学院学报,2008,23(1):34-37.
[4]夏晶晶,佘跃惠,张雪梅.大庆油田聚合物驱后产生物表面活性剂本源菌研究[J].长江大学学报(自然科学版)理工卷,2008,5(1):166-169.
[5]Wu JY,Yeh KL,Lu WB,et al.Rhamnolipid production with indigenous Pseudomonas aeruginosa EM1 isolated from oil-contaminated site[J].Bioresource Technology,2008,99(5):1157-1164.
[6]Liu Qingmei,Yuan Hang,Wang Jun et al.A Mutant of Bacillus subtilis with High-producing Surfactin by Ion Beam Implantation[J].Plasma Science & Technology,2006,8(4):491-496.
[7]丁立孝,何国庆,刘晔,等.脂肽生物表面活性剂产生菌的筛选[J].农业生物技术学报,2004,12(3):330-333.
[8]Mishra S,Tyot J,Kuhad RC,et al.Evaluation of inoculum addition to stimulate in situ bioremediation of oily-sludge-contaminated soil[J].Applied and Environmental Microbiology,2001,67(4):1675-1681.
[9]潘冰峰,徐国梁,施邑屏,等.生物表面活性剂产生菌的筛选[J].微生物学报,1999,39(3):264-267.
[10]余增亮,邱励俭,霍裕平.离子注入生物效应及育种研究进展[J].安徽农学院学报,1991,18(4):251-257.
[11]张凡,佘跃惠.排油圈法对生物表面活性剂的定性与定量[J].化学工程师,2005,(1):14-15,38.
[12]周金葵,王大威,廖明清,等.1株石油烃降解菌的筛选及性能评价[J].大庆石油地质与开发,2007,26(6):119-123.
[13]汪杰,郑维爽,礼晓,等.高效石油降解菌的筛选鉴定及修复能力研究[J].环境科学学报,2010,30(6):1228-1234.