应用酶联免疫法检测组织工程骨牛血清白蛋白残余量的实验研究
2013-07-13邹文焘刘广鹏孙剑崔磊
邹文焘,刘广鹏,孙剑,崔磊
应用酶联免疫法检测组织工程骨牛血清白蛋白残余量的实验研究
邹文焘,刘广鹏,孙剑,崔磊
200072 上海,同济大学附属第十人民医院耳鼻咽喉头颈外科(邹文焘),整形外科(刘广鹏);200235 上海组织工程研究与开发中心(孙剑、崔磊)
检测常规体外构建的组织工程骨中牛血清白蛋白残余量,并探讨减少其残留量的方法。
体外分离培养人骨髓基质干细胞,取第 2 代细胞(P2)接种于完全脱钙骨支架材料并成骨诱导培养 2 周,体外构建组织工程骨。成骨诱导液为含 10% 胎牛血清的条件培养液,并于检测前 1 天更换为无血清的条件培养液。待测组织工程骨先经 1:100(v:v)生理盐水浸洗 3 次,然后加入磷酸盐缓冲液(PBS),37 ℃振荡浸提 24 h,获取浸提液。同法获取未接种细胞的单纯支架材料的浸提液作为对照组。采用酶联免疫法检测样品浸提液中牛血清白蛋白的残余量,比较两者牛血清白蛋白残余量的差异。
经生理盐水洗涤 3 次后,洗涤液中的牛血清白蛋白含量明显降低。酶联免疫法测定的组织工程骨与单纯支架材料的牛血清白蛋白残余量分别为(15.57 ± 5.82)ng 和(14.85 ± 5.06)ng,单位重量的牛血清白蛋白残余量分别为(0.254 ± 0.088)ng/mg 和(0.306 ± 0.079)ng/mg,两组相比均无显著性差异(> 0.05,n = 10)。
酶联免疫法适用于组织工程骨中牛血清白蛋白残余量的检测。因为支架材料较细胞更易吸附牛血清白蛋白,现有条件下构建的组织工程骨牛血清白蛋白残余量仍然较高,需要继续探索降低其残余含量的新方法。
血清白蛋白,牛; 酶联免疫吸附测定; 组织工程骨; 残余量
胎牛血清(fetal bovine serum, FBS)是重要的细胞培养介质,其主要成分有牛血清白蛋白(bovine serum albumin,BSA)、免疫球蛋白、转铁蛋白及其他细胞生长因子等。而 BSA是其中含量最高的蛋白质成分(> 40%),作为异种蛋白,BSA 残余量过高会导致人体过敏反应。因此药典规定疫苗成品的 BSA 残余量每件不超过 50 ng[1]。
1 材料与方法
1.1 材料
1.1.1 试剂 定量检测牛血清白蛋白酶联免疫试剂盒(40 ng/ml),购自无锡博生医用生物技术开发有限公司;DMEM 低糖培养基购自 Gibco 公司;FBS 购自 Hyclone 公司;地塞米松、β-磷酸甘油钠和维生素 C 为美国 Sigma 公司产品。
1.1.2 仪器 Beckman XL90 低温离心机为德国 Beckman 公司产品;Bio-Rad iMark 酶标仪为美国 Bio-Rad 公司产品;TC-100B 恒温水平摇床为上海领成生物科技有限公司产品。
1.2 方法
1.2.1 组织工程骨的体外构建 待测样品为具有生物活性的组织工程骨,具体制备方法参见文献[4-5]。简言之,体外分离培养正常人骨髓基质干细胞(bone marrow mesenchymal stem cells, BMSCs)至第 2 代(passage 2,P2)作为种子细胞。选择孔隙率为 80% ~ 85% 的猪松质骨来源完全脱钙骨材料(demineralized bone matrix,DBM,由上海组织工程研究与开发中心研制)为支架材料。将已高温高压消毒的 DBM 材料(规格大小为 4 mm ×4 mm × 4 mm)置于无菌培养皿内,取 P2 代人 BMSCs 以 1 × 106/ml 的密度接种 DBM 支架材料。每块材料接种 10 μl 细胞悬液,细胞数量为 1 × 104个。将细胞材料复合物置于细胞培养箱 4 h 后,转移至 96 孔培养板,每孔加入 200 μl 成骨条件培养液(含低糖 DMEM、10% FBS、10-8mol/L 地塞米松、10 mmol/L β-磷酸甘油钠和 10-4mol/L 维生素 C)在 37 ℃,5% CO2条件下继续培养。体外成骨诱导培养 2 周后,于检测前 1 天更换为无血清的条件培养液,制备成待检测的组织工程骨样品。对照组为未接种细胞的 DBM 材料,同样置于 200 μl 成骨条件培养液中 2 周,检测前 1 天更换为无血清的条件培养液。
1.2.2 酶联免疫分析法测定原理 应用酶联免疫分析法测定标本中 BSA 含量。首先用纯化的抗体包被微孔板,制成固相抗体。包被单抗的微孔中加入 BSA 抗原,经过结合、洗涤后加入酶标抗 BSA 抗体,洗涤后用显色剂显色。颜色的深浅和样品中的 BSA 含量呈正相关。用酶标仪在 450 nm 波长下测定吸光度(值),计算样品浓度。
1.2.3 样品准备 取出组织工程骨样品,以体积比 1:100 的 37 ℃温热生理盐水浸泡并洗涤3 次,每次 10 min,然后将样品置于滤纸上吸附残余液体,用眼科剪剪碎,称重,置于 1.5 ml 的 Eppendorf 管中。根据《医疗器械生物学评价标准》中关于试验材料浸提液的规定标准[6],每 0.2 g 样品加入 1 ml 磷酸盐缓冲液(PBS)平放固定于摇床内,37 ℃、150 r/min 振荡浸提 24 h。对照组样品同法处理获取浸提液。每例样品吸取 0.3 ml 浸提液待测。另将组织工程骨样品 3 次浸泡冲洗后的生理盐水也分别取样检测其中的 BSA 含量。
1.2.4 操作步骤 96 孔酶标板(试剂盒自备)分别设空白孔、标准孔、待测样品孔(复孔数均为 3)。除空白孔加入 100 μl PBS 外,余孔分别加标准溶液或待测样品 100 μl。轻轻混匀,加盖,37 ℃温育 30 min。将酶标板取出弃去液体,甩干,每个孔中加满洗涤液,反应 30 s 后甩去液体,在滤纸上将酶标板拍干,重复此步骤 5 次。在标准品孔和样品孔中加入 100 μl 的酶标偶合溶液,37 ℃温育 30 min。洗板 5 次,甩干。依序每孔加底物溶液100 μl,37 ℃避光显色 15 min。依序每孔加终止溶液 50 μl,终止反应。酶标仪 450 nm 波长测量各孔的光密度(值)。
1.2.5 结果计算 以标准物的浓度为横坐标(对数坐标),值为纵坐标(普通坐标),用 Microsoft Excel 统计软件算出标准曲线的直线回归方程式。将样品值代入方程式,算出样品实际浓度。
在设计行星机构之初,一般要确定一个行星架固定时太阳轮到齿圈的理论速比,最终由于上述3个配齿条件限制,使得由行星机构齿数比表示的实际速比与理论速比产生一定的偏差,即
1.3 统计学处理

2 结果
2.1 组织工程骨的体外构建
组织工程骨的支架材料为 DBM,规格大小为 4 mm × 4 mm × 4 mm(图 1A)。显微 CT 和扫描电镜观察可见 DBM 的三维多孔超微结构(图 1B、C)。种子细胞为正常人 P2 代 BMSCs(图 1D),接种 DBM 后,细胞材料复合物在体外继续成骨诱导培养 2周。倒置相差显微镜观察见 BMSCs 在 DBM 孔隙间生长旺盛,形成细胞膜片(图 1E)。扫描电镜检测显示细胞分泌较多细胞外基质,覆盖在材料表面(图 1F)。
2.2 酶联免疫法检测 BSA 的标准曲线
BSA 检测试剂盒检测范围为 0 ~ 40 ng/ml,根据其标准品测定的标准曲线2= 0.9947,符合试剂盒规定的2> 0.95 的标准检测要求(图 2)。
2.3 洗涤液 BSA 含量测定
组织工程骨样品以体积比 1:100 的生理盐水浸泡并洗涤 3 次,通过测定洗涤液中 BSA 含量,可发现随洗涤次数增多,BSA 含量明显降低。3 次洗涤的洗涤液 BSA 浓度分别为(86.35 ± 0.66)、(23.44 ± 0.27)和(1.88 ± 0.10)ng/ml,3 次之间的结果都有显著性差异(n = 10,< 0.001,图 3)。
2.4 组织工程骨 BSA 残余量测定
实验所用 DBM 材料的体积大小均为 64 mm3,其中实验组平均干重为(61.63 ± 12.36)mg,对照组为(64.50 ± 14.50)mg,两组重量比较无显著性差异(> 0.05,n = 10)。实验组平均每块组织工程骨的 BSA 残余量为(15.57 ± 5.82)ng,单位重量的 BSA 残余量为(0.254 ± 0.088)ng/mg。对照组的相应值分别为(14.85 ± 5.06)ng 和(0.306 ± 0.079)ng/mg,两组间比较均无显著性差异(> 0.05,n = 10)。

图 1 A:实验所用 DBM 材料的大体照片,规格为 4 mm × 4 mm × 4 mm;B:显微 CT 显示 DBM的多孔微观结构;C:未接种 BMSCs 之前的 DBM 扫描电镜图片;D:种子细胞为人 P2 代 BMSCs;E:接种 BMSCs 并成骨诱导培养 2 周之后的光镜观察,细胞在材料孔隙间生长旺盛,形成细胞膜片(箭头所示);F:扫描电镜观察,BMSCs 分泌较多的细胞外基质并覆盖在 DBM 表面
Figure 1 A: Gross observation of DBM scaffolds used in this experiment with size of 4 mm × 4 mm × 4 mm; B: The porous microstructure of DBM shown by micro-CT; C: Scanning electron microscopy (SEM) image of DBM without BMSCs; D: Human BMSCs of passage 2; E: After 2 weeks of osteogenic induction, cell-sheet could be found between the pores of DBM; F: BMSCs excreted large amounts of extracellular matrix and covered on the surface of DBM observed by SEM
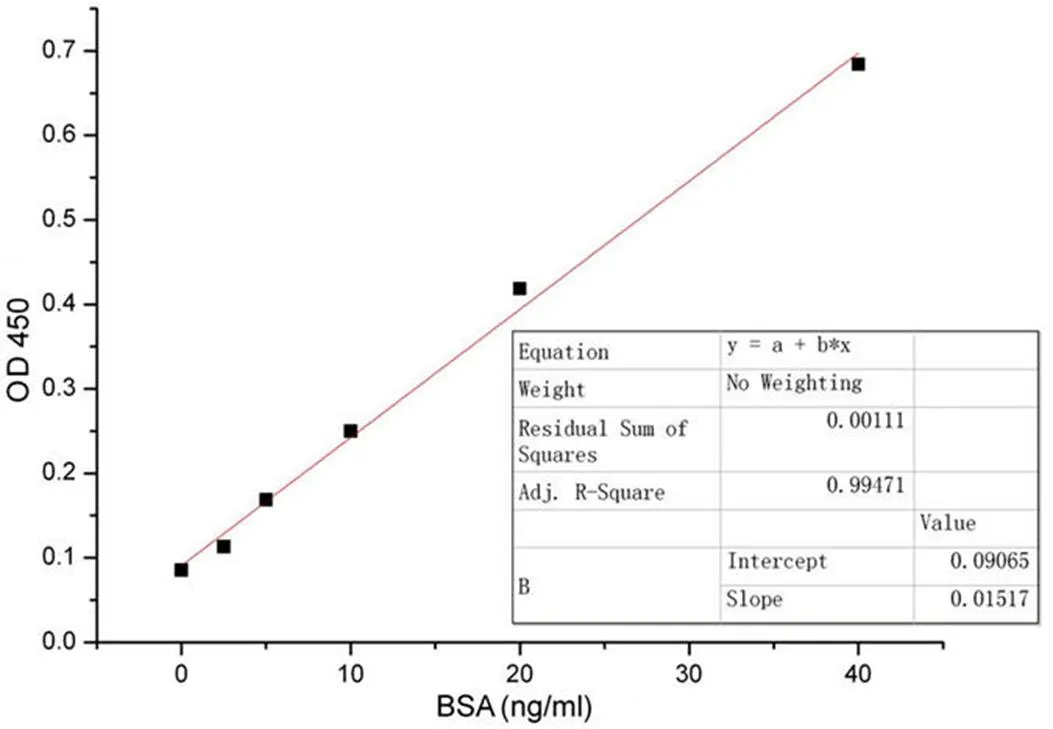
图 2 酶联免疫法测试BSA 残余量的标准曲线,R2 = 0.9947
Figure 2 The standard curve of residual BSA detected by ELISA,2= 0.9947
3 讨论
BSA 是牛血清中含量最高的蛋白质成分(35 ~ 50 g/L),也是最重要的载体蛋白,可以结合并转运生长因子、激素、脂肪酸、胆固醇、维生素、金属离子等,以利于细胞的解毒和摄取营养,从而促进细胞生长[7]。但 BSA 对于人体是一种异种变应原,有导致人体免疫反应的可能性。同时 BSA 可能携带一定种类的病毒微生物,具有传播牛脑部海绵状病变(bovine spongiform encephalopathy,疯牛病)的潜在危险[8]。因此 BSA 残余量的多少关系到生物制品的安全性是否合格,进而影响到人体健康。

图 3 组织工程骨样品洗涤液中 BSA 含量的变化情况
Figure 3 Variation of BSA content of sample in the dilution liquid
目前国际上对组织工程医疗产品中 BSA 残余量的要求尚无定论。依据世界卫生组织及《中国药典》规定,疫苗中 BSA 限量是 50 ng/件,因此国内组织工程领域基本是参照此项标准要求开展相关研究的。但是疫苗单支剂量相对固定,差异性小,便于建立相对统一的 BSA 残余量标准。而在组织工程骨的临床应用中,根据疾病所致骨缺损大小不同,所需植入的组织工程骨材料规格差异很大,相应的 BSA 残余量差异也大。本实验显示,规格大小为 64 mm3的组织工程骨样品,经清洗后的 BSA 残余量平均值为 15.57 ng。若修复骨缺损的材料体积为 2 cm3,其规格大小对于临床应用来说并不是很大,但相应的 BSA 残余量将达到 486.56 ng,远远超出药典的规定剂量。因此,研究如何降低组织工程化医疗产品中的残余 BSA 含量就显得非常重要[9]。目前的主要途径有:①在组织工程化产品制备过程中减少牛血清的应用,寻找牛血清的替代品;②在组织工程化组织植入体内之前,进行规范化清洗。
牛血清替代物主要有人血小板裂解液(human platelet lysates,HPL)、自体血清(autologous serum,AS)等。许茹等[10]对机采血小板进行反复冻融来获得人 HPL,通过血小板裂解能够释放多种细胞因子,可以在 BMSCs 的体外扩增过程中代替 FBS,获得临床所需数量的 BMSCs,且并没有引起 BMSCs 细胞形态、免疫表型、细胞周期等生物学特性的改变。而 Bottenstein 和 Sato[11]在 1979 年首次发表了用无血清培养基进行大鼠垂体细胞(GH3)培养的报道,此后各国学者先后在 30 余种细胞系的体外培养中获得了成功。无血清培养技术将是组织工程技术的发展方向,但是目前无血清培养的促增殖效率尚不令人满意,而自体血清较为稀缺,难以获得。
在种子细胞增殖阶段,所用的动物血清很容易通过离心洗涤的方法去除。当细胞与支架材料复合后,培养基中的血清成分会被支架大量吸附,此时难以再将血清从支架中分离出来。本实验证实,接种 BMSCs 的组织工程骨与未接种细胞的 DBM 材料相比,两者单位重量的 BSA 残余量无显著性差异,表明支架材料较细胞更容易吸附残留 BSA。有研究设想把细胞接种支架材料作为血清替代品和动物血清应用的分界线,在种子细胞增殖阶段使用动物血清,细胞与支架材料复合后换用 AS。罗飞等[12]报道,自体血清对 BMSCs 具有良好的促增殖作用,而且自体血清对经过动物血清培养的 BMSCs 进行再序贯培养的促增殖效率影响轻微,因此组织工程骨种子细胞接种支架后换用自体血清具有一定的可行性。
为了清除残余 BSA,组织工程医疗产品在植入前必须经过规范化的清洗。清洗所用的试剂以及流程对 BSA 残余量都有显著影响。本实验证实,随洗涤次数增多,样品洗涤液中的 BSA 含量明显降低。因此现有技术生产的组织工程医疗产品在真正进入临床使用之前,有必要依据不同的临床预期用途,选择合适的清洗试剂,制定相应的操作流程。组织工程骨一般为多孔支架结构,其结构决定了需要充分的时间及一定次数的漂洗才能有效清除残留在其中的 BSA。但清洗时间过长或次数过于频繁会影响活细胞的生物学活性。因此,为了在生物安全性与产品有效性之间取得平衡,制定清洗程序时不但要检测 BSA 的残余量是否符合人体安全标准,同时需确保产品的生物学活性(如细胞活性与功能)能够达到要求。理想的清洗流程应在有效清除残余 BSA 的同时,最大限度地保持组织工程产品的生物活性,以便植入体内后发挥最大的效应,而这方面的研究目前尚未引起足够重视[13]。
[1] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China. 2010. Beijing: China Medical Science Press, 2010. (in Chinese)
国家药典委员会. 中华人民共和国药典. 2010年版. 北京: 中国医药科技出版社, 2010.
[2] Szpalski C, Wetterau M, Barr J, et al. Bone tissue engineering: current strategies and techniques--part I: Scaffolds. Tissue Eng Part B Rev, 2012, 18(4):246-257.
[3] Panseri S, Russo A, Cunha C, et al. Osteochondral tissue engineering approaches for articular cartilage and subchondral bone regeneration. Knee Surg Sports Traumatol Arthrosc, 2012, 20(6):1182-1191.
[4] Liu GP, Shu CF, Yin S, et al. The effects of cryopreservation on growth and osteogenesis of human bone marrow stromal cells cultured on demineralized bone matrix. Chin J Orthop Trauma, 2006, 8(9): 933-937. (in Chinese)
刘广鹏, 舒朝锋, 尹烁, 等. 低温保存对人骨髓基质干细胞在脱钙骨上体外增殖及成骨能力的影响. 中华创伤骨科杂志, 2006, 8(9): 933-937.
[5] Liu GP, Sun J, Li YL, et al. The effect of cryopreservation on the growthand osteogenesis capability of GFP-labeled canine adipose-derived stem cells on demineralized bone matrix. Chin Med Biotechnol, 2011, 6(1):7-11. (in Chinese)
刘广鹏, 孙剑, 李宇琳, 等. 低温保存的GFP标记脂肪源性干细胞体外构建组织工程骨的研究. 中国医药生物技术, 2011, 6(1):7-11.
[6] State Bureau of Quality and Technical Supervision. GB/T 16886.12-2000 Biological evaluation of medical devices - Part 12: Sample preparation and reference materials. Beijing: China Standards Publishing House, 2000. (in Chinese)
国家质量技术监督局. GB/T 16886.12-2000 医疗器械生物学评价—第12部分: 样品的制备与参照样品. 北京: 中国标准出版社, 2000.
[7] Xue QS. Principles and techniques of culture in vitro. Beijing: Science Press, 2001:54-55. (in Chinese)
薛庆善. 体外培养的原理与技术. 北京: 科学出版社, 2001:54-55.
[8] Shahdadfar A, Frønsdal K, Haug T, et al. In vitro expansion of human mesenchymal stem cells: choice of serum is a determinant of cell proliferation, differentiation, gene expression, and transcriptome stability. Stem Cells, 2005, 23(9):1357-1366.
[9] Fang Y, Feng XM, Xi TF, et al. Quantitative measure of residual BSA in TEMPs-ELISA method. J Tissue Eng Reconstr Surg, 2008, 4(1): 12-14. (in Chinese)
方玉, 冯晓明, 奚廷斐, 等. ELISA法检测组织工程产品中残留牛血清蛋白含量. 组织工程与重建外科杂志, 2008, 4(1):12-14.
[10] Xu R, Xia WJ, Rong X, et al. Human platelet lysates promotes the
proliferation of mesenchymal stem cells in vitro. J South Med Univ, 2011, 31(8):1396-1400. (in Chinese)
许茹, 夏文杰, 戎霞, 等. 人血小板裂解液替代胎牛血清促进骨髓间质干细胞的增殖. 南方医科大学学报, 2011, 31(8):1396-1400.
[11] Bottenstein JE, Sato GH. Growth of a rat neuroblastoma cell line in serum-free supplemented medium. Proc Natl Acad Sci U S A, 1979, 76(1):514-517.
[12] Luo F, Xu JZ, Wang XQ, et al. Effect of autologous serum on the proliferation of hMSCs adapted with calf serum. Acta Academiae Medicinae Militaris Tertiae, 2005, 27(16):1634-1636. (in Chinese)
罗飞, 许建中, 王序全, 等. 自体血清对牛血清适应性人间充质干细胞增殖的影响. 第三军医大学学报, 2005, 27(16):1634-1636.
[13] Fang Y, Feng XM, Xi TF. Approaches about quantitative measure of residual bovine serum albumin in tissue engineered medical products. J Clinical Rehabilitative Tissue Eng Res, 2008, 12(32):6347-6350. (in Chinese)
方玉, 冯晓明, 奚廷斐. 组织工程医疗产品中残留牛血清白蛋白的检验常见问题. 中国组织工程研究与临床康复, 2008, 12(32):6347- 6350.
Quantitative detection of residual BSA in tissue engineered bone by enzyme-linked immunosorbent assay
ZOU Wen-tao, LIU Guang-peng,SUN Jian, CUI Lei
Department of Otolaryngology (ZOU Wen-tao), Department of Plastic and Reconstructive Surgery (LIU Guang-peng), Shanghai Tenth People’s Hospital, Tongji University, Shanghai 200072, China; Shanghai Tissue Engineering Research and Development Center, Shanghai 200235, China (SUN Jian, CUI Lei)
To detect the residual bovine serum albumin (BSA) in tissue engineered bone constructed conventionallyby enzyme-linked immunosorbent assay (ELISA) and investigate methods to reduce it.
Human bone marrow mesenchymal stem cells (BMSCs) were isolated and cultured, and BMSCs of passage 2 were inoculated in demineralized bone matrix scaffolds and induced osteogenesisfor two weeks to construct tissue engineered bone. Osteogenesis inducing medium was conditioned medium containing 10% fetal bovine serum, and was replaced with serum-free conditioned medium 1 day before detection. Then the tissue engineered bone was rinsed in 1:100 (v:v) saline for three times, put in PBS buffer and extracted for 24 hours at 37 ℃ to obtain the extracted liquor. The extracted liquor of scaffold alone without cells inoculated simultaneously served as the control. Residual BSA content in the extracted liquor were detected by ELISA and compared between the two groups.
BSA content in the dilution liquid decreased after washing three times. The average residual BSA in tissue engineered bone and in scaffold material detected by ELISA was (15.57 ± 5.82) ng and (14.85 ± 5.06) ng, respectively, which was normalized as (0.254 ± 0.088) ng/mg and (0.306 ± 0.079) ng/mg, respectively, showing no significant difference between two groups (> 0.05, n = 10).
ELISA method is suitable for the detection of the residual BSA in tissue engineered bone. As the scaffold materials absorb BSA more easily than the cells, the residual BSA in tissue engineered bone is still relatively high. Therefore, new methods of reducing BSA residual need to be explored.
Serum albumin, bovine; Enzyme-linked immenosorbent assay; Tissue engineered bone; Residual
LIU Guang-peng, Email: guangpengliu@163.com
国家自然科学基金(81171475、31271027)
刘广鹏,Email: guangpengliu@163.com
2012-12-12
10.3969/cmba.j.issn.1673-713X.2013.02.002
