酶联免疫斑点法对抗结核治疗期肺结核患者多肽特异性IFN-γ的检测
2013-07-13林淑娴杨芳芳彭毅李研方毅敏黎意芬赖小敏
林淑娴,杨芳芳,彭毅,李研,方毅敏,黎意芬,赖小敏
酶联免疫斑点法对抗结核治疗期肺结核患者多肽特异性IFN-γ的检测
林淑娴,杨芳芳,彭毅,李研,方毅敏,黎意芬,赖小敏
510080 广州,中山大学中山医学院微生物教研室,热带病防治研究教育部重点实验室,海洋微生物功能分子广东省高校重点实验室,广东省重大传染病预防和控制技术中心(林淑娴、杨芳芳、彭毅、李研、赖小敏);510095 广州市胸科医院内科(方毅敏、黎意芬)
运用酶联免疫斑点法检测结核患者外周血 IFN-γ,探讨结核患者结核多肽特异性 IFN-γ 分泌水平随抗结核治疗的变化。
采用结核混合多肽 E6 + E7 + C14、E6 + E7 作为刺激抗原,对 331 个处于治疗前或 1、2、3、4、5 和 6 个月治疗期的肺结核患者外周血标本进行多肽特异性 IFN-γ 酶联免疫斑点法(ELISPOT)检测。
治疗前的肺结核患者其 ELISPOT 阳性检测率均高于痰涂片和痰培养阳性率(E6 + E7 + C14-ELISPOT 92.5%、E6 + E7-ELISPOT 89.7%、痰涂片 41.0%、痰培养 59.0%),且差别均有统计学意义(< 0.010 和< 0.001)。在抗结核治疗各个时期,肺结核患者 IFN-γ-ELISPOT 检测阳性率和斑点数(spot forming cells/106cells, SFP)随着治疗的进行持续下降,由治疗前高水平(E6 + E7 + C14-ELISPOT 阳性率 92.5%、SFP 计数中值 M = 381;E6 + E7-ELISPOT 阳性率 89.7%、SFP 计数中值 M = 168)降至第 6 个月治疗结束时低水平(E6 + E7 + C14-ELISPOT 43.6%、M = 40;E6 + E7-ELISPOT 38.1%、M = 36)。痰涂阳性患者的 SFP 计数持续处在高位,且治疗 6 个月痰涂阳性患者的 SFP 计数显著高于痰涂阴性患者。
两种混合多肽 IFN-γ-ELISPOT 可提高结核患者的诊断率,同时检测抗结核治疗患者的 IFN-γ 分泌水平以监测抗结核治疗的效果。
结核,肺; 免疫酶技术; 细胞; 抗结核治疗
结核病是严重危害人类健康的呼吸道传染病,全球大约有三分之一的人口感染过结核分枝杆菌(,MTB)[1]。根据世界卫生组织的最新数据,结核病是引起人类死亡的第二杀手[2]。我国既是结核病高负担国家,也是耐多药结核病流行严重国家。监测抗结核治疗患者的治疗效果,根据效果及时调整治疗方案,有利于防止耐药菌株的出现。酶联免疫斑点试验是一种基于抗原特异性细胞免疫反应的新型免疫检测技术,已被证明在结核诊断、检测潜伏感染、监测治疗效果等方面有潜在的应用价值[3-5]。目前,在国外,基于 ELISPOT 原理、商业化的 T-SPOT.TB已被多个国家批准使用[6-7],但由于价格昂贵而限制了在我国的广泛使用。本研究采用 E6 + E7 + C14、E6 + E7 混合多肽为刺激物,检测抗结核治疗期结核患者外周血的 IFN-γ 分泌水平,探讨结核患者的治疗效果与结核多肽刺激下 IFN-γ 分泌水平之间的关系。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器 96 孔 ELISPOT 板购自美国 Millipore 公司;包被抗体(anti-human IFN-γ)、生物素标记抗人 IFN-γ 抗体购自美国 eBioscience 公司;碱性磷酸酶标记的链霉亲和素,底物 NBT、BCIP 均购自美国 Thermo 公司;RPMI 1640 培养基购于美国 Gibco 公司;新生小牛血清购于澳大利亚 HyClone 公司;淋巴细胞分离液购于荷兰 Amersham Bioscience 公司;ELISPOT 读板系统购于美国 Cellular Technology 公司。E7(中国授权发明专利号:200810220523.1)、E6(中国发明专利公开号:201110130364.8)、C14 多肽委托西安华辰生物科技有限公司合成,纯度为 98%,其中 E6、E7 来源于 MTB 分泌性蛋白 ESAT-6,C14 则来源于另外一种分泌性蛋白 CFP-10。
1.1.2 标本来源 共纳入结核患者 331 例,男性 225 人,女性 106 人,年龄中位数(M)为 41(四分位间距:27 - 52)。全部患者均依据临床表现、细菌学、影像学或抗结核药物疗效明确诊断为肺结核。肺外结核及其他肺炎、肺癌患者不纳入研究,年龄小于 15 岁的肺结核患者排除在外。331 例纳入研究的患者均于 2010 年 9 月到 2011 年 10 月期间在广州市胸科医院接受抗结核治疗。331 例患者按治疗时间进行分组,其中治疗前有 39 人,治疗时间 1、2、3、4、5 和 6 个月分别有 39、55、40、40、63 和 55 人。广州人口迁移性大,加之追踪时间较长,纳入研究患者并未能在所有研究时间点抽血进行IFN-γ ELISPOT 检测,但是所有患者追踪监测时间都包含在治疗前、治疗 1、2、3、4、5 和 6 个月这 7 个治疗时间点。由于经济上的原因,331 例纳入研究患者中,只有治疗前抽血的患者有相应的痰培养检测;在治疗前、治疗 2 个月和 6 个月抽血的患者有相应的痰涂片检测。
1.2 方法
1.2.1 外周血标本 所有研究对象均采用乙二胺四乙酸(EDTA-K2)抗凝静脉血,采样后在 6 h 之内采用梯度密度离心法分离新鲜的外周血单个核细胞(PBMC)用于 ELISPOT 检测。
1.2.2 结核多肽特异性 IFN-γ-ELISPOT 检测方法 分离得到的 PBMC细胞用含 10% 新生小牛血清和 100 U 抗生素的 RPMI 1640 重悬,调整细胞浓度,使加入已包被抗人 IFN-γ 的 ELISPOT 板中的细胞为每孔2.5 × 105个。阳性对照孔加入豆蔻酸-佛波醇-乙酸酯(PMA,25 ng/ml)和离子霉素(ionomycin,1 μg/ml);阴性对照孔不添加任何刺激物;实验孔加入特异性多肽抗原,浓度为20 μg/ml。将细胞置 37 ℃,5% CO2培养箱培养18 h 后,用含 0.25% 吐温 20 的磷酸缓冲液(PBST)洗板 10 次;接着加生物素标记抗人 IFN-γ(0.5 μg/ml)室温孵育2 h;PBST 洗板 5 次,用碱性磷酸酶标记链霉亲和素(2 μg/ml)室温孵育 2 ~ 2.5 h,最后,加入底物NBT/BCIP 显色。晾干后,采用 ELISPOT 读板分析仪自动扫描仪计数,Quality Control 系统对自动扫描系统得到的斑点数(spot forming cells,SFP)进行质量控制,所得斑点数乘以系数 4,即为每百万(106)所检测 PBMC 中斑点数(SFP/106PBMC),实验组的每百万 PBMC 中斑点数减去阴性对照的 SFP,为统计记录数据(即抗原多肽特异性IFN-γ 应答水平);最后 SFP ≥ 50 判断为阳性。
1.3 统计学处理
所有数据采用 SPSS 16.0 统计,GraphPad Prism 5 进行作图。对于 ELISPOT 和细菌学诊断的比较采用 McNemar2检验;对于不用治疗时期的阳性率比较采用 Pearson Chi-Square 检验;对于不同治疗时期的斑点数比较,采用 Kruskal Wallis 秩和检验。< 0.05 表示差别具有统计学意义。
2 结果
2.1 治疗前患者 IFN-γ ELISPOT 与细菌学检测结果的比较
表 1 显示,在治疗前患者组,两种混合多肽(E6 + E7 + C14 和 E6 + E7)的 IFN-γ ELISPOT 阳性检测率分别为 92.5% 和 89.7%,均高于痰涂片和痰培养阳性率(41.0% 和 59.0%),且差异均具有统计学意义(< 0.01 和< 0.001)。
2.2 IFN-γ ELISPOT 在治疗过程中的检测阳性率变化
图 1 显示两种混合多肽在各个治疗点的阳性率分布。E6 + E7 + C14-IFN-γ ELISPOT在 7 个治疗时间点(治疗前、治疗 1、2、3、4、5 和 6 个月)阳性率分别为 92.5%、79.0%、70.1%、61.0%、52.5%、41.3% 和 43.6%(图 1A)。统计学分析显示,治疗前与治疗 1 个月阳性率差异无统计学意义(= 0.112),而与治疗 2、3、4、5、6 个月间差异则有统计学意义(< 0.006 ~< 0.001);治疗2 个月与 5、6 个月之间差异也有统计学意义(< 0.007 和< 0.001),但与 3、4 个月之间无统计学意义(均 > 0.05);此外,治疗 5 个月与 6 个月之间差异无统计学意义(> 0.05)。
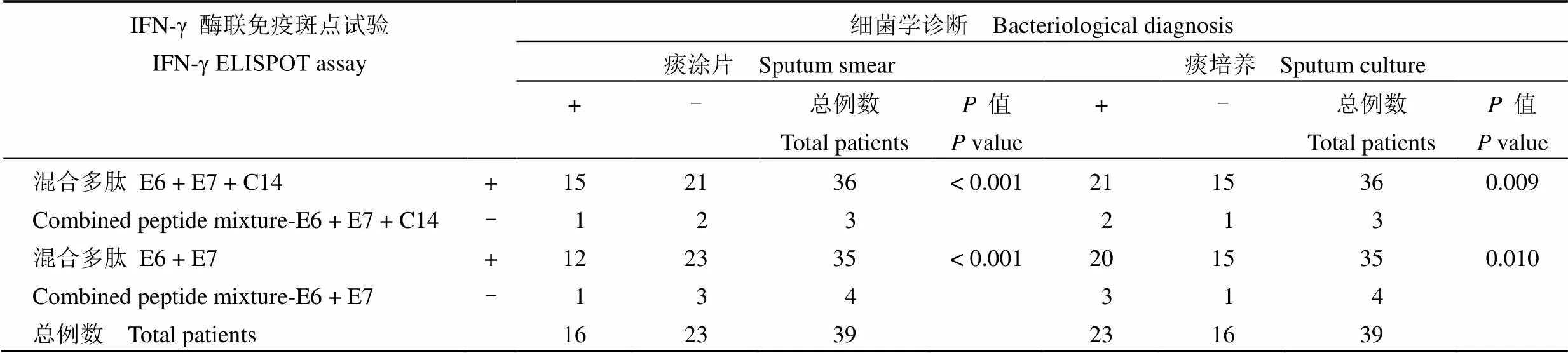
表 1 治疗前患者 IFN-γ ELISPOT 与细菌学检测结果的比较

A:E6 + E7 + C14-IFN-γ ELISPOT 的阳性率直方图;B:E6 + E7-IFN-γ ELISPOT 的阳性率直方图
Figure 1 The positive percentages of IFN-γ ELISPOT assays with E6 + E7 + C14 or E6 + E7 during treatment time points

A:E6 + E7 + C14-IFN-γ ELISPOT 每百万PBMC 中斑点数(中线代表中位数值,SFP/106 PBMC);B:E6 + E7-IFN-γ ELISPOT 每百万PBMC 中斑点数(中线代表中位数值,SFP/106 PBMC);**:治疗前与治疗 1 个月的 SFP 计数的比较;#:治疗 2 个月与治疗 5 个月的 SFP 计数的比较;*:治疗 2 个月与治疗 6 个月的 SFP 计数的比较
Figure 2 The quantitative SFP of IFN-γ ELISPOT assays at different time points
E6 + E7-IFN-γ ELISPOT 在 7 个治疗时间点的阳性率分别为 89.7%、76.9%、65.4%、57.4%、42.5%、46.0% 和 38.1%(图 1B)。7 个治疗时间点的阳性率之间的差异的统计学意义表现与 E6 + E7 + C14-IFN-γ ELISPOT 结果相似,其中治疗前与治疗 1 个月间差异无统计学意义(= 0.192),与治疗 2、3、4、5、6 个月间差异有统计学意义(< 0.01 ~< 0.001);治疗 2 个月与 5、6 个月之间差异也有统计学意义(均 < 0.05),但与 3、4 个月之间差异无统计学意义(均 > 0.05);此外,治疗 5 个月与 6 个月之间差异无统计学意义(> 0.05)。
2.3 IFN-γ ELISPOT 在各个治疗期 SFP 计数
两种混合多肽 IFN-γ ELISPOT 的 SFP 计数从治疗前的高水平随着抗结核治疗延续而持续降低,至治疗 5 ~ 6 个月达低水平(图 2)。
E6 + E7 + C14-IFN-γ ELISPOT 的 SFP 计数(图 2A)在 7 个时间点的中位数值分别为 381、339、131、95、58、42 和 40。其中治疗前与治疗1 个月间差异无统计学意义(= 0.463),而与 2、3、4、5、6 个月间差异有统计学意义(< 0.001 ~< 0.008);此外,治疗 2 个月与 3、4 个月之间差异无统计学意义(均 > 0.05),而与 5、6 个月间差异则有统计学意义(均 < 0.05);治疗 5 与 6 个月之间差异无统计学意义(> 0.05)。
E6 + E7-IFN-γ ELISPOT 的 SFP 计数(图 2B)在 7 个时间点的中位数值分别为 168、160、110、116、41、31 和 36。其中治疗前与治疗 1、2、3 个月间差异无统计学意义(均 > 0.05),而与治疗 4、5、6 个月间差异有统计学意义(均 < 0.01);此外,治疗 2 个月与3、4、5 个月间差异无统计学意义(均 > 0.05),而与 6 个月间差异有统计学意义(= 0.009)。
2.4 治疗前、治疗 2 个月及 6 个月痰涂片阳性与阴性患者 IFN-γ ELISPOT 的 SFP 计数比较

A1、A2、A3:痰涂阳性和痰涂阴性患者的E6 + E7 + C14-IFN-γ ELISPOT 试验在治疗 0、2、6 个月斑点计数散点图;B1、B2、B3:痰涂阳性和痰涂阴性患者的E6 + E7-IFN-γ ELISPOT 试验在治疗 0、2、6 个月斑点计数散点图
Figure 3 Comparison of smear positive and smear negative SFP values with IFN-γ ELISPOT assay at months 0, 2 and 6
进一步分析治疗前、治疗 2、6 个月 3 个时间点的 IFN-γ ELISPOT 的 SFP 计数发现,痰涂片阳性患者高于阴性患者(图 3)。在治疗前、治疗2 个月,痰涂片阳性患者 SFP 计数(治疗前:E6 + E7 + C14,M = 444;E6 + E7,M = 200。治疗 2 个月:E6 + E7 + C14,M = 225;E6 + E7,M = 163)比痰涂片阴性患者(治疗前:E6 + E7 + C14,M = 300;E6 + E7,M = 162;治疗 2 个月:E6 + E7 + C14,M = 128;E6 + E7,M = 108)高,但两者间差异没有统计学意义(均 > 0.05;图 3 A1,A2,B1,B2);而治疗 6 个月,痰涂片阳性患者(E6 + E7 + C14,M = 225;E6 + E7,M = 342)显著高于痰涂片阴性患者(E6 + E7 + C14,M = 31;E6 + E7,M = 26),且差异有统计学意义(< 0.001;图3 A3,B3)。
3 讨论
目前结核病主要以临床症状、胸部 X 光片及细菌学检测作为诊断的主要依据[8-9],这些传统的诊断方法存在诊断率低、误诊率高、耗时长等缺点[10-11]。近年来,发展起来的 T-SPOT.TB 试剂盒以及类似的 ELISPOT 检测,在结核病的诊断运用中不仅快捷、方便,而且其敏感性和特异性达到 83% ~ 97%[12-15]。本实验室在前期的工作中,筛选出了 E6、E7 和 C14 三种 MTB 特异性多肽,并以此为基础建立的 ELISPOT 技术与 T-SPOT.TB 的敏感性和特异性相似[16]。本研究中,E6 + E7 + C14-ELISPOT(92.5%)和 E6 + E7-ELISPOT(89.7%)对治疗前结核患者的 IFN-γ ELISPOT 阳性检测率均高于痰涂片(41.0%)和痰培养(59.0%)的阳性率,与文献报道的 T-SPOT.TB 试剂盒检测敏感性相似[12, 14, 17-18]。
在本研究中,IFN-γ ELISPOT 在治疗过程中的检测阳性率和 SFP 计数随着抗结核治疗的进行持续降低,至 5 ~ 6个月达低水平,其中治疗前和治疗 1 个月差异无统计学意义、而与 2、3、4、5、6 个月间差异有统计学意义;同时治疗 2 个月与治疗 5、6 个月,E6 + E7 + C14-IFN-γ ELISPOT 检测阳性率和 SFP 计数间的差异均有统计学意义,而与 3、4 个月均无统计学意义;此外,治疗前、治疗 2 个月,痰涂阳性患者的 IFN-γ ELISPOT 的 SFP 计数略高于痰涂阴性患者,而到治疗 6 个月前者才显著高于后者。这提示在前期的治疗中,肺结核患者的 IFN-γ 分泌水平处于高位,随治疗病情好转的患者 IFN-γ 分泌水平降低;而痰涂阳性患者的 IFN-γ 分泌水平仍处于高位。
两种混合多肽 IFN-γ ELISPOT 的 SFP 计数在各个时间点间统计学结果不完全相同,其原因可能是由于纳入的病例数不足或刺激多肽的不同所致。Chee 等[19]应用 T-SPOT.TB 追踪监测接受抗结核治疗患者IFN-γ 分泌水平,CFP-10 刺激下 SFP 计数在各个时间点要比 ESAT-6 高。Adetifa等[20]应用 CFP-10 和 ESAT-6 来源 15 个氨基酸长度的多肽作为刺激物,发现 CFP-10 来源多肽刺激下 SFP 计数在各个时间点要比 ESAT-6 高,这表明同一结核蛋白来源但长度或氨基酸序列不同的多肽,刺激效果存在差异。本实验室在前期工作中,筛选出 E6、E7(ESAT-6 来源)、C14(CFP-10 来源)三种 MTB 特异性多肽,组合成 E6 + E7 + C14、E6 + E7 两种混合多肽检测分析了确诊肺结核患者 IFN-γ 反应水平,结果为混合多肽的刺激效果要比单个多肽强[16]。而在本研究中,对治疗期的肺结核患者进行外周血多肽特异性 IFN-γ 检测得到相似结果,E6 + E7 + C14-IFN-γ ELISPOT 在各个时期 SFP 计数和阳性率均高于 E6 + E7-IFN-γ ELISPOT。
由于人口迁移和追踪时间长,纳入研究患者并未能在所有研究时间点进行抽血 IFN-γ ELISPOT 检测,这是本实验最大的不足。为弥补这一缺陷,本研究所有纳入研究患者追踪监测时间都包含在治疗前、治疗 1、2、3、4、5 和 6 个月这 7 个治疗时间点,按不同治疗时间点进行分组,同时增加每个治疗时间点研究病例数,以减少个体差异造成的误差,增加结果的可靠性,这与 Zhang 等[21]及我们在其他研究方法中使用的分组方式类似。
综上所述,本实验室建立起的 ELISPOT 技术,在前期诊断可以提高痰涂阴性患者结核的诊断率,后期治疗可以辅助监测抗结核治疗效果。
[1] Arend SM, Engelhard AC, Groot G, et al. Tuberculin skin testing compared with T-cell responses to Mycobacterium tuberculosis- specific and nonspecific antigens for detection of latent infection in persons with recent tuberculosis contact. Clin Diagn Lab Immun, 2001, 8(6):1089-1096.
[2] World Health Organization. Global tuberculosis control 2012. [2012- 11-20]. http://apps.who.int/iris/bitstream/10665/75938/1/97892415645 02_eng.pdf
[3] Nicol MP, Pienaar D, Wood K, et al. Enzyme-linked immunospot assay responses to early secretory antigenic target 6, culture filtrate protein 10, and purified protein derivative among children with tuberculosis: implications for diagnosis and monitoring of therapy.Clin Infect Dis, 2005, 40(9):1301-1308.
[4] Carrara S, Vincenti D, Petrosillo N, et al. Use of a T cell-based assay for monitoring efficacy of antituberculosis therapy. Clin Infect Dis, 2004, 38(5):754-756.
[5] Aiken AM, Hill PC, Fox A, et al. Reversion of the ELISPOT test after treatment in Gambian tuberculosis cases. BMC Infect Dis, 2006, 6:66.
[6] National Institute for Health and Clinical Excellence. Tuberculosis: clinical diagnosis and management of tuberculosis; and measures for its prevention and control//National Institute for Health and Clinical Excellence 2006 Clinical Guidelines 33. London: National Institute for Health and Clinical Excellence, 2006.
[7] Canadian Tuberculosis Committee (CTC). Updated recommendations on interferon gamma release assays for latent tuberculosis infection. An Advisory Committee Statement (ACS). Can Commun Dis Rep, 2008, 34(ACS-6):1-13.
[8] Diagnostic Standards and Classification of Tuberculosis in Adults and Children. This official statement of the American Thoracic Society and the Centers for Disease Control and Prevention was adopted by the ATS Board of Directors, July 1999. This statement was endorsed by the Council of the Infectious Disease Society of America, September 1999. Am J Respir Crit Care Med, 2000, 161(4 Pt 1):1376-1395.
[9] Drobniewski FA, Caws M, Gibsion A, et al. Modern laboratory diagnosis of tuberculosis. Lancet Infect Dis, 2003, 3(3):141-147.
[10] Davies PD, Pai M. The diagnosis and misdiagnosis of tuberculosis. Int J Tuberc Lung Dis, 2008, 12(11):1226-1234.
[11] Boyd JC, Marr JJ. Decreasing reliability of acid-fast smear techniques for detection of tuberculosis. Ann Intern Med, 1975, 82(4):489-492.
[12] Meier T, Eulenbruch HP, Wrighton-Smith P, et al. Sensitivity of a new commercial enzyme-linked immunospot assay (T SPOT-TB) for diagnosis of tuberculosis in clinical practice. Eur J Clin Microbiol Infect Dis, 2005, 24(8):529-536.
[13] Kang YA, Lee HW, Hwang SS, et al. Usefulness of whole-blood interferon-gamma assay and interferon-gamma enzyme-linked immunospot assay in the diagnosis of active pulmonary tuberculosis. Chest, 2007, 132(3):959-965.
[14] Wang JY, Chou CH, Lee LN, et al. Diagnosis of tuberculosis by an enzyme-linked immunospot assay for interferon-gamma. Emerg Infect Dis, 2007, 13:553-558.
[15] Goletti D, Carrara S, Vincenti D, et al. Accuracy of an immune diagnostic assay based on RD1 selected epitopes for active tuberculosis in a clinical setting: a pilot study. Clin Microbiol Infect, 2006, 12(6):544-550.
[16] Yang FF, Tu ZQ, Fang YM, et al. Monitoring of peptide-specific and gamma interferon-productive T cells with active and convalescent tuberculosis using an enzyme-linked immunosotbent spot assay. Clin Vaccine Immunol, 2012, 19(3):401-410.
[17] Chee CB, Gan SH, Khinmar KW, et al. Comparison of sensitivities of two commercial gamma interferon release assays for pulmonary tuberculosis. J Clin Microbiol 2008, 46(6):1935-1940.
[18] Lee JY, Choi HJ, Park IN, et al. Comparison of two commercial interferon-gamma assays for diagnosing Mycobacterium tuberculosis infection. Eur Respir J, 2006, 28(1):24-30.
[19] Chee CB, KhinMar KW, Gan SH, et al. Tuberculosis treatment effect on T-cell interferon-gamma responses to Mycobacterium tuberculosis- specific antigens. Eur Respir J, 2010, 36(2):355-361.
[20] Adetifa IM, Ota MO, Walther B, et al. Decay kinetics of an interferon gamma release assay with anti-tuberculosis therapy in newly diagnosed tuberculosis cases. PLoS One, 2010, 5(9): pil: e12502.
[21] Zhang S, Shao L, Mo L, et al. Evaluation of gamma interferon release assays using Mycobacterium tuberculosis antigens for diagnosis of latent and active tuberculosis in Mycobacterium bovis BCG- vaccinated populations. Clin Vaccine Immunol, 2010, 17(12):1985- 1990.
Detection of peptide-specific interferon-gamma with enzyme-linked immunospot assay in patients with pulmonary tuberculosis during the anti-tuberculosis treatment
LIN Shu-xian, YANG Fang-fang, PENG Yi, LI Yan, FANG Yi-min, LI Yi-fen, LAI Xiao-min
Department of Microbiology, Zhongshan School of Medicine, Sun Yat-sen University, Ministry of Education Key Laboratory of Tropical Disease Control, Guangdong Provincial Department of Education Key Laboratory of Functional Molecules from Marine Microorganisms, Guangdong Provincial Research Center for Severe Infectious Disease Prevention and Control Technology, Guangzhou 510080, China (LIN Shu-xian, YANG Fang-fang, PENG Yi, LI Yan, LAI Xiao-min); Guangzhou Chest Hospital, Guangzhou 510095, China (FANG Yi-min, LI Yi-fen)
To detect IFN-γ in the peripheral blood of pulmonary tuberculosis (PTB) patients by using IFN-γ enzyme-linked immunospot assay (ELISPOT) and investigate peptide-specific IFN-γ levels during anti-TB treatment.
Peptide-specific IFN-gin peripheral blood (PLB) was detected by ELISPOT with(MTB) peptide mixtures E6 + E7 + C14 and E6 + E7 as stimulants. The PLB samples were taken from 331 PTB patients tracked longitudinally before treatment or 1, 2, 3, 4, 5, 6 months after treatment.
Before treatment, the positive detection rates of two kinds of combined peptide mixture IFN-γ-ELISPOT were significantly higher than that of sputum smear and sputum culture (E6 + E7 + C14-ELISPOT 92.5%, E6 + E7-ELISPOT 89.7%; sputum smear 41.0%, sputum culture 59.0%). The positive detection rates and the spot forming cells per 106cells (SFP) of IFN-γ-ELISPOT consistently decreased overall the treatment from higher level before treatment (by E6 + E7 + C14-ELISPOT, positive rate 92.5%, median SFP (M) = 381; by E6 + E7-ELISPOT, positive rate 89.7%, M = 168) to lower level after six months treatment (by E6 + E7 + C14-ELISPOT 43.6%, M=40; by E6 + E7-ELISPOT 38.1%, M = 36). SFP values of patients with positive sputum smear were continued to remain high, and it was higher than that of patients with negative sputum smear aftet 6 months treatment.
The two combined peptide mixture IFN-γ-ELISPOT assays increase the detection rates of PTB patients andmonitor the efficiency of anti-TB treatment by detecting IFN-γ levels in patients with anti-TB treatment.
Tuberculosis, pulmonary; Immunoenzyme techniques; Cells; Anti-tuberculosis therapy
10.3969/cmba.j.issn.1673-713X.2013.02.003
LAI Xiao-min, Email: laixm@mail.sysu.edu.cn
十二五“传染病重大专项”分任务(2012ZX10004903-004- 002);国家自然科学基金面上项目(81271779)
赖小敏,Email:laixm@mail.sysu.edu.cn
2012-12-04
