粤东地区散发性肾病综合征患儿NPHS2基因多态性分析
2013-07-08王宪耀綦巧雯林浩铨林敏杨立业林明祥
王宪耀 綦巧雯林浩铨林敏杨立业 林明祥★
粤东地区散发性肾病综合征患儿NPHS2基因多态性分析
王宪耀1綦巧雯1林浩铨1林敏2杨立业2林明祥1★
目的研究粤东地区散发性肾病综合征(nephrotic syndrome,NS)患儿NPHS2基因的多态性,为早期预测该地区原发性NS患儿对常规激素治疗的反应性及预后提供帮助。方法聚合酶链反应法扩增基因组DNA,直接测序分析25例散发性肾病综合征患儿NPHS2基因的多态性。结果25例患儿的NPHS2基因中8个外显子均未检测出错义突变,在外显子1,2,8中发现4个已报道的SNP位点(rs1079292;rs3738423;rs1410592;rs3818587)。结论在已检测的25例粤东散发性肾病综合征患儿中NPHS2基因未见有编码区突变,提示NPHS2突变不是该地区散发性肾病综合征患儿发病的主要致病原因。
NPHS2;突变;粤东;散发性;肾病综合征
散发性肾病综合征(nephrotic syndrome,NS)及大量蛋白尿的病因及发病机理至今仍未完全明确。研究表明,免疫及遗传因素可能起着重要的作用。Podocin是2000年才发现的表达于肾小球足细胞裂孔隔膜处的特征性结构分子[1,2],其编码基因NPHS2定位于1q25~31。Podocin表达的缺失可导致常染色体隐性遗传激素抵抗型肾病综合征,临床表现为早期出现蛋白尿并迅速发展为终末期肾病。家族或非家族性激素抵抗型肾病综合征及局灶节段肾小球硬化型患者中,目前已有60多种NPHS2基因突变的报道,包括点突变、缺失、插入、框架漂移及启动子区突变等[3~7]。对激素依赖或频复发性NS患儿是否存在NPHS2基因突变目前仍有争议[7,14,18]。本研究应用直接测序分析了25例粤东散发性NS患儿NPHS2基因的多态性现象,拟了解该地区散发性NS患儿发病与NPHS2基因突变的相关性。
1 资料和方法
1.1 临床资料
以2008年11月~2010年11月在本院住院的25例原发性NS患儿为研究对象,其中4例为频复发型,2例为激素耐药型,其余为激素敏感型。发病年龄(数据不符合正态分布)中位年龄6岁,年龄最小19个月,最大13岁,其中男性20例,女性5例。排除有遗传性疾病家族史、乙型肝炎病毒相关性肾炎、系统性红斑狼疮、胰岛素依赖性糖尿病、原发性高血压等,以及因药物、理化因素引起的肾脏病变导致大量蛋白尿患儿。对照组为正常体检儿童10例,所有入选者均获知情同意权。
1.2 方法
1.2.1 DNA提取
留取入选者外周静脉血2 mL,肝素抗凝。用常规DNA提取试剂盒抽提基因组DNA。用PCR体外扩增NPHS2共8个外显子片段,纯化后直接测序分析其多态性现象。
1.2.2 引物设计与序列
引物设计分别位于各外显子两侧的内含子区域(表1)。
1.2.3 PCR反应
条件按常规操作适当修改:PCR反应体系为50μL,含100 ng基因组DNA模板,5μL 5×PCR缓冲液,4μL 10 mmol/L dNTP,特异性引物各1μL(20μmol/L),Taq DNA多聚酶2.5 U。PCR扩增条件:94℃预变性5 min后进入循环:94℃ 40 s,55℃~58℃(退火温度根据引物Tm值加以调整)40 s(退火时间根据产物长度加以调整),72℃ 40 s,35个循环,72℃延伸10 min。取10μL PCR产物加入含有0.5 mg/L溴化乙锭的2%琼脂糖泳槽,100 V电泳30 min,紫外投射灯下观察。
1.2.4 测序
PCR产物送上海英骏生物技术有限公司直接测序。
2 结果
在入组的25例原发性NS患儿及正常对照中,检测NPHS2基因所有8个外显子,均未发现有错义突变,病例组检测到的同义多态性有位于外显子1的rs1079292:GG[A/G],都为纯合子G;位于外显子2的rs3738423:TC[C/T],杂合3例,其余为纯合子C;位于外显子8中的rs1410592:GC[C/T],杂合14例,纯合子C 5例,纯合子T 6例,以及rs3818587:CT[G/A],其中杂合4例,纯合子A 21例(图1),与正常对照组等位基因频率差异无统计学意义。
3 讨论
NPHS2基因共有8个外显子。自2000年以来,各国学者已经在多个家族性、散发性激素抵抗型肾病综合征(steroid-resistant nephrotic syndrome,SRNS)及局灶节段肾小球硬化型(focal and segmental glomerulosclerosis,FSGS)病例中发现了60种以上的突变。这些突变散发于NPHS2基因的8个外显子之中,并未发现特别的热点突变。患者大多在儿童期发病,也有在成人期发病。余自华等[8]曾报道,在23例散发SRNS儿童中发现1例NPHS2基因1082T>C杂合(外显子2,L351P)突变的患者,病理诊断为FSGS,后死于肾功能衰竭。
目前国内外研究所报道的NPHS2基因的突变主要是单核苷酸置换所引起的错义突变,大片段的缺失、插入等严重的突变很少看到。而且这些错义突变主要是纯合子,或者是复杂的杂合子,即在一个患者的基因中存在两种或以上的错义突变。一般而言,预后也比较差。欧洲及北美的研究发现,在家族性SRNS和非家族性SRNS病例中,携NPHS2基因纯合及复杂杂合子突变的分别占到38%和26%[9,10]。这些患者往往发病比较早,但肾移植之后的复发率比较低。Ruf等[11]报道,在26例携带NPHS2基因复杂杂合突变的(双突变)的NS病例中,22例对激素抵抗,11例出现ESRD(end stage renal disease);而9例单纯杂合突变的NS病例中,4例表现为激素敏感,只有1例发病8年后进展为终末期肾衰。Malina M等[12]报道在1例纯合R138Q突变SRNS幼儿,环孢素A治疗获得部分缓解。对于仅有1个单纯杂合错义突变的病例,其引起NPHS2基因功能缺陷,进而导致蛋白尿和激素抵抗型肾病综合征的发生机制,目前尚有争议。Liu等[13,14]曾报道,应用体外人工诱变技术建立NPHS1基因突变转染HEK293细胞后发现,细胞膜表面nephrin的表达消失了,或有明显的下调,而胞质内质网内有显著的nephrin蛋白表达。说明这些点突变在引起一个氨基酸残基置换之后,可能导致蛋白质空间结构如折叠的异常,进而导致蛋白质不能正常转运至生理位置,滞留于内质网等蛋白质的合成之处,从而引发蛋白质功能的丧失和缺陷。

表1 NPHS2基因8个外显子区域对应引物序列Table 1 The primer sequences of 8 NPHS2 exons
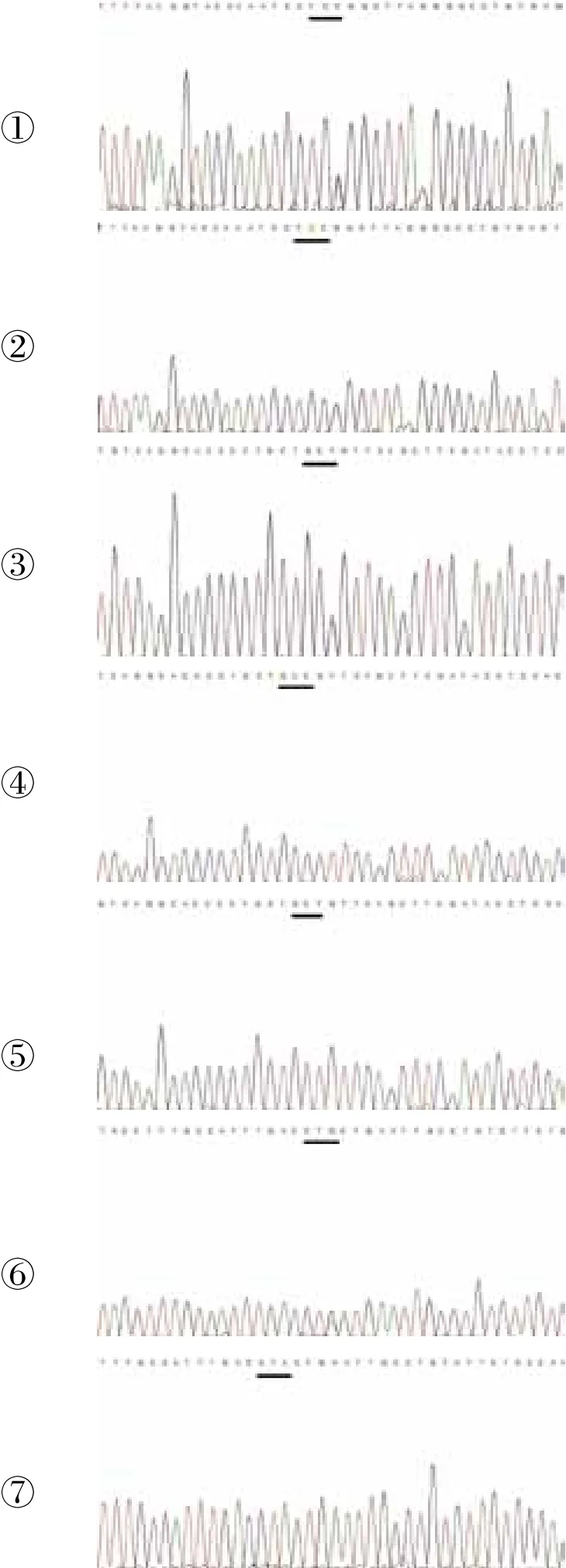
图1 检测到的NPHS2基因SNP多态性Figure 1 Polymorphisms of SNPs detected in NPHS2(①②:位于外显子2的rs3738423: TC[C/T],杂合3例,其余为纯合子C;③④⑤:位于外显子8中的rs1410592:GC[C/T],杂合14例,纯合子C 5例,纯合子T 6例;⑥⑦:位于外显子8中的rs3818587:CT[G/A],杂合4例,纯合子A 21例)
尽管多个研究已证实NPHS2基因纯合或复合杂合突变导致SRNS,但是对NPHS2基因突变是否参与激素依赖型或频复发型肾病综合征(steroiddependent nephrotic syndrome/frequent relapse nephrotic syndrome,SDNS/FRNS)发病仍有不同的认识。Caridi等[7]对59例SDNS/FRNS患儿进行NPHS2基因突变分析,结果4例(6.8%)患儿检测到NPHS2基因杂合突变,认为NPHS2基因杂合突变与原发性NS发生激素依赖或频复发有关。而Gbadegesin等[15]研究未能证实NPSH2基因杂合突变与SDNS/FRNS相关。他们应用DNA直接测序法对20例SDNS/FRNS患儿进行NPHS2基因突变分析,结果未发现患儿存在NPHS2基因突变。
NPHS2基因突变介导的家族性SRNS应该具有地域差异。与欧洲报道的较高发病率不同,Abid A等[16]报道在145例巴基斯坦NS患者中(其中36例为先天或婴儿NS,39例为家族性NS),只有3.4%存在NPHS2突变,其中,家族性NS中未发现有突变。付荣等[17]在对3个南方汉族人家族性SRNS家系中NPHS2基因8个外显子及启动子检测中发现其不是主要致病原因。Chernin G等[18,19]对18例SRNS非裔美籍儿童NPHS2基因检测发现未存在致病性突变,这与其他报道的接近30%~40%突变率不同。Cho H Y等[20]报道在70例SRNS韩国患儿中未检测出NPHS2突变。本研究在25例散发的儿童肾病综合征患者中,未发现引起蛋白表达异常的错义突变,但在外显子1、外显子2、外显子8中存在多态性。在IgA肾病患者,NPHS1基因的多态变化与患者的蛋白尿等表型的严重程度相关,提示这样的多态性可能通过目前我们尚未明确的机制,影响该基因的功能。本研究中存在的多态性因入组数较少,是否具有潜在病理意义还有待进一步研究证实。
在本研究中的粤东地区散发性NS患儿中,其NPHS2基因未存在引起蛋白编码改变的错义突变,提示在该地区散发性NS患儿,特别是激素敏感型NS患儿,NPHS2突变致nephrin表达异常不是其主要发病原因,在发现的数个NPHS2多态性中是否存在病理意义仍须进一步研究。
[1] Boute N, Gribouval O, Roselli S, et al. NPHS2, encoding the glomerular protein podocin, is mutated in autosomal recessive steroid-resistant nephrotic syndrome[J]. Nat Genet, 2000, 24(4): 349-354.
[2] Caridi G, Perfumo F, Ghiggeri G M. NPHS2 (Podocin) mutations in nephrotic syndrome. Clinical spectrum and fi ne mechanisms[J]. Pediatr Res, 2005, 57(5 Pt 2): 54R-61R.
[3] Koziell A, Grech V, Hussain S, et al. Genotype/phenotype correlations of NPHS1 and NPHS2 mutations in nephrotic syndrome advocate a functional inter-relationship in glomerular fi ltration[J]. Hum Mol Genet, 2002, 11(4): 379-388.
[4] Karle S M, Uetz B, Ronner V, et al. Novel mutations in NPHS2 detected in both familial and sporadic steroidresistant nephrotic syndrome[J]. J Am Soc Nephrol, 2002, 13(2): 388-393.
[5] Caridi G, Bertelli R, Carrea A, et al. Prevalence, genetics, and clinical features of patients carrying podocin mutations in steroidresistant nonfamilial focal segmental glomerulosclerosis[J]. J Am Soc Nephrol, 2001, 12(12): 2742-2746.
[6] Winn M P. Not all in the family: mutations of podocin in sporadic steroid-resistant nephrotic syndrome[J]. J Am Soc Nephrol, 2002, 13(2): 577-579.
[7] Caridi G, Bertelli R, Di Duca M, et al. Broadening the spectrum of diseases related to podocin mutations[J]. J Am Soc Nephrol, 2003, 14(5): 1278-1286.
[8] 余自华, 丁洁, 黄建萍, 等. 散发性儿童激素耐药型肾病综合征NPHS2基因突变[J]. 中华肾脏病杂志, 2004, 20(6): 413-417.
[9] Fuchshuber A, Gribouval O, Ronner V, et al. Clinical and genetic evaluation of familial steroid-responsive nephrotic syndrome in childhood[J]. J Am Soc Nephrol, 2001, 12(2): 374-378.
[10] Weber S, Gribouval O, Esquivel E L, et al. NPHS2 mutation analysis shows genetic heterogeneity of steroid-resistant nephrotic syndrome and low post-transplant recurrence[J]. Kidney Int, 2004, 66(2): 571-579.
[11] Ruf R G, Lichtenberger A, Karle S M, et al. Patients with mutations in NPHS2 (podocin) do not respond to standard steroid treatment of nephrotic syndrome[J]. J Am Soc Nephrol, 2004, 15(3): 722-732.
[12] Malina M, Cinek O, Janda J, et al. Partial remission with cyclosporine A in a patient with nephrotic syndrome due to NPHS2 mutation[J]. Pediatr Nephrol, 2009, 24(10): 2051-2053.
[13] Liu X L, Doné S C, Yan K, et al. Defective trafficking of nephrin missense mutants rescued by a chemical chaperone[J]. J Am Soc Nephrol, 2004, 15(7): 1731-1738.
[14] Liu L, Doné S C, Khoshnoodi J, et al. Defective nephrin trafficking caused by missense mutations in the NPHS1 gene: insight into the mechanisms of congenital nephrotic syndrome[J]. Hum Mol Genet, 2001, 10(23): 2637-2644.
[15] Gbadegesin R, Hinkes B, Vlangos C, et al. Mutational analysis of NPHS2 and WT1 in frequently relapsing and steroid-dependent nephrotic syndrome[J]. Pediatr Nephrol, 2007, 22(4): 509-513.
[16] Abid A, Khaliq S, Shahid S, et al. A spectrum of novel NPHS1 and NPHS2 gene mutations in pediatric nephrotic syndrome patients from Pakistan[J]. Gene, 2012, 502(2): 133-7.
[17] 付荣, 陈新民, 王庆华, 等. 中国南方汉族人家族性激素耐药型肾病综合征家系NPHS2基因突变[J]. 中华儿科杂志, 2008, 46(8): 591-596.
[18] Chernin G, Heeringa S F, Gbadegesin R, et al. Low prevalence of NPHS2 mutations in African American children with steroid-resistant nephrotic syndrome[J]. Pediatr Nephrol, 2008, 23(9): 1455-1460.
[19] Hinkes B G, Mucha B, Vlangos C N, et al. Nephrotic syndrome in the first year of life: two thirds of cases are caused by mutations in 4 genes (NPHS1, NPHS2, WT1, and LAMB2)[J]. Pediatrics, 2007, 119(4): e907-e919.
[20] Cho H Y, Lee J H, Choi H J, et al. WT1 and NPHS2 mutations in Korean children with steroid-resistant nephrotic syndrome[J]. Pediatr Nephrol, 2008, 23(1): 63-70.
Polymorphisms of NPHS2 gene in sporadic nephrotic syndrome children of eastern Guangdong
WANG Xianyao1, QI Qiaowen1, LIN Haoquan1, LIN Min2, YANG Liye2, LIN Mingxiang1★
(1.Department of Pediatrics, Shantou Central Hospital, Guangdong, Shantou 515000, China; 2.Central Laboratory, Chaozhou Central Hospital, Guangdong, Chaozhou 521000, China)
Objective To study the polymorphisms of podocin coding NPHS2 gene in sporadic primary nephrotic syndrome (NS) children of eastern Guangdong in order to predict the responsiveness of steroid therapy and prognosis. Methods Genome DNA was amplif i ed by PCR. Polymorphisms of NPHS2 gene in 25 sporadic nephrotic syndrome children were examined by direct sequencing. Results There was no missense mutation being detected in exons 1~8 of NPHS2 in 25 sporadic NS children. Four polymorphisms (rs1079292; rs3738423; rs1410592; rs3818587) were detected among exon 1, 2, 8. Conclusion In 25 sporadic NS children of eastern Guangdong there was no missense mutation being detected in coding domain sequence, which indicated that mutation of NPHS2 was not the primary pathogeny of sporadic nephrotic syndrome children in eastern Guangdong.
NPHS2; Mutation; Eastern Guangdong; Sporadic; Nephrotic syndrome
广东省医学科研基金(B2010298)
1.汕头市中心医院儿科,广东,汕头 515000 2.潮州市中心医院中心实验室,广东,潮州 521000
★通讯作者:林明祥,E-mail: mingxlin@sina.com
