微炎症状态与腹膜透析
2012-11-26综述俞雨生审校
王 涵 综述 俞雨生 审校
腹膜透析(peritoneal dialysis,PD)患者微炎症状态发生率高,大量研究证实其与PD患者营养不良及心血管疾病的发生和发展密切相关,称之为营养不良-炎症-动脉粥样硬化(malnutrition-inflammationatherosclerosis,MIA)综合征[1]。MIA 综合征与 PD患者的预后密切相关,监测相关的炎症指标可预测PD患者的死亡率。近年来微炎症状态备受关注,本文就PD患者微炎症状态的原因、病理生理机制及预防措施作一简述。
微炎症状态的概念
早期研究发现,心血管疾病和终末期肾病(endstage renal disease,ESRD)患者体内存在急性时相反应,出现炎症因子、C反应蛋白(C-reactive protein,CRP)等升高。急性时相反应与预后密切相关,但患者并无明显感染征象,因其临床及病理生理特点不同于一般微生物感染,故称为“微炎症状态”[2],即内毒素、化学物质和免疫复合物等激活单核巨噬细胞系统,释放白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)等促炎性细胞因子,导致循环中炎性细胞因子轻度持续增高,而临床上无明显症状。
微炎症状态与多种疾病的发生、发展密切相关。微炎症状态在动脉粥样硬化的发病机制及心血管疾病的进展中起着重要作用,动脉粥样斑块是多因素共同作用的结果,首先病变处出现巨噬细胞、T淋巴细胞、肥大细胞聚集,导致炎症应答,释放炎症因子,而炎症因子释放进一步促进斑块形成。原发性高血压患者体内亦存在微炎症状态,并与血管内皮细胞功能障碍有关。此外,微炎症状态与ESRD患者多种并发症均有一定关联。Stenvinkel等[1]对109例ESRD患者的研究发现,22%患者同时存在营养不良、炎症及动脉粥样硬化三种情况,且三者之间存在相互因果关系,故临床上提出MIA综合征的概念。其中微炎症被认为是营养不良与动脉粥样硬化的中心环节,同时MIA状态亦影响PD患者生存质量及预后,是死亡率增加的重要因素。
PD导致微炎症状态的原因
微炎症状态在PD患者中发生率较高。根据CRP评估炎症发生率为12%~65%。其产生原因复杂,涉及多种透析和非透析相关因素(表1)。

表1 腹膜透析患者出现慢性炎症的原因[3]
透析相关因素
透析液 腹膜长期暴露于高渗、高糖、高乳酸盐的透析液中,葡萄糖降解产物(glucose degradation products,GDP)增加,可导致体内多种蛋白质发生非糖基化和糖基化终末产物(advanced glycation end products,AGE)蓄积。Schwedler等[4]体外实验证实,AGE可与特异性受体结合,激活细胞内信号转导通路,导致炎症反应。
腹膜转运功能 不同转运功能提示腹膜对葡萄糖的平衡作用、肌酐清除力、超滤能力不同。Sezer等[5]发现炎症状态与转运功能密切相关,高转运和高平均转运的PD患者微炎症状态发生率高,其CRP水平高于低转运和低平均转运者,其机制不明,可能与高转运PD患者营养不良和容量负荷过重有关。
此外,腹膜炎、导管出口处感染、导管刺激也是PD患者微炎症状态产生的重要原因。
非透析相关因素
残余肾功能状态 PD患者残余肾功能状态在调节活动性炎症中发挥重要作用。残余肾功能下降导致氧化应激反应增加,致使外周血单核细胞活化,血清中CRP,IL-6,血管内皮细胞黏附分子1,髓过氧化物酶水平显著升高,最终发生炎症反应。研究证明残余肾功能降低与CRP升高密切相关;另外,体内循环内皮因子及其可溶性受体浓度与肌酐清除率有关。事实上,ESRD患者透析前已出现炎症反应,其肾小球滤过率与炎性细胞因子(如 CRP,IL-6,TNF-α)浓度呈负相关[6];同时动物实验证实,肾脏切除术后小鼠的TNF-α和IL-1清除率降低,说明肾脏可能参与清除各种炎症因子,残余肾功能下降造成炎症因子清除减少,从而出现炎症反应。
遗传因素 IL-6的基因功能具有多样性,IL-6基因启动子174G/C单核苷酸多态性影响透析患者炎症反应和心血管疾病发生率。趋化因子受体5(CCR5)是多种促炎症因子受体,如CCR5基因缺失则导致相应受体缺乏,则炎症反应发生率和心血管疾病的死亡率较低。另外,CRP基因的单核苷酸多态性亦可决定CRP水平。
容量负荷 PD患者常有容量超负荷,可导致微炎症状态。研究表明容量负荷与CRP呈正相关[7],有心力衰竭病史的PD患者,其CRP水平明显高于无此病史的PD患者,目前认为其机制可能与免疫应答相关,容量负荷增加激活促炎因子,使TNF-α等炎症因子释放增加,引起炎症反应。
口腔感染 口腔疾病特别是牙周炎,是微炎症状态发生的重要来源。Bayraktar等[8]发现透析患者的口腔pH值、口腔菌斑指数均高于健康人,且牙周病变程度重,唾液流速低;另外PD患者的口腔菌斑指数与高敏CRP升高相关,但其具体机制尚不明确。
此外,毒素蓄积、心功能衰竭和动脉粥样硬化的病变心肌也是PD患者炎症和免疫系统激活的重要原因。
微炎症状态的病理生理改变
微炎症状态可以改变体内多个系统的病理生理(图1),特别是心血管、营养及内分泌系统。炎症因子通过诱导黏附分子、激活补体等多种途径(表2),促进动脉粥样硬化、心脏瓣膜钙化、心肌肥厚,并影响患者营养状况。
加速动脉粥样硬化 动脉粥样硬化是一种慢性炎症过程,在最初循环白细胞聚集和粥样硬化斑块裂解过程中均有炎症反应参与。
CRP可直接诱导血管内皮黏附分子表达,导致更多单核细胞黏附于血管内皮细胞。同时CRP降低主动脉内皮细胞上内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的表达及生物活性。eNOS活性降低,抑制一氧化氮(Nitric oxide,NO)的生物利用度,从而抑制血管扩张,刺激低密度脂蛋白(low density lipoprotein,LDL)氧化、平滑肌细胞增生和单核细胞黏附。CRP还能上调血管紧张素I受体,促进血管平滑肌细胞增生和迁移,上调人类单核细胞CCR2的表达,促进单核细胞介导的趋化作用[9]。临床研究证明CRP增加可预测正常人心血管疾病的发生。对PD患者的长期观察发现,CRP>5mg/L持续6个月,即与心脏缺血性疾病的发生显著相关,CRP增加也与颈动脉粥样硬化斑块形成密切相关[10]。
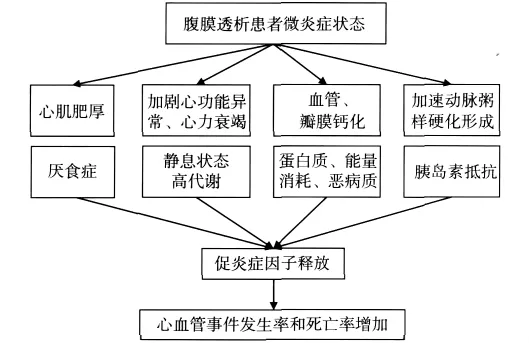
图1 腹膜透析患者微炎症状态的病理生理改变[3]
IL-6、TNF-α、细胞间黏附因子 1(intercellular adhesion molecule-1,ICAM-1)等促炎症反应因子,均与动脉粥样硬化形成有关。研究发现IL-6能早期预测PD患者颈动脉粥样硬化的发生,也是预测其严重程度的最好指标。Huber等[11]通过动物实验证实,重组IL-6可加剧载脂蛋白E(apolip-oprotein-E,APO-E)缺乏的小鼠早期动脉粥样硬化进展,表明IL-6可能参与早期动脉粥样硬化形成。同时Ridker等[12]的临床研究表明IL-6增加可预测健康男性心肌梗死的发生率。TNF-α增加则能够预测普通人群心肌梗塞后再发冠脉事件的概率。Papagianni等[13]对 63例持续非卧床腹膜透析(CAPD)患者随访发现ICAM-1独立于其他因素之一,与动脉硬化发生率相关,其机制不明。因此,炎症因子在动脉粥样硬化形成、发展过程中起重要作用。

表2 微炎症的生物标记物及作用机制[3]
促进血管、心脏瓣膜钙化 血管和心脏瓣膜钙化是ESRD及PD患者常见的并发症,也是影响患者死亡率的重要因素。血管及瓣膜钙化的调节机制不同,其中包括血管平滑肌转型为成骨细胞。ESRD患者的血管内膜和中膜均可发生钙化,是动脉粥样硬化加重的标志。其中冠状动脉钙化被认为是影响PD患者预后的重要因素。
以往研究认为,PD患者心脏瓣膜钙化与炎症状态密切相关,但不明确炎症状态的发生是血管、瓣膜钙化的合并症还是参与其进展的因素。Tintut等[14]在体外实验发现,TNF-α通过增加碱性磷酸酶活性和表达诱导血管钙化。小鼠体内TNF-α与血管钙化存在密切联系,从而证实了炎症因子诱发血管钙化形成的假说。有研究发现,尽管PD患者钙磷乘积<5 mmol2/L2,炎症状态仍可增加瓣膜钙化的风险,且高 CRP提示瓣膜钙化的 PD患者死亡率高[15]。对ESRD患者的尸检研究发现,在动脉壁钙化和非钙化部分均能检出CRP的mRNA显著增加[16],进一步说明尿毒症本身可能介导血管炎症和血管钙化的发展。
体内存在的钙化抑制物在防止血管和瓣膜钙化中发挥了关键作用。胎球蛋白A和骨保护素(osteoprotegerin,OPG)等是重要的体循环钙化抑制物,均与炎症活动具有密切的关系。胎球蛋白A是肝细胞合成的负性急性时相蛋白(62kD),可抑制细胞因子的产生、影响 TNF-α 功能。Schafer等[17]的动物实验显示,缺乏胎球蛋白A基因的小鼠喂食矿物质和过量维生素D,其肾脏,肺,心肌,皮肤,血管等多个器官均出现广泛的钙盐沉积,说明胎球蛋白A在抑制器官钙化的过程中起关键作用。同时临床观察发现,PD患者胎球蛋白A降低与营养不良、炎症、动脉粥样硬化、瓣膜钙化密切相关,并提示较高的死亡率和心血管死亡率。
OPG是肿瘤坏死因子受体家族的分泌蛋白,是核因子κB(NF-κB)配体的受体活化剂,在抑制破骨细胞活化和促进其体外凋亡中起重要作用,OPG基因敲除小鼠表现为广泛主动脉和肾动脉中膜钙化和骨质疏松,表明OPG在调节血管钙化和骨代谢中发挥作用。研究表明PD患者血清OPG水平高于正常人群,并与CRP相关。此外,透析患者高CRP和高OPG并存时提示腹部钙化进展迅速[18]。OPG对无炎症状态的透析患者无预测死亡率的价值。因此,OPG在血管钙化中的作用机制需要进一步研究。
心肌肥厚和心力衰竭 左心室肥厚是ESRD患者最常见的心血管并发症之一,可见于75%以上的早期透析患者。尿毒症心肌肥厚的特点,不仅表现在心肌细胞肥大,同时还存在间质纤维化。其发病机制复杂,不仅涉及收缩期高血压、糖尿病和高龄等传统危险因素,还涉及容量负荷增加、尿毒症毒素、低蛋白血症、钙、磷负超荷等肾脏病相关危险因素。目前对于CRP是否参与其发病机制尚不清楚。体外实验表明,CRP可通过 NF-κB机制,直接增强IL-1β激活心肌细胞诱导型NOS表达的作用。PD患者心肌肥厚的严重性与CRP增加有关,目前研究认为炎症和瓣膜钙化可能是残余肾功能减低与心肌肥厚之间的纽带[19]。
炎症状态可能加重心力衰竭。重度心力衰竭患者循环TNF-α和IL-6水平升高。纽约心脏病协会认为循环细胞因子水平与心力衰竭的严重程度直接相关[20]。这可能与促炎性细胞因子可促进左室重构、加重左室功能不全有关。实验研究表明,循环TNF具有负性肌力作用,当停止释放TNF时,其负性肌力作用消失[21]。Wang等[23]研究显示 PD 患者炎症状态与动脉弹性降低、心肌肥厚、扩张存在相关性。此外,心脏收缩和舒张功能障碍的PD患者体内存在高水平CRP和IL-6,提示这类患者存在心脏衰竭的高风险,已发生心力衰竭的PD患者死亡率更高。
心力衰竭患者炎性因子激活可能与循环内毒素水平增加有关,且合并水肿者内毒素水平明显高于无水肿者,利尿后内毒素水平明显下降,即所谓容量超负荷患者的“肠漏假说”,其本质是肠道通透性改变,导致水肿,同时细菌(包括内毒素)易位进入血液循环,导致全身性炎症[23]。细胞因子的激活可能与容量及非容量因素均有关。综上所述,炎性因子激活可能在调节心力衰竭进展中发挥重要作用,导致死亡率更高。
增加蛋白质、能量消耗 ESRD和PD患者发生蛋白质能量消耗和心血管疾病与炎症反应密切相关。蛋白消耗是影响PD患者预后的重要因素,严重者可出现恶病质,既往认为与蛋白质摄入减少,分解代谢增加有关。越来越多的证据表明,微炎症状态可能诱发厌食症。厌食症与炎症标志物(如IL-6和CRP)密切相关,并能预测透析患者的死亡率。促炎性细胞因子刺激瘦素释放,是急性炎症导致尿毒症患者厌食的潜在机制。在慢性肾功能不全患者中血清瘦素水平增加,与膳食摄入不足和高分解代谢有关。瘦素通过抑制神经元产生神经肽Y和刺鼠相关肽同时刺激下丘脑神经元释放促黑素细胞激素来抑制食欲,瘦素还可充当炎性细胞因子,如PYY3-36,生长素,胰岛素和脂联素,通过下丘脑中枢系统的调节参与体内能量代谢平衡。PD患者血清瘦素水平的升高与炎症状态和干体重降低有关,同时Mak等[24]也报道了瘦素与炎症相关恶病质有密切关系。瘦素受体缺陷小鼠(db/db)和黑皮质素受体基因敲除小鼠均未出现尿毒症相关恶病质,表明下丘脑黑皮质素系统(瘦素的中枢调节系统),在尿毒症相关恶病质发病机制中起重要作用。
可见,PD患者的炎症状态与营养不良密切相关,目前提出营养不良-炎症复合体综合征(malnutrition inflammation complex syndrome,MICS)的临床概念,并加以量化,用以评估透析患者的营养状况及死亡率。
胰岛素抵抗(insulin resistance,IR) IR是ESRD常见现象,主要表现为组织对胰岛素不敏感,IR预示ESRD患者心血管疾病死亡率增加[25]。尽管透析可在一定程度改善IR,但长期吸收透析液中葡萄糖进一步加重了PD患者代谢紊乱。有研究表明,炎症状态在 IR形成中可能起关键的作用。TNF-α等炎性因子可以抑制胰岛素信号转导,减少骨骼肌吸收葡萄糖,导致IR[26]。噻唑烷二酮类可以逆转TNF-α介导的IR、恢复胰岛素的敏感性。另外慢性亚临床炎症、肥胖、IR及动脉粥样硬化之间存在密切联系,提示ESRD患者的微炎症状态、肥胖、IR和心血管疾病可能存在一定联系。初步研究表明PD患者IR与慢性炎症之间也存在联系。
微炎症状态的防治
持续的微炎症状态可影响体内多个系统,加重动脉硬化、营养不良等并发症。因此在炎症状态早期给予合理干预,对于降低PD患者并发症发生率、死亡率有重要意义。
药物治疗 抗炎治疗能有效地降低PD患者发病率和死亡率,可应用他汀类、血管紧张素转换酶抑制剂(ACEI)、过氧化物酶增生物激活受体(PPAR)激动剂和抗氧化剂等多种药物控制炎症状态。
羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂(他汀类) 此类药物通过抑制胆固醇合成、脂质过氧化、稳定斑块等机制降低冠脉事件发生风险,恢复血管内皮细胞部分功能。研究还发现他汀类药物可抑制动脉血管壁炎症反应[27]。其作用机制包括:减弱炎症细胞向斑块内的趋化和聚集,抑制巨噬细胞可溶性细胞间黏附分子及金属蛋白酶表达等。存在高炎症状态PD患者服用辛伐他汀后,CRP和IL-6等炎症因子水平显著降低,而IL-10等抗炎症因子水平明显升高。
ACEI和血管紧张素受体抑制剂(ARB) 血管紧张素系统可以促进血管内皮细胞炎症反应发展,诱发斑块不稳定性,造成急性冠脉综合征。AngⅡ可通过AngⅡ型受体通路激活NF-κB和APO等转录因子,表达IL-6、VCAM和 TGF-α等多种细胞因子,介导微炎症反应。ARB可阻滞C-C趋化因子2b型受体,干扰其在炎症部位招募单核细胞,从而直接调节机体的免疫系统,发挥抗炎症作用,减轻炎症对血管内皮细胞、血管平滑肌细胞功能的损害[28]。
过氧化物酶体增生物激活受体(PPARs)激动剂巨噬细胞大量表达PPAR,活化巨噬细胞可释放多种促炎介质,目前认为PPAR在巨噬细胞炎症反应中起重要作用,可抑制巨噬细胞上脱辅基蛋B受体表达[29],并诱导、促进巨噬细胞凋亡,减少巨噬细胞炎性因子的释放,如 TNF-α、IL-1、IL-6等。PPARγ的配体罗格列酮激活 PPAR后,通过对NF-κB的抑制,使细胞因子和炎症介质释放减少,降低炎症反应发生率。
非药物治疗 针对导致微炎症状态的透析相关因素,亦可减轻微炎症状态。
改进葡萄糖透析液的生物不相容性 传统透析液中含高糖、高乳酸盐、高GDP和低PH值,长期应用可影响腹膜功能。生物相容性透析液可能增强宿主防御机制,减少微炎症反应。在一项随机对照试验显示,与传统透析液相比,以碳酸氢盐/乳酸盐混合物为缓冲碱的中性透析液,可降低GDP产生,降低IL-6和血管内皮生长因子水平,进而减少微炎症发生率。另外,使用生物相容性透析液的透析患者,其腹膜间皮细胞损害及腹膜纤维化发生率也较低。
控制容量负荷 能否维持容量平衡是判断PD患者预后的重要指标,有效控制容量负荷可以降低PD患者微炎症状态发生率。患者应限制盐、水分摄入,有残余肾功能的患者,可应用利尿剂增加尿量从而降低容量负荷。此外,艾考糊精透析液能够减少PD患者细胞外容积,尽管透析超滤量与腹膜转运功能有关,但艾考糊精对于细胞外液的影响主要取决于PD患者初始容量,而非腹膜转运功能。
微炎症状态与PD患者预后的评估
已有充足的证据表明,微炎症状态是预测透析患者死亡率和心血管死亡率的有效指标。Bergström[30]的早期研究表明,CRP 上升与血液透析患者死亡率增长之间存在相关性。随后,其他研究亦证实PD患者体内 CRP水平与死亡率相关。Herzig等[31]对50例PD患者的研究发现,高CRP水平增加急性心肌梗死风险,Wang等[32]得到相似结论,即CRP升高,独立于其他心血管、透析、营养和生化参数等指标,预测死亡率及心血管的发病率。对PD患者为期5年随访研究发现CRP≥10mg/L时,其死亡率增加超过3倍[33]。因此,高水平CRP已被证明可以独立于其他传统和非传统危险因素,预测心血管事件的发生。
连续测量CRP在预测透析患者的预后中具有重要意义。荷兰透析充分合作研究表示,单次血液透析后CRP每增加1mg/L,死亡风险率增加9%,取决于年龄、合并症、原发病及营养状况,而与透析前CRP水平无关[34]。连续长期(≥6月)随访测量较单次性测量CRP能更好地预测血液透析患者的死亡率。
除了CRP,其他炎症标志物也与死亡风险和心血管死亡率增加有关。已证明IL-6能够预测CKD不同时期及透析患者的死亡率[35],可能比CRP更有效地预测CKD患者的预后。此外,血清髓过氧化物酶、血清透明质酸、正五聚蛋白3,胎球蛋白A,可溶性CD14均被证实可以预测PD患者的死亡率及心血管事件的发生。
小结:微炎症状态是导致PD患者心血管事件高发的重要诱因,大量研究表明PD本身可以引起微炎症状态,且与PD患者心血管疾病、营养、代谢紊乱等并发症密切相关。通过测定CRP、IL-6等炎症因子,可有效预测PD患者死亡率及不可逆转的心血管事件发生率,积极早期干预微炎症状态,对缓解PD患者体内炎症反应,从而降低死亡率及心血管事件发生率有重要意义。
1 Stenvinkel P,Heimbürger O,Paultre F,et al.Strong association between malnutrition,inflammation,and atherosclerosis in chronic renal failure.Kidney Int,1999,55(5):1899-1911.
2 Schömig M,Eisenhardt A,Ritz E.The microinflammatory state of uremia.Blood Purif,2000,18(4):327-332.
3 Wang AY.Consequences of chronic inflammation in peritoneal dialysis.Semin Nephrol,2011,31(2):159-171.
4 Schwedler S,Schinzel R,Vaith P,Wanner C.Inflammation and advanced glycation end products in uremia:simple coexistence,potentiation or causal relationship?Kidney Int Suppl,2001,78:S32-36.
5 Sezer S,Tutal E,Arat Z,et al.Peritoneal transport status influence on atherosclerosis/inflammation in CAPD patients.J Ren Nutr,2005,15(4):427-434.
6 Pecoits-Filho R,Heimbürger O,Bárány P,et al.Associations between circulating inflammatory markers and residual renal function in CRF patients.Am JKidney Dis,2003,41(6):1212-1218.
7 Vicenté-Martínez M, Martínez-Ramírez L, Muñoz R, et al.Inflammation in patients on peritoneal dialysis is associated with increased extracellular fluid volume.Arch Med Res,2004,35(3):220-224.
8 Bayraktar G,Kurtulus I,Kazancioglu R,et al.Oral health and inflammation in patients with end-stage renal failure.Perit Dial Int,2009,29(4):472-479.
9 Han KH,Hong KH,Park JH,et al.C-reactive protein promotes monocyte chemoattractant protein-1—mediated chemotaxis through upregulating CC chemokine receptor 2 expression in human monocytes.Circulation,2004,109(21):2566-2571.
10 Wang AY,Ho SS,Liu EK,et al.Differential associations of traditional and non-traditional risk factors with carotid intima-media thickening and plaque in peritoneal dialysis patients.Am J Nephrol,2007,27(5):458-465.
11 Huber SA,Sakkinen P,Conze D,et al.Interleukin-6 exacerbates early atherosclerosis in mice.Arterioscler Thromb Vasc Biol,1999,19(10):2364-2367.
12 Ridker PM,Rifai N,Stampfer MJ,et al.Plasma concentration of interleukin-6 and the risk of future myocardial infarction among apparently healthy men.Circulation,2000,101(15):1767-1772.
13 Papagianni A,Kokolina E,Kalovoulos M,et al.Carotid atherosclerosis is associated with inflammation,malnutrition and intercellular adhesion molecule-1 in patients on continuous ambulatory peritoneal dialysis.Nephrol Dial Transplant,2004,19(5):1258-1263.
14 Tintut Y,Patel J,Parhami F,et al.Tumor necrosis factor-alpha promotes in vitro calcification of vascular cells via the cAMPpathway.Circulation,2000,102(21):2636-2642.
15 Wang AY,Lam CW,Wang M,et al.Increased circulating inflammatory proteins predict a worse prognosis with valvular calcification in end-stage renal disease:a prospective cohort study.Am JNephrol,2008,28(4):647-653.
16 Gross ML,Meyer HP,Ziebart H,et al.Calcification of coronary intima and media:immunohistochemistry,backscatter imaging,and x-ray analysis in renal and nonrenal patients.Clin JAm Soc Nephrol,2007,2(1):121-134.
17 Schafer C,Heiss A,Schwarz A,et al.The serum protein alpha 2-Heremans-Schmid glycoprotein/fetuin-A is a systemically acting inhibitor of ectopic calcification. J Clin Invest,2003,112(3):357-366.
18 Nitta K,Akiba T,Uchida K,et al.The progression of vascular calcification and serum osteoprotegerin levels in patients on long-term hemodialysis.Am JKidney Dis,2003,42(2):303-309.
19 Wang AY,Lam CW,Wang M,et al.Is valvular calcification a part of the missing link between residual kidney function and cardiac hypertrophy in peritoneal dialysis patients?Clin J Am Soc Nephrol,2009,4(10):1629-1636.
20 Torre-Amione G,Kapadia S,Lee J,et al.Tumor necrosis factor-alpha and tumor necrosis factor receptors in the failing human heart.Circulation,1996,93(4):704-711.
21 Bozkurt B,Kribbs SB,Clubb FJ Jr,et al.Pathophysiologically relevant concentrations of tumor necrosis factor-alpha promote progressive left ventricular dysfunction and remodeling in rats.Circulation,1998,97(14):1382-1391.
22 Wang AY,Wang M,Woo J,et al.Inflammation,residual kidney function,and cardiac hypertrophy are interrelated and combine adversely to enhance mortality and cardiovascular death risk of peritoneal dialysis patients. J Am Soc Nephrol,2004, 15(8):2186-2194.
23 Niebauer J,Volk HD,Kemp M,et al.Endotoxin and immune activation in chronic heart failure:a prospective cohort study.Lancet,1999,353(9167):1838-1842.
24 Mak RH,Cheung W,Cone RD,et al.Leptin and inflammationassociated cachexia in chronic kidney disease.Kidney Int,2006,69(5):794-797.
25 Shinohara K,Shoji T,Emoto M,et al.Insulin resistance as an independent predictor of cardiovascular mortality in patients with endstage renal disease.JAm Soc Nephrol,2002,13(7):1894-1900.
26 Solomon SS,Usdan LS,Palazzolo MR.Mechanisms involved in tumor necrosis factor-alpha induction of insulin resistance and its reversal by thiazolidinedione(s).Am J Med Sci,2001,322(2):75-78.
27 Tsirpanlis G,Chatzipanagiotou S,Nicolaou C.Microinflammation versus inflammation in chronic renal failure patients.Kidney Int,2004,66(5):2093-2094.
28 Marshall TG,Lee RE,Marshall FE.Common angiotensin receptor blockers may directly modulate the immune system via VDR,PPAR and CCR2b.Theor Biol Med Model,2006,3:1.
29 Kota BP,Huang TH,Roufogalis BD.An overview on biological mechanisms of PPARs.Pharmacol Res,2005,51(2):85-94.
30 Bergström J.Inflammation,malnutrition,cardiovascular disease and mortality in end-stage renal disease.Pol Arch Med Wewn,2000,104(4):641-643.
31 Herzig KA,Purdie DM,Chang W,et al.Is C-reactive protein a useful predictor of outcome in peritoneal dialysis patients?J Am Soc Nephrol,2001,12(4):814-821.
32 Wang AY,Lam CW,Chan IH,et al.Long-term mortality and cardiovascular risk stratification of peritoneal dialysis patients using a combination of inflammation and calcification markers.Nephrol Dial Transplant,2009,24(12):3826-3833.
33 Iseki K,Tozawa M,Yoshi S,et al.Serum C-reactive protein(CRP)and risk of death in chronic dialysis patients.Nephrol Dial Transplant,1999,14(8):1956-1960.
34 Korevaar JC,van Manen JG,Dekker FW,et al.Effect of an increase in C-reactive protein level during a hemodialysis session on mortality.J Am Soc Nephrol,2004,15(11):2916-2922.
35 Barreto DV,Barreto FC,Liabeuf S,et al.Plasma interleukin-6 is independently associated with mortality in both hemodialysis and predialysis patients with chronic kidney disease.Kidney Int,2010,77(6):550-556.
