移植肾肾小球病的临床病理观察
2012-11-26陈惠萍陈劲松季曙明黄湘华谢轲楠程东瑞文吉秋张明超刘志红孙启全
李 雪 陈惠萍 陈劲松 季曙明 黄湘华 谢轲楠 程东瑞 文吉秋 吴 迪 张明超 刘志红 孙启全
移植肾肾小球病(transplant glomerulopathy,TG)是肾移植术后常见病理改变之一,以肾小球基膜(GBM)双轨样改变为特征,常伴系膜基质增多[1]。早在40多年前,TG作为慢性移植肾肾病(CAN)的一种特殊病理类型已被人们认识[2]。2005年,Banff会议取消了CAN这一诊断名词,但由于TG特殊的形态学改变及其与体液性免疫的密切关系得以保留[3]。近年来,由于TG发病率高、预后差逐渐受到关注。然而,迄今为止国内尚无肾移植患者TG的相关报道。本文回顾性分析近年来南京军区南京总医院全军肾脏病研究所经肾活检诊断明确TG的患者的临床、病理特征及预后,旨在加深对 TG的认识。
对象和方法
研究对象 2004年1月至2011年7月南京军区南京总医院全军肾脏病研究所行同种异体肾移植术后活检 622例,确诊为 TG的患者 79例(12.7%),其中男性63例,女性16例,平均年龄(44.8±11.0)岁。TG诊断主要依据组织学 GBM双轨样改变(图1A),同时排除其他原因导致的GBM双轨样改变,如缺血、膜增生性肾小球肾炎(MPGN)复发和血栓性微血管病(TMA)及乙肝病毒、丙肝病毒相关的肾损害等。按Banff 2007分类标准[4],将患者分轻度(cg1)7例,中度(cg2)30例,重度(cg3)42例。
肾活检类型包括肾移植后半年行程序性活检和指征活检(主要包括移植肾功能减退和发现蛋白尿)。
免疫抑制方案 基础免疫抑制方案以他克莫司(FK506)或环孢素A(CsA)联合霉酚酸酯 (MMF)和糖皮质激素 (泼尼松,Pred)为基础,早期6例患者以硫唑嘌呤(AZA)替代MMF,另有4例患者在早期临床表现为蛋白尿时加用雷公藤多苷片。FK506初始量0.15 g/(kg·d),每12h一次,监测浓度并根据浓度调整剂量,术后6月内 FK506浓度控制在6~8 ng/ml之间。CsA起始剂量 6mg/(kg·d),1次/12h口服,术后6月内CsA浓度控制在100~150 ng/ml。MMF 起始剂量为 1.5 g/d,1 次/12h 口服,手术当日即服。术中应用甲泼尼龙(MP)静脉注射1 000mg/d,术后第1、2天500mg/d。从第 3天起口服 Pred 80mg/d,每日递减10mg,减至 20mg/d维持,此后逐渐减量,术后6月减量至10~15mg/d,术后1年减量至5mg/d并长期维持。
临床观察指标 临床资料取自随访系统,主要包括肾移植受者的性别、年龄、移植时间、肾活检时间、免疫抑制剂方案,肾活检时24h尿蛋白定量、血白蛋白、血红蛋白(Hb)、血清肌酐(SCr)水平,HLA-Ⅰ抗体及HLA-Ⅱ抗体水平及是否有急性排斥反应(AR)病史。
临床指标定义 蛋白尿:尿蛋白定量 >0.4 g/24h;中等量蛋白尿为尿蛋白定量1~3.5 g/24h,肾病范围蛋白尿为尿蛋白定量>3.5 g/24h。镜下血尿:尿沉渣红细胞计数>10万/ml。贫血:Hb男性 <120 g/L,女性 <110 g/L;轻度90~120 g/L,中度60~90 g/L,重度 <60 g/L。
肾脏组织病理检查 所有患者均在B超引导下行经皮肾活检穿刺术,穿刺方法采用斜角进针负压吸引法。所取肾组织分别送光镜、免疫病理检查。
光镜 石蜡切片 2μm 行 HE、PAS、PASMMasson和Masson三色染色。观察项目包括肾小球炎、肾小管炎、管周毛细血管炎、动脉内膜炎及肾间质纤维化等;肾间质纤维化、肾小管萎缩及内膜纤维性增厚作为慢性损伤的标志。病变程度根据Banff 2007 分级(0~3)[4],肾小球(g)、肾间质(i)、肾小管(t)、血管(v)、管周毛细血管(ptc)分别积分,上述病变的程度如肾小管萎缩(ct)、间质纤维化(ci)和动脉硬化(cv)分级也依 Banff 2007[4]。
免疫荧光 应用冰冻组织切片行 IgG、IgA、IgM、C3、C4和 C4d染色。C4d阳性的量化评分依照 Banff 2007[4]。
免疫组化 应用免疫组化法行肾组织CD4、CD8、CD20、CD68、HLA-DR 和 IL-2R 检查。
统计学分析 采用 SPSS 13.0软件进行分析,符合正态分布的计量资料以均数 ±标准差表示,计数资料以百分率表示。正态分布参数,两组间比较采用非配对t检验,多组比较采用单因素方差分析(one-way ANOVA)。百分率的比较采用卡方检验。所有检验均为双侧检验,P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
TG患者一般情况 表1为TG患者的一般情况。2004年1月至2011年7月在我院行移植后肾活检患者622例,其中79例诊断符合TG,占移植肾活检的12.7%,多在移植后5~7年确诊TG。分析资料时,79例患者中已有23例移植肾失随功,4例失随访,其余52例仍在随访。
临床特征及实验室检查特点 如表2所示,蛋白尿是TG患者最常见的临床表现(91.1%),其中以中等量蛋白尿最为常见,13.9%的患者存在肾病范围蛋白尿,血尿(均为镜下血尿)仅 20.3%。84.8%患者存在不同程度的贫血,其中以轻、中度贫血为常见。70例患者(88.6%)诊断时 SCr升高[(228.1 ±127.3)μmol/L]。28 例(35.4%)患者存在急性体液性排斥(AHR)的病史,65例行血清中群体反应性抗体(PRA)检测的患者中有35例阳性,其中30例患者(46.2%)抗HLA-Ⅱ类抗体阳性,9例(13.9%)抗HLA-Ⅰ类抗体阳性,4例患者两类抗体均为阳性。

表1 79例移植肾肾小球病患者的一般情况

表2 移植肾肾小球病患者临床表现及实验室检查特点及其与病理分型的对照
病理特点 79例TG患者在诊断时以中、重度为主。肾小球炎(图1B)、肾间质纤维化、肾小管萎缩及管周毛细血管炎几乎是所有患者共有的病变。44例患者(55.7%)C4d阳性(图1C)。TG患者间质CD4、CD8、CD68及CD20细胞计数均普遍增多(表3,4)。
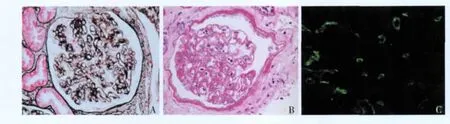
图1 移植肾肾小球病患者组织学及免疫荧光特点

表3 移植肾肾小球病患者的主要病理改变评分
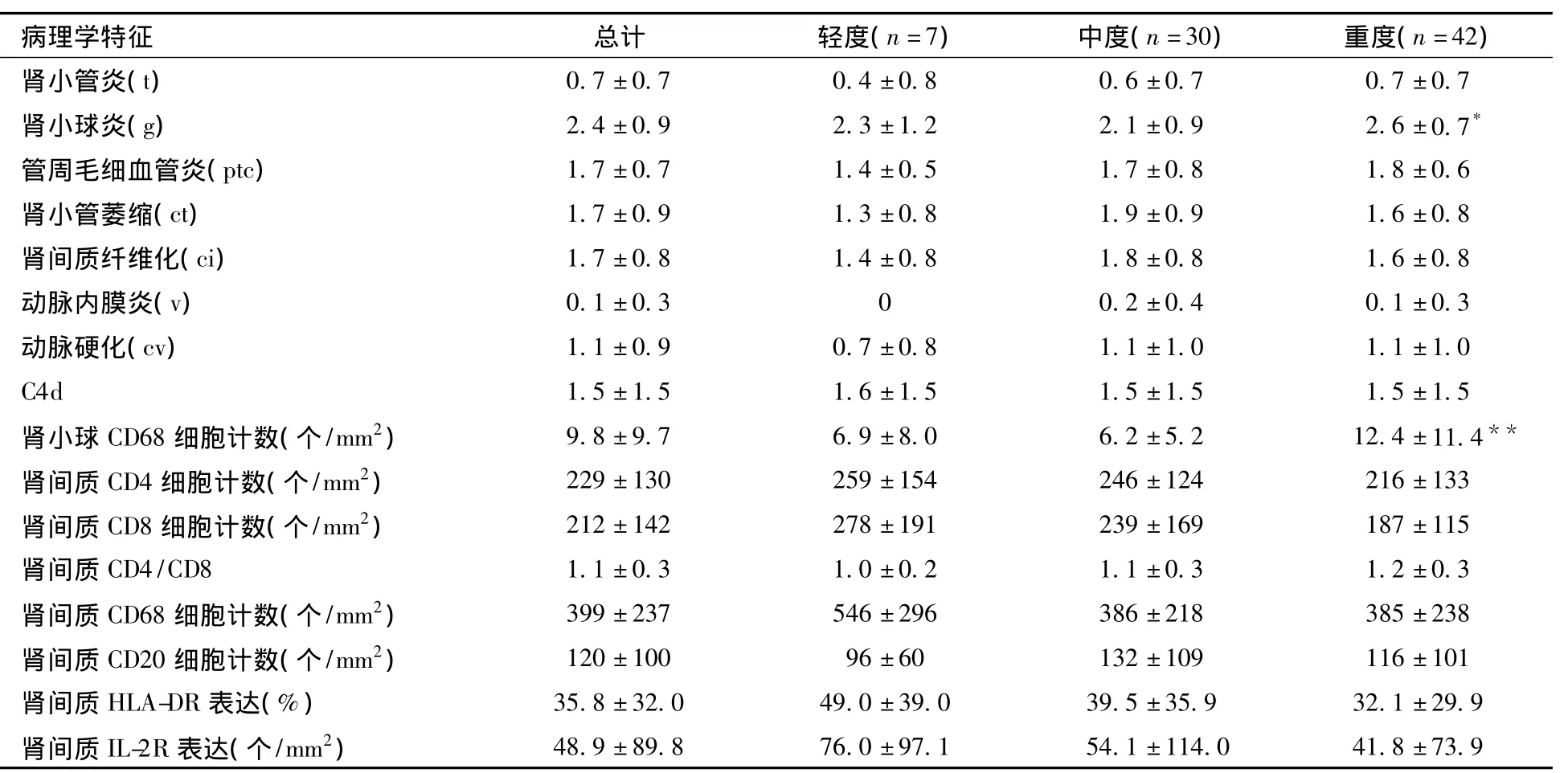
表4 移植肾肾小球病患者的病理学特征及其与病理分型的对照
临床特征及实验室检查特点与病理分型的对照 将79例TG患者根据病理改变严重程度分组后分析表明,TG的严重程度与患者性别、年龄、诊断时间及免疫抑制治疗方案无关。cg1组、cg2组和cg3组患者比,cg3组蛋白尿发生率高且较严重(P<0.01),血浆白蛋白相对较低(P <0.05),而其他指标如血红蛋白水平、SCr水平、HLA抗体水平等无统计学意义;cg3组患者肾小球炎得分及肾小球内巨噬细胞计数高,肾间质炎细胞(CD4、CD8、CD68和CD20细胞)计数、肾间质纤维化和肾小管萎缩程度等三组无统计学差异。
讨 论
TG患者一般情况 各移植中心对TG发病率的报道差别很大,从2.4%~ 20%不等[5-7],本中心TG患者占移植肾活检患者的12.7%。Gloor等[7]一项对55例确诊为TG患者的研究发现,肾移植6月内极少诊断TG,其一年发病率为4.0%,五年发病率为20.2%;去除指征活检的患者后,TG的一年发病率降至2.8%,五年发病率为11.5%。由于各移植中心移植肾活检的指征不同,TG的发病时间也有差异,我们的研究表明,TG诊断多在移植后5~7年,这与国外(2.75~8.2 年)的报道相似[7,8]。随着移植肾活检技术的普及,诊断时间有望提前。
临床特征及实验室检查特点 我们的观察显示,约90%的TG患者存在蛋白尿和(或)移植肾功能不全。TG的临床表现滞后病理学改变,早期临床表现是非特异性的,包括SCr进行性升高、少量蛋白尿和轻度高血压,TG进展期则可出现肾病范围内的蛋白尿和进行性移植肾功能下降[6,7]。因此,蛋白尿和移植肾功能不全的程度可能因各中心活检的指征而异。Gloor等[7]报道的 TG患者中47%SCr正常,其他因指征活检诊断的TG患者,肾功能不全概率要高得多。Sis等[6]报道66例TG患者诊断时SCr波动在(177.0 ±99.8)μmol/L间。本研究中 79例TG患者诊断时91.9%为中、重度,cg1患者仅占8.9%,因此,存在蛋白尿和(或)移植肾功能不全的患者高达90%。
本研究发现多数患者(84.8%)存在不同程度的贫血,其中以轻、中度贫血常见。移植后贫血的发病率各中心报道有所不同,但大多在25%~40%[9-11]。目前普遍认为可导致移植后贫血的原因主要包括移植肾功能不全、免疫抑制剂(如MMF、AZA)、降压药物如血管紧张素转换酶抑制剂(ACEI)和血管紧张素受体拮抗剂(ARB),铁缺乏和供受者的年龄偏大等[12]。本组患者贫血的发生率高,是否有其他尿因,有待我们进一步研究。
本研究中HLA抗体特别是HLA-Ⅱ抗体阳性率较高,这一结果与目前普遍接受的TG与体液性免疫密切相关这一观点一致。近年来,多项研究表明TG在抗-HLA抗体阳性的患者中更常见,且HLA-Ⅱ抗体与 TG 的关系较 HLA-Ⅰ抗体更为密切[6,7,13]。有研究表明,肾小球和管周毛细血管内皮细胞在正常情况下可表达 HLA-Ⅱ抗原[14,15]。
我们分析了活检时进行的血清群体反应性抗体(PRA)检测及目前仍在随访的58例TG患者的资料发现,TG患者HLA抗体与AR的发生无关联(P>0.05),HLA阳性 TG患者与 HLA阴性 TG患者预后无统计学差异(P=0.148);而 Hourmant等[16]一项对移植后受者HLA抗体与AR及移植肾预后的大样本研究显示,HLA抗体、AR与移植肾功能预后不良相关,提示与其他移植后疾病不同,HLA抗体有其特殊的机制参与TG形成。
病理特点 目前普遍认为TG是慢性体液性排斥的特殊病理类型(Banff 2005 和 2007)[3,4]。移植肾肾小球炎、管周毛细血管炎等体液性排斥的特殊性病变可见于TG患者,而肾间质炎细胞浸润、管周毛细血管基膜增厚、肾间质纤维化及肾小管萎缩是TG患者共有的病变。移植肾间质中大量炎细胞(CD4、CD8、CD68及 CD20 细胞)浸润,肾小球中亦可见单核细胞细胞浸润,因此推测TG是否与慢性活动性炎症反应相关。
多项研究表明,管周毛细血管C4d沉积与TG密切相关[17,18]。本研究发现,管周毛细血管 C4d沉积仅见于44例(55.7%),其中弥漫性沉积(C4d3)35例,局灶性沉积 (C4d2)6例,这与国外研究结果相似。Colvin等[19]报道 TG患者 C4d沉积概率为30%~60%,平均约50%。TG作为以体液性免疫为主的病变,C4d阳性率仅约50%,可能与C4d作为体液性排斥的标志物敏感性不足有关;Sis等[6]研究认为管周毛细血管C4d沉积并不能代表循环中抗体水平,因此,C4d阴性也不能排除抗体介导的肾小球损伤[6]。
临床特征及实验室检查特点与病理分型的对照Maryniak等[20]提出TG的病理特征随病程进展而加重,最早的病理改变是弥漫性内皮细胞和系膜细胞肿胀及毛细血管袢开放减少,随之而来的是GBM分层、系膜基质增多,少数为肾小球节段硬化。
随着TG进展,蛋白尿水平也加重,至后期甚至出现肾病范围蛋白尿和低蛋白血症;肾小球炎逐渐加重,肾小球巨噬细胞计数也明显增多,这与Cosio等的研究一致[13]。其他病理学损伤,包括肾间质炎症、肾小管炎、肾间质纤维化/肾小管萎缩 (IF/TA)等的严重程度并不与TG的严重程度一致,Gloor等[7]认为这可能与部分TG有其特殊的发病机制有关,一些严重TG的病理表现相对较轻,甚至有些TG少见除GBM双轨之外的病理学异常表现。
总之,本研究结果表明,TG患者的临床表现包括蛋白尿、移植肾功能不全,84.8%的患者存在不同程度的贫血,35.4%的患者有AHR病史,46.2%的患者HLA-Ⅱ类抗体阳性。TG患者的组织学特点包括GBM双轨样改变、肾小球炎、管周毛细血管炎、间质纤维化及肾小管萎缩等,这些改变符合慢性体液性排斥特点。
1 Racusen LC,Solez K,Colvin RB,et al.The Banff 97 working classification of renal allograft pathology.Kidney Int,1999,55(2):713-723.
2 Hood B,Olander R,Nagy Z,et al.Glomerulopathy in the transplanted kidney.Scand JUrol Nephrol,1970,4(2):135-142.
3 Solez K,Colvin RB,Racusen LC,et al.Banff'05 Meeting Report:differential diagnosis of chronic allograft injury and elimination of chronic allograft nephropathy(‘CAN’).Am J Transplant,2007,7(3):518-526.
4 Solez K,Colvin RB,Racusen LC,et al.Banff 07 classification of renal allograft pathology:updates and future directions.Am J Transplant,2008,8(4):753-760.
5 John R,Konvalinka A,Tobar A,et al.Determinants of long-term graft outcome in transplant glomerulopathy.Transplantation,2010,90(7):757-764.
6 Sis B,Campbell PM,Mueller T,et al.Transplant glomerulopathy,late antibody-mediated rejection and the ABCD tetrad in kidney allograft biopsies for cause.Am JTransplant,2007,7(7):1743-1752.
7 Gloor JM,Sethi S,Stegall MD,et al.Transplant glomerulopathy:subclinical incidence and association with alloantibody.Am J Transplant,2007,7(9):2124-2132.
8 Sijpkens YW,Joosten SA,Wong MC,et al.Immunologic risk factors and glomerular C4d deposits in chronic transplant glomerulopathy.Kidney Int,2004,65(6):2409-2418.
9 Mix TC,Kazmi W,Khan S,et al.Anemia:a continuing problem following kidney transplantation. Am J Transplant,2003,3(11):1426-1433.
10 Petrone H,Arriola M,Re L,et al.National survey of anemia prevalence after kidney transplantation in Argentina.Transplant Proc,2010,42(1):288-290.
11 Chadban SJ,Baines L,Polkinghorne K,et al.Anemia after kidney transplantation is not completely explained by reduced kidney function.Am JKidney Dis,2007,49(2):301-309.
12 Vanrenterghem Y. Anemia after kidney transplantation.Transplantation,2009,87(9):1265-1267.
13 Cosio FG,Gloor JM,Sethi S,et al.Transplant glomerulopathy.Am J Transplant,2008,8(3):492-496.
14 Muczynski KA,Cotner T,Anderson SK.Unusual expression of human lymphocyte antigen class II in normal renal microvascular endothelium.Kidney Int,2001,59(2):488-497.
15 Muczynski KA,Ekle DM,Coder DM,et al.Normal human kidney HLA-DR-expressing renal microvascular endothelial cells:characterization,isolation,and regulation of MHCclass II expression.J Am Soc Nephrol,2003,14(5):1336-1348.
16 Hourmant M,Cesbron-Gautier A,Terasaki PI,et al.Frequency and clinical implications of development of donor-specfic and non-donorspecific HLA antibodies after kidney transplantation.J Am Soc Nephrol,2005,16(9):2804-2812.
17 Mauiyyedi S,Pelle PD,Saidman S,et al.Chronic humoral rejection:identification of antibody-mediated chronic renal allograft rejection by C4d deposits in peritubular capillaries.J Am Soc Nephrol,2001,12(3):574-582.
18 Regele H,Böhmig GA,Habicht A,et al.Capillary deposition of complement split product C4d in renal allografts is associated with basement membrane injury in peritubular and glomerular capillaries:a contribution of humoral immunity to chronic allograft rejection.J Am Soc Nephrol,2002,13(9):2371-2380.
19 Colvin RB.Antibody-mediated renal allograft rejection:diagnosis and pathogenesis.J Am Soc Nephrol,2007,18(4):1046-1056.
20 Maryniak RK,First MR,Weiss MA.Transplant glomerulopathy:evolution of morphologically distinct changes.Kidney Int,1985,27(5):799-806.
