多靶点治疗Ⅳ+Ⅴ型狼疮性肾炎的长期随访
2012-11-26许圣淳陈樱花刘正钊章海涛刘志红胡伟新
许圣淳 陈樱花 刘正钊 章海涛 鲍 浩 刘志红 胡伟新
上世纪80年代后,环磷酰胺(cyclophosphamide,CTX)联合激素治疗弥漫增生性狼疮肾炎(diffused proliferative lupus nephritis,DPLN),显著改善患者的预后。2000年新型免疫抑制剂吗替麦考酸酚酯(mycophenolate mofetil,MMF)和他克莫司(tacrolimus,FK506)开始用于治疗狼疮性肾炎(lupus nephritis,LN),因疗效佳,安全性好,可替代CTX成为治疗新选择。既往研究发现,以上治疗对于增生性肾炎效果显著,6月完全缓解率达40%~60%[1-2],而对合并膜性病变的IV型LN的诱导疗效均不理想[3,4],6月完全缓解率 <30%,尤以静脉环磷酰胺冲击疗法(intravenous cyclophosphamide,IVCY)最差(<10%)。
鉴于此,我们首次提出了激素联合 MMF及FK506的多靶点疗法(multi-target therapy,MT),随机对照试验证实该方法治疗Ⅳ+Ⅴ型LN的6月完全缓解率显著高于IVCY疗法(50%vs 5%),同时不良反应发生率较低[5]。但该研究样本量小,随访时间短,疗效及安全性评价限于诱导阶段。LN的治疗是一个长期免疫调控的过程,在力求临床缓解后,降低复发率、减少药物不良反应,改善远期预后是临床医生面临的艰巨任务。MT诱导疗效肯定[5-7],该疗法能否成为有效合理的维持方案?长期用药安全性如何?目前尚无相关报道。本研究是前期小样本、诱导期临床试验[5]的扩展及延续:增加病例数、延长随访时间,评价MT治疗Ⅳ+Ⅴ型LN的长期疗效及安全性。
对象和方法
研究对象 2005年9月至2009年6月期间于全军肾脏病研究所住院,且符合以下标准者:(1)年龄12~60岁,性别不限;(2)符合1997年美国风湿病协会(the American college of rheumatology,ACR)系统性红斑狼疮(SLE)的诊断标准,SLE活动性指数(disease activity index,DAI)≥12 分[8];(3)入组前3周内接受肾活检,符合2003年ISN/RPS病理分型标准的Ⅳ +Ⅴ型 LN[9],慢性化指数(chronicity index,CI)<4 分[10];(4)24h 尿蛋白定量 >1.5 g/d,伴或不伴活动性尿沉渣(尿红细胞计数>10万/ml或尿白细胞>5个/HP或红细胞管型)。
排除标准包括:(1)血清肌酐(SCr)>265.2 μmol/L(3mg/dl)或估计的肾小球滤过率(estimated glomerular filtration rate,eGFR)<30 ml/(min·1.73m2);(2)肝功能异常:谷丙或谷草转氨酶超过正常上限2倍;(3)糖代谢异常:空腹血糖>6.1 mmol/L或餐后2h血糖>7.8 mmol/L;(4)对方案中任一免疫抑制药物过敏或有禁忌证者;(5)入组前12周内接受CTX、MMF或FK506治疗,或入组前24周内接受丙球、肾脏替代或血浆置换治疗;(6)妊娠、哺乳期妇女,或拒绝避孕者;(7)合并危及生命的并发症,如严重感染、狼疮脑病等。
分组及治疗方案 符合入选条件者随机分为两组:MT组和IVCY-硫唑嘌呤(AZA)组。诱导6月获完全缓解者转入维持治疗,6月获部分缓解者延长诱导治疗至9月,后切换至维持治疗;6月无效者退出方案。总随访时间为24月。
MT组:诱导期及维持期均采用激素联合MMF及FK506治疗。诱导期MMF和FK506剂量和剂量调整与我们既往报道一致[5],即 MMF 1 g/d,FK506 4mg/d,体重<50 kg者,MMF和FK506的初始剂量分别减至 0.75 g/d和 3mg/d。维持期 MMF及FK506分别减至诱导期剂量的3/4,即 MMF 0.75 g/d,FK506 3mg/d。持续完全缓解者,MMF及FK506剂量分别减至0.5 g/d和2mg/d。
IVCY-AZA组:诱导期采用CTX静脉冲击治疗,CTX首次剂量0.75 g/m2体表面积(BSA)[计算公式:BSA(m2)=,此后可根据血象和患者反应调整为0.5~1.0 g/m2BSA,每月 1次。维持期予 AZA口服,剂量为2mg/(kg·d)。
两组激素使用方法相同。均先接受甲强龙静脉冲击,0.5 g/d×3d。后续口服泼尼松,起始剂量0.6~0.8mg/(kg·d)×4周,后每2 周减5mg/d,至 20mg/d后每2周减2.5mg/d,直至10mg/d(诱导4月左右),以此剂量维持。
出现以下情况,免疫抑制药物减量或暂停:(1)FK506谷浓度>10 ng/ml,霉酚酸(MPA)0~12 h血药浓度曲线下面积(MPA-AUC0~12h)>45mg·h/L;(2)SCr持续升高超过基线30%,或超过正常上限;(3)糖代谢异常;(4)肝酶异常:谷丙或谷草转氨酶超过正常上限2倍;(5)血白细胞计数(WBC)减低(排除 SLE活动),或淋巴细胞亚群 CD4+细胞<200/μl;(6)胃肠道不适。
患者退出研究的指标包括:(1)严重合并症:如狼疮脑病、严重感染、心脑血管意外;(2)狼疮病情迅速恶化,需静脉免疫球蛋白、血浆置换等补救治疗;(3)持续或严重的肝酶升高(谷丙或谷草转氨酶超过正常上限5倍),WBC持续或严重减低(WBC<2×109/L);(4)SCr持续倍增;(5)诱导期停药MT组超过1周、IVCY-AZA组超过2周或维持期停药超过2周;(6)诱导治疗6月无效;(7)患者本人要求退出研究。
联合用药 禁止合并使用其他免疫抑制剂,如来氟米特、甲氨蝶呤等。降压药物使用钙通道拮抗剂,β受体阻滞剂,目标血压控制在130/85 mmHg以下,禁止使用血管紧张素转换酶抑制剂(ACEI)或血管紧张素II受体拮抗剂(ARB)。如入组前已使用ACEI或ARB 4周以上,可继续保留。
肾组织病理 所有患者在入选前三周内行B超引导下经皮肾穿刺术,肾组织行常规光镜、免疫荧光和电镜检查。光镜检查采用石蜡切片,行HE、PAS、PASM-Masson、Masson 三色染色,免疫荧光行冰冻切片 IgG、IgM、IgA、C3、C1q抗原染色。参照Austin评分系统[10],进行肾组织活动性指数(activity index,AI)及CI半定量评分。
随访及观察指标 诱导期每月随访1次,维持期每3月随访1次,记录患者临床表现及实验室检查,包括24h尿蛋白定量、尿沉渣、血白蛋白、SCr、抗核抗体(ANA)、抗双链DNA(ds-DNA)抗体、补体C3、C4、全血细胞计数、血糖、血脂。MT组在接受治疗后1周、1月、3月、6月和9月计算MPA-AUC0~12h及检测FK506谷浓度。检测三个时间点血样标本MPA 浓度(服药前、服药后 0.5h、2h)、通过公式[11]计算获得MPA-AUC0~12h。采集服药前血样标本检测FK506谷浓度。eGFR采用MDRD公式计算(两组分别有2例<18岁患者采用Schwartz公式)。详细记录治疗过程中的各种不良反应,包括感染、过敏、胃肠道症状、肝酶升高、血液系统损害、及女性月经情况。肝酶升高定义为谷丙转氨酶或谷草转氨酶升高超过正常上限2倍。血液系统损害需排除SLE疾病活动所致。
疗效评价 主要疗效指标为完全缓解率,次要指标包括部分缓解、复发。
完全缓解定义为:24h尿蛋白定量<0.4 g/d,无活动性尿沉渣,血白蛋白≥35 g/L,SCr正常或上升不超过基础值15%。部分缓解定义为:24h尿蛋白定量下降至基础值50%以下、且<3 g/d,血白蛋白≥30 g/L,SCr正常或上升不超过基础值15%。无效指未达到完全或部分缓解标准。
复发包括肾脏病复发和肾外表现复发。肾脏病复发定义为:完全缓解者24h尿蛋白定量≥1.0 g/d、部分缓解者24h尿蛋白定量上升≥2.0 g/d,或尿蛋白倍增,伴或不伴血尿增加(尿沉渣红细胞计数倍增,或由<10万/ml升至>20万/ml)或SCr升高。肾外表现复发定义为:SLE-DAI升高>4分,包括出现皮疹、血管炎、关节痛、血液系统、神经系统症状、狼疮性心肌炎、狼疮性肺炎、浆膜腔炎等与SLE活动相关的症状,或实验室检查异常等。
统计方法 计量资料以均数±标准差或中位数(四分位数)表示,计数资料以百分率表示。两组间计量资料的比较采用t检验或Mann-Whitney U检验,计数资料比较采用χ2检验或 Fisher精确检验。Kaplan-Meier法分析累积完全缓解率和肾脏无复发生存率,组间比较采用Log-rank检验。数据分析使用SPSS 13.0统计软件,重复测量数据分析应用SAS 9.1软件中的MIXED过程,得到时间交互作用项系数,差值采用最小二乘法计算得到。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
基线资料 共80例患者进入本研究,每组各40例。71例完成6月诱导治疗(MT组37例,IVCY-AZA组34例),其中60例获得完全或部分缓解,MT组36例(90%),IVCY-AZA组24例(60%)。IVCY-AZA组3例缓解患者诱导结束时失访(1例完全缓解者6月失访,2例部分缓解者9月失访),因此进入维持治疗的共57例,MT组36例、IVCY-AZA组21例(图1)。
诱导治疗前及维持治疗前两组基线资料均无明显差异(表1)。诱导治疗前,61例(76.3%)患者存在肾病范围蛋白尿(24h尿蛋白定量>3.5 g/d),12例患者(15%)基线SCr升高。
疗效分析 意向性分析(intention-to-treat analysis,ITT)表明,诱导6月期间,MT组完全缓解率显著高于 IVCY-AZA组(45%vs 12.5%,P=0.001),两组部分缓解率分别为 45% 和 47.5%(P=0.823)(图2),MT组总缓解率90%,显著高于IVCY-AZA组(60%,P=0.002)。24月期间,MT组80%患者达完全缓解,显著高于 IVCY-AZA组(47.5%,P=0.002)。MT组6月及24月累积完全缓解率均明显高于 IVCY-AZA组(P=0.002,0.036;图3)。MT组获完全缓解的中位时间为7个月,IVCY-AZA组为10个月。
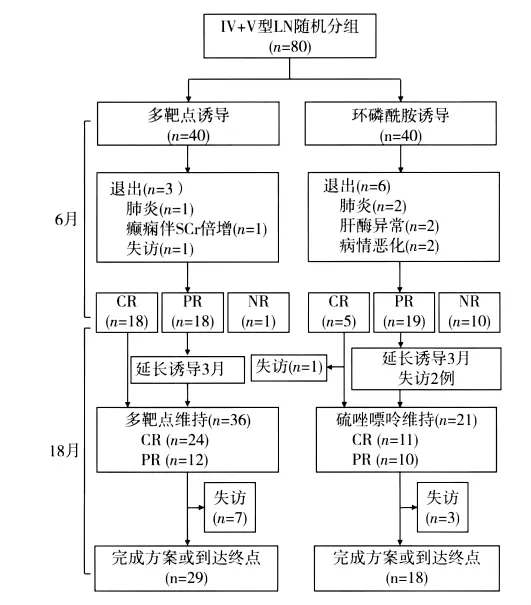
图1 两组入组及随访情况
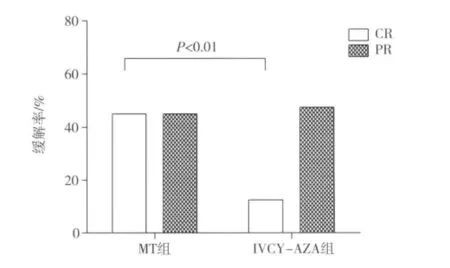
图2 治疗诱导6月缓解率比较
多靶点药物剂量及浓度 表2示MMF和FK506的用量,诱导期 MPA-AUC0~12h20~35mg·h/L,FK506 谷浓度5~6 ng/ml。
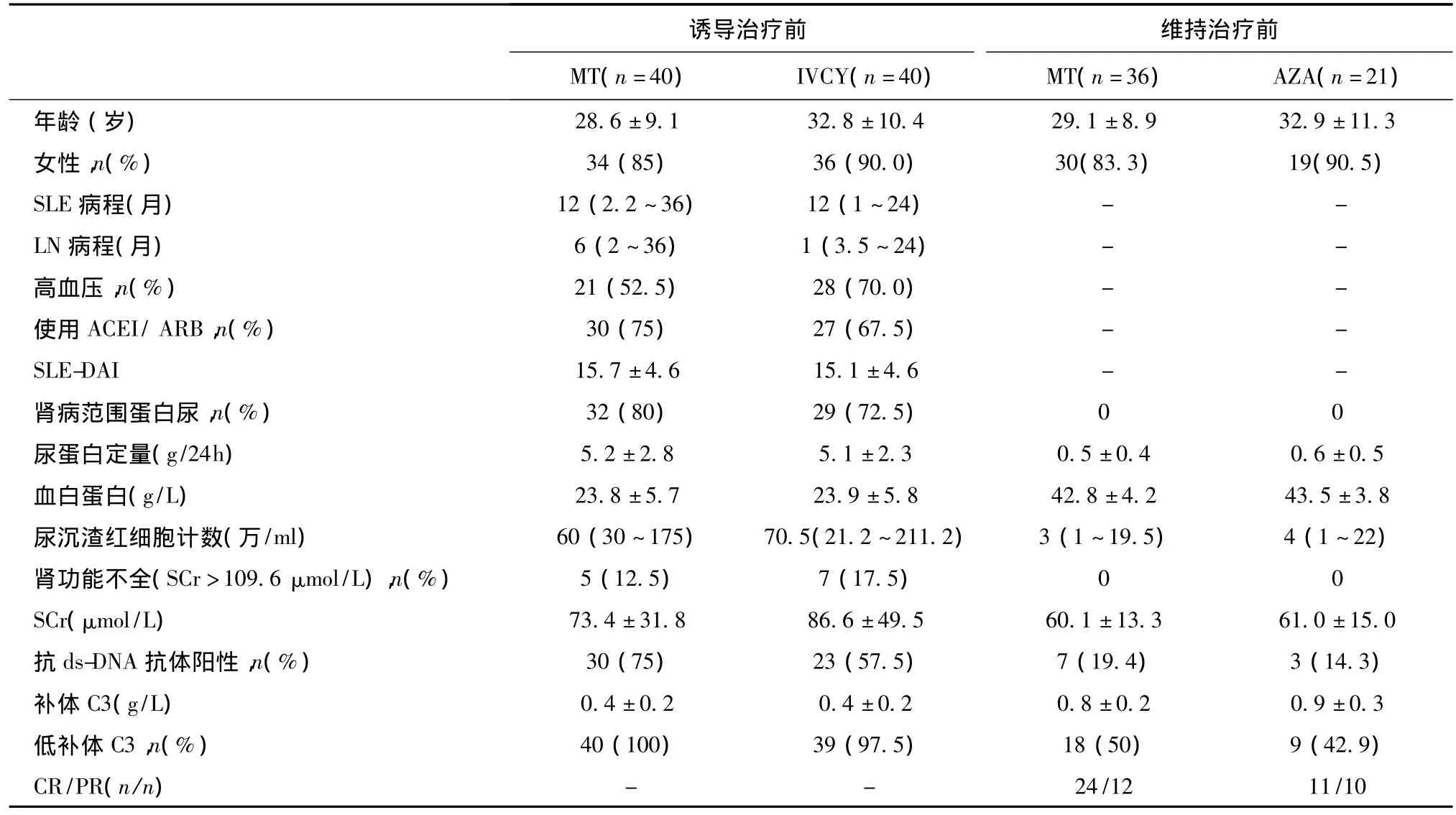
表1 诱导及维持治疗前患者临床资料比较
免疫指标变化 MT组诱导6月时,抗ds-DNA抗体转阴率、以及补体C3、C4恢复正常比例均高于IVCYAZA组,但未达到统计学差异(P>0.05)(表3)。
重复测量数据分析 混合效应模型分析表明MT组和IVCY-AZA组SCr值均随时间显著减低(两组系数分别为 -0.004、-0.008,P 分别为 0.026,<0.000 1),MT 组 SCr值显著低于 IVCY-AZA 组(差值 =6.90 μmol/L;95%CI 0.037~ 0.119,P=0.000 2)。MT组和IVCY-AZA组eGFR随时间明显改善(两组系数分别为 0.468、0.621,P 分别为0.015、0.006),且MT 组的eGFR 值高于 IVCY-AZA组 [差值 =-8.196 ml/(min·1.73m2);95%CI-12.4~ -3.92,P=0.000 2]。两组尿蛋白定量均随时间显著减低(两组系数分别为 -0.124、-0.154,P < 0.000 1),MT 组尿蛋白定量低于IVCY-AZA 组(差值 =0.767 g/d;95%CI 0.520~1.014,P <0.000 1)。两组白蛋白均随时间显著增加(两组系数分别为0.651、0.712,P <0.000 1),MT组白蛋白值高于 IVCY-AZA组(差值 =-2.093 g/L;95%CI-2.945~ -1.241,P < 0.000 1)。MT组和IVCY-AZA组补体C3随时间明显升高(两组系数分别为 0.009、0.011,P < 0.000 1),MT 组 C3值显著高于 IVCY-AZA组(差值 =-0.043 g/L;95%CI-0.073~ -0.012,P=0.006 4)。各指标随时间变化趋势见图4。另外两组血脂(总胆固醇、三酰甘油)也明显改善。

图3 MT组和IVCY-AZA组6月(A)和24月(B)累积完全缓解率比较(Kaplan-Meier法)

表2 MMF和FK506剂量及血药浓度
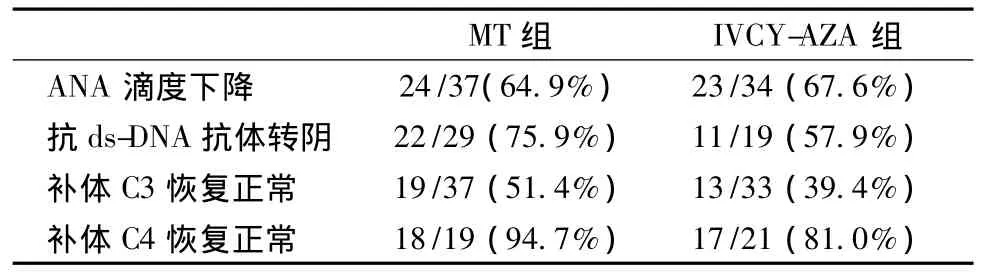
表3 诱导治疗6月后免疫指标变化
复发 本项研究中共57例患者进入维持期(MT组36例,IVCY-AZA组21例),MT组肾脏复发3例,肾外复发2例,IVCY-AZA组分别为1例、3例。两组总复发率(肾脏复发+肾外复发)分别为13.9%和19.0%(P >0.05),无统计学差异。两组肾脏复发均为蛋白尿性,均发生于免疫抑制剂减量或切换维持治疗后3月内(两组肾脏复发时间分别为16,11,11月和12月),予免疫抑制剂或激素加量后均再次获得缓解。两组24月肾脏无复发生存率无统计学差异(图5)。
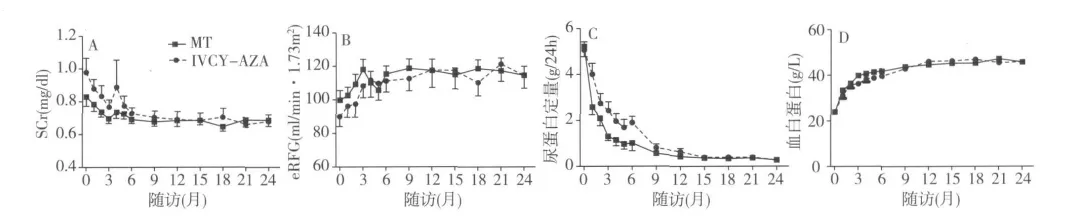
图4 MT组和IVCY-AZA组SCr,eGFR,尿蛋白定量及血白蛋白重复测量数据分析
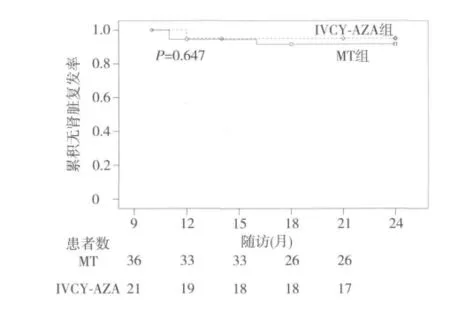
图5 肾脏无复发曲线
不良反应 本研究中无死亡病例。诱导期MT组有2例(1例肺炎、1例癫痫伴SCr倍增),IVCYAZA组有4例因不良反应(2例肺炎、2例肝酶异常)退出。两组感染发生率均为22.5%。IVCY-AZA组诱导期间脱发(17.5%vs2.5%,P=0.023)、恶心呕吐发生率(22.5%vs5.0%,P=0.025),显著高于MT组,MT组高血压发生率15%,IVCY-AZA组无新发高血压(P=0.026)。IVCY-AZA组诱导及维持期血WBC减低的发生率均高于MT组,但均无统计学差异(表4,5)。
讨 论
Ⅳ+Ⅴ型LN对传统免疫抑制剂治疗反应差[3,4]、预后不良[12],本研究所应用激素联合 MMF及FK506(多靶点疗法)提高此型缓解率,以改善远期预后。前期小样本对照研究初步证实MT治疗Ⅳ+Ⅴ型LN的6月完全缓解率显著高于IVCY疗法(50%vs 5%)[5],本研究在前期临床试验的基础上增加入组患者、延长随访时间,不仅验证了MT的诱导疗效(MT和IVCY疗法6月完全缓解率,45%vs 12.5%);也是首次将此疗法在诱导后继续用于维持,开创了LN的新型序贯疗法,即连续MT诱导-维持治疗。MT治疗Ⅳ+Ⅴ型LN两年完全缓解率达80%,显著优于IVCY-AZA组,肾功能得以改善,两种治疗方案两年复发率相似,MT诱导及维持期均无严重不良反应发生,患者耐受性良好。

表4 MT组和IVCY-AZA组诱导期不良反应
既往研究以Ⅳ+Ⅴ型LN为研究对象的很少,伴有膜性病变的Ⅳ型LN通常和单纯Ⅳ型LN统称为弥漫增生型狼疮性肾炎(diffused proliferative lupus nephritis,DPLN)作为研究对象。然而,Ⅳ型和Ⅳ+Ⅴ型LN的短期疗效以及远期预后差别显著。本中心研究表明[3,4],MMF、FK506、CTX等免疫抑制剂单独治疗IV型LN的6月完全缓解率达40%~60%,然而将其治疗Ⅳ+Ⅴ型LN,6月完全缓解率仅20%~30%,其中以IVCY疗法最低,6月完全缓解率低于10%。其他研究也发现类似结果,Chan等[13]发现,CTX诱导AZA维持治疗Ⅳ型LN 12月完全缓解率77%,而Ⅳ+Ⅴ型LN仅14%。快速、充分地诱导缓解是治疗LN的首要任务,较部分缓解而言,完全缓解的预后意义更大,Illei等[14]对DPLN患者随访10年发现,部分缓解患者复发及进展至ESRD风险明显高于完全缓解者,Chan等[15]发现部分缓解患者病情复发风险是完全缓解者的6.2倍。MT对于Ⅳ+Ⅴ型LN显著的诱导疗效突出表现在提高完全缓解率(6月完全缓解率近50%),因此初期治疗保证诱导疗效的同时,对减少复发、改善预后也有一定作用。
LN病程迁延,具有反复复发-缓解特性,目前治疗LN的金标准除了快速、充分地诱导缓解外,还包括维持缓解、减少复发,以及保护肾功能、减少不良反应,提高远期人肾存活率。研究报道肾脏复发率为27%~66%[16],各研究的复发率不一致可能与病情严重程度、治疗方案、随访时间以及复发的定义等方面的异质性有关。肾脏复发不仅带来新的免疫炎症或瘢痕、加重肾脏损害,也因加强免疫抑制治疗而增加不良反应。很多预后分析均证实肾脏复发是SCr倍增或 ESRD 的危险因素[17,18],其中反复复发、肾炎性复发、早期蛋白尿复发SCr倍增率明显增加[18,19],长期免疫抑制剂维持能有效降低复发率[17,20],改善远期预后。目前维持方案包括每3月1次IVCY冲击,MMF以及AZA。CTX的不良反应存在时间、剂量依赖性,长期使用不良反应明显,其维持治疗难以推广;2000年以来随机对照试验证实应用MMF和AZA维持,对于减少复发、降低死亡或肾衰竭发生率以及不良反应方面均优于IVCY维持[21-23]。最新 ALMS 试验维持期结果显示[24]:随访3年,MMF维持治疗较AZA更能有效地减少终点事件的发生(定义为治疗失败,包括死亡、ESRD、SCr倍增、复发、补救治疗,16.4%vs 32.4%)、减少不良反应,其中 MMF较 AZA显著降低复发率(12.9%vs 23.4%)。以上维持方案目前广泛应用于临床,但最佳维持药物、及最佳维持疗程有待深入研究。本研究首次将MT用作维持治疗,MT组和IVCY-AZA组两年肾脏病复发率均低于10%,其中IVCY-AZA 组仅 4.8%,国外 Contreras等[21]采用IVCY诱导AZA维持治疗19例DPLN,随访30月复发率高达31%,其治疗方案和随访时间与本研究IVCY-AZA组相仿,但研究对象主要为黑人及西班牙人,并且维持治疗的标准相对宽松,维持治疗前平均蛋白尿1.3 g/d,其中3例维持治疗前存在肾病范围蛋白尿。本研究维持开始时患者病情较轻,两组均有一半以上患者为完全缓解,平均蛋白尿仅0.6 g/d。严格控制维持治疗标准,对于减少复发率可能起到一定作用,MT对复发的影响仍需大样本、长期随访观察。
激素联合MMF或FK506治疗,已相当广泛地应用于LN。但是不同研究给药剂量差异很大,最佳治疗剂量还有待进一步研究。ALMS研究诱导期和维持期 MMF 的靶剂量分别为 3 g/d、2 g/d[24,25]。在Contreras研究中,MMF以1.5 g/d维持,MAINTAIN 试验中MMF以2 g/d维持。关于FK506治疗LN的研究相对少[26],用量 0.1~ 0.2mg/(kg·d)。本研究采用MMF和FK506联合给药,诱导和维持剂量均较低。小剂量、联合治疗,在保证疗效的同时,减少了不良反应的发生。
两组肾功能在两年内均得到有效保护:SCr和eGFR随时间显著改善。一方面和免疫抑制剂治疗有关,另一方面本研究入组患者基线慢性化病变程度较轻,表现在基线CI评分低(两组平均CI分别为1.4,1.7),基线 SCr升高患者较少(15%)。需要注意的是,IVCY-AZA组中相当一部分无效患者在6月时退出研究,而无效患者肾功损害风险明显增加[27]。另外,本研究随访时间相对短,而硬性终点事件如死亡、ESRD、SCr倍增等通常在随访5年后出现。
不良反应主要发生于诱导期,MT组没有因免疫抑制药物联合应用而增加感染率。严重脱发、恶心呕吐在IVCY诱导时更多见,与既往研究报道一致。多靶点组特殊的不良反应是高血压(15%)。由于两组患者激素用量相同,高血压的发生与FK506应用有关,是FK506最主要的不良反应。有研究报道[28],应用MMF和FK506联合治疗7例对MMF治疗无效的LN,随访16月,因FK506不良反应而终止治疗的发生率达57%,包括糖尿病、肌痛、肌痉挛、肺炎等,然而此项研究样本量较小,仅7例患者,MMF(平均剂量2.8 g/d)及FK506剂量(平均剂量3.4mg/d)偏高,而且在加用FK506治疗前,患者已接受长期激素及MMF治疗,较高的不良反应发生率可能与以上因素有关。本研究中不良反应发生率低,与监测MMF和FK506血药浓度并以此调整剂量有关,既往研究表明 MPA-AUC0~12h>40mg·h/L,不良反应明显增加[29]。应用 FK506 长期治疗,需考虑钙调神经蛋白酶抑制剂(Calcineurin inhibitor,CNI)导致的肾毒性,本研究MT组重复测量数据的混合模型分析显示SCr随时间变化显著减低及eGFR随时间显著升高,67%患者末次随访SCr较基线减低,且无一例最后随访 SCr超过基线50%。
小结:多靶点疗法治疗Ⅳ+Ⅴ型LN不仅可以显著提高缓解率、而且能有效预防复发、保护肾功能。本研究观察的病例随访相对短,仅纳入了Ⅳ+Ⅴ型LN。多靶点疗法的最佳疗程、对远期预后的意义,以及对不同类型LN的疗效仍需进一步探讨。
1 胡伟新,陈惠萍,唐政,等.霉酚酸酯与间断环磷酰胺冲击疗法治疗Ⅳ型狼疮性肾炎疗效的比较.肾脏病与透析肾移植杂志,2000,9(1):3-8.
2 章海涛,胡伟新,谢红浪,等.普乐可复与环磷酰胺诱导治疗Ⅳ型狼疮性肾炎的疗效比较.肾脏病与透析肾移植杂志,2006,15(6):501-507.
3 刘春蓓,胡伟新,谢红浪,等.霉酚酸酯与环磷酰胺治疗Ⅳ型伴Ⅴ型狼疮性肾炎的疗效比较.肾脏病与透析肾移植杂志,2006,15(1):1-6.
4 章海涛,胡伟新,谢红浪,等.前瞻性比较普乐可复与环磷酰胺诱导治疗Ⅴ型伴Ⅳ型狼疮性肾炎的疗效.肾脏病与透析肾移植杂志,2006,15(6):508-514.
5 Bao H,Liu ZH,Xie HL,et al.Successful treatment of class V+IV lupus nephritis with multitarget therapy.J Am Soc Nephrol,2008,17(10):2001-2010.
6 鲍 浩,刘志红,胡伟新,等.多靶点诱导治疗增殖性和膜性狼疮性肾炎前瞻对照性临床研究.肾脏病与透析肾移植杂志,2009,18(3):201-206,225.
7 胡伟新,陈樱花,刘正钊,等.激素联合赛可平和他克莫司治疗狼疮性肾炎的前瞻性临床研究.肾脏病与透析肾移植杂志,2011,20(4):301-306.
8 Gladman DD,Ibañez D,Urowitz MB.Systemic lupus erythematosus disease activity index 2000.J Rheumatol,2002,29(2):288-291.
9 Weening JJ,D'Agati VD,Schwartz MM,et al.The classification of glomerulonephritis in systemic lupus erythematosus revisited.J Am Soc Nephrol,2004,15(2):241-250.
10 Austin HA,3rd,Muenz LR,Joyce KM,et al.Diffuse proliferative lupus nephritis:identification of specific pathologic features affecting renal outcome.Kidney Int,1984,25(4):689-695.
11 Shaw LM,A Nicholls,M Hale,et al.Therapeutic monitoring of mycophenolic acid.A consensus panel report.Clin Biochem,1998,31(5):317-322.
12 孙海鸥,胡伟新,谢红浪,等.弥漫增生型狼疮性肾炎的远期预后.肾脏病与透析肾移植杂志,2008,17(3):216-223.
13 Chan TM,Li FK,Wong RW,et al.Sequential therapy for diffuse proliferative and membranous lupus nephritis:cyclophosphamide and prednisolone followed by azathioprine and prednisolone.Nephron,1995,71(3):321-327.
14 Illei GG,Takada K,Parkin D,et al.Renal flares are common in patients with severe proliferative lupus nephritis treated with pulse immunosuppressive therapy:long-term followup of a cohort of 145 patients participating in randomized controlled studies.Arthritis Rheum,2002,46(4):995-1002.
15 Chan TM,Tse KC,Tang CS,et al.Long-term outcome of patients with diffuse proliferative lupus nephritis treated with prednisolone and oral cyclophosphamide followed by azathioprine.Lupus,2005,14(4):265-272.
16 Sidiropoulos PI,HD Kritikos,Boumpas DT.Lupus nephritis flares.Lupus,2005,14(1):49-52.
17 Mok CC,Ying KY,Tang S,et al.Predictors and outcome of renal flares after successful cyclophosphamide treatment for diffuse proliferative lupus glomerulonephritis.Arthritis Rheum,2004,50(8):2559-2568.
18 Mosca M,W Bencivelli,Neri R,et al.Renal flares in 91 SLE patients with diffuse proliferative glomerulonephritis.Kidney Int,2002,61(4):1502-1509.
19 Moroni G,Quaglini S,Maccario M,et al.“Nephritic flares”are predictors of bad long-term renal outcome in lupus nephritis.Kidney Int,1996,50(6):2047-2053.
20 Boumpas DT,Austin HA 3rd,Vaughn EM,et al.Controlled trial of pulse methylprednisolone versus two regimens of pulse cyclophosphamide in severe lupus nephritis.Lancet,1992,340(8822):741-745.
21 Contreras G,Pardo V,Leclercq B,et al.Sequential therapies for proliferative lupus nephritis. N Engl J Med, 2004, 350(10):971-980.
22 Houssiau FA,D'Cruz D,Sangle S,et al.Azathioprine versus mycophenolate mofetil for long-term immunosuppression in lupus nephritis:results from the MAINTAIN Nephritis Trial.Ann Rheum Dis,2010,69(12):2083-2089.
23 Chan TM,Tse KC,Tang CS,et al.Long-term study of mycophenolate mofetil as continuous induction and maintenance treatment for diffuse proliferative lupus nephritis. J Am Soc Nephrol,2005,16(4):1076-1084.
24 Dooley MA,Jayne D,Ginzler EM,et al.Mycophenolate versus azathioprine as maintenance therapy for lupus nephritis.N Engl JMed,2011,365(20):1886-1895.
25 Appel GB,Contreras G,Dooley MA,et al.Mycophenolate mofetil versus cyclophosphamide for induction treatment of lupus nephritis.J Am Soc Nephrol,2009,20(5):1103-1112.
26 Lee YH,Lee HS,Choi SJ,et al.Efficacy and safety of tacrolimus therapy for lupus nephritis:a systematic review of clinical trials.Lupus,2011,20(6):636-640.
27 Korbet SM,Lewis EJ,Schwartz MM,et al.Factors predictive of outcome in severe lupus nephritis.Lupus Nephritis Collaborative Study Group.Am J Kidney Dis,2000,35(5):904-914.
28 Lanata CM,T Mahmood,Fine DM,et al.Combination therapy of mycophenolate mofetil and tacrolimus in lupus nephritis.Lupus,2010,19(8):935-940.
29 谢红浪,胡伟新,章海涛,等.霉酚酸酯治疗狼疮性肾炎的血药浓度与不良反应的联系.肾脏病与透析肾移植杂志,2007,16(5):414-420.
