芦笋老茎澄清汁对链脲佐菌素致糖尿病大鼠降糖作用的研究
2012-11-24赵旌旌赵洪军王洁琼瞿伟菁
赵旌旌,赵洪军,赵 頔,王洁琼,瞿伟菁
华东师范大学生命科学学院,上海200062
芦笋老茎澄清汁对链脲佐菌素致糖尿病大鼠降糖作用的研究
赵旌旌,赵洪军,赵 頔,王洁琼,瞿伟菁*
华东师范大学生命科学学院,上海200062
本文评价了芦笋老茎澄清汁(CAJ)的降血糖作用,并对其降血糖机制进行了初步探讨。腹腔注射STZ制备类似1型糖尿病大鼠模型,以0.6,1.2和2.0 g/kg体重剂量的CAJ连续灌胃21 d,监测血糖,测定糖化血清蛋白、血清胰岛素、肝糖原、脂代谢及抗氧化系统部分相关指标。结果显示,CAJ可明显降低糖尿病大鼠血清中葡萄糖、糖化血清蛋白、总胆固醇和MDA含量,并显著提高受试模型鼠的血清胰岛素水平、肝糖原含量、血清SOD活性、肝脏SOD、GSH-Px和CAT的活性。上述结果表明CAJ可明显降低糖尿病大鼠的血糖水平,刺激胰岛素分泌,调节血脂,增强抗氧化能力。
芦笋老茎澄清汁(CAJ);链脲佐菌素;糖尿病大鼠;降血糖作用
芦笋(Asparagus officinalis L.),学名石刁柏,百合科天门冬属多年生宿根性草本植物,是一种品味兼优、药食兼用的营养保健名贵蔬菜。因其含有黄酮、多糖、皂苷和氨基酸[1]等多种活性物质,故除食用外,芦笋还具有多种生物学活性,如:抗氧化[2]、抗肿瘤[3]和降血脂[4]。上述活性研究均围绕芦笋可食部分嫩茎展开,对于收割和加工过程中弃掉的约占原料35%的老茎关注甚少。有文献报道,老茎中含有约50%的原汁[5],本课题组前期研究确立了芦笋老茎汁的最佳澄清工艺[6],发现经该工艺获得的老茎澄清汁(clarified asparagus juice,CAJ)含有活性成分黄酮、多酚、皂苷和多糖[6,7],在体外实验中可明显清除羟基自由基和亚硝酸盐、抑制结肠癌细胞的增殖、并能有效抑制а-葡萄糖苷酶活性[7]。在此基础上,本文进一步研究了CAJ对STZ诱导的糖尿病大鼠血糖和血脂代谢的影响。
1 材料与方法
1.1 材料与仪器
1.1.1 芦笋澄清汁的制备[6]
取芦笋弃料(老茎)洗净晾干,杀青,置于榨汁机中压榨取汁,用ZTC1+1澄清剂澄清处理后,滤纸过滤,获取老茎澄清汁(CAJ),减压浓缩后冷冻干燥,保存备用。
1.1.2 动物
雄性Wistar大鼠,体重190~210 g,购自上海西普尔-必凯实验动物公司,实验动物合格证号:SCXK(沪)2007-0016。
1.1.3 药品与试剂
链脲佐菌素(Streptozocin,STZ,Sigma公司);格列苯脲(Glibenclamide,北京太洋药业有限公司,批号:050503);血糖试纸条及血糖仪(美国雅培公司);其他试剂均为国产分析纯。血清葡萄糖(serum glucose,Glu)、血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、碱性磷酸酶(Alkaline phosphatase,ALP)、谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspartate aminotransferase,AST)试剂盒,购自上海科欣生物技术研究所;超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-PX)、丙二醛(Malonyldiadehyde,MDA)、总抗氧化能力(Total antioxidant capacity,T-AOC)、肝糖原(Glycogen)、糖化血清蛋白(glycosylated serum protein,GSP)、肝脏已糖激酶(Hexokinase)测定试剂盒,购自南京建成生物工程研究所;蛋白测定试剂盒,购自碧云天生物技术研究所。
1.1.4 仪器
梅特勒-托利多B-L系列电子天平(梅特勒-托利多仪器有限公司),TL-16R台式高速冷冻离心机(上海市离心机械研究所),T6新世纪紫外可见分光光度计(北京普析通用有限公司),DK-S24型电热恒温水浴锅(上海精宏实验设备有限公司),XW-80A涡旋混合器(上海医科大学仪器厂)等。
1.2 方法
1.2.1 STZ诱导的糖尿病大鼠模型的制备
正常雄性Wistar大鼠适应性饲养5 d,禁食12 h后,随机分出14只作为正常对照组(Normal control),其余大鼠根据预试验结果腹腔注射47 mg/kg B.W.剂量STZ(以0.1 mol/L,pH 4.6柠檬酸缓冲液配制,灭菌),正常对照组注射等体积缓冲液。注射STZ将引起胰岛素应激性的大量分泌,引发致命的低血糖效应,因此注射后的24 h需向大鼠补充3%的葡萄糖水溶液。注射后5 d,大鼠禁食8 h,尾静脉采血,分离血清,测定空腹血清葡萄糖含量,血糖值大于10.0 mmol/L的大鼠选为类似1型糖尿病大鼠。
1.2.2 分组与降糖实验
试验共分6组,除正常对照组外,糖尿病大鼠随机分为5组,每组14只,分别为:模型对照组(Diabetic control),格列苯脲组(Glibenclamide,Glib)、CAJ高、中、低剂量组。格列苯脲组大鼠按20 mg/ (kg B.W.·d)剂量灌胃给予(ig)格列苯脲;CAJ低、中、高剂量治疗组分别按0.6 g/(kg B.W.·d)、1.2 g/(kg B.W.·d)和2.0 g/(kg B.W.·d)剂量ig CAJ;正常对照组和模型对照组ig等体积蒸馏水,连续21 d。每周测定空腹血清葡萄糖含量;21 d时,各组动物禁食8 h,取血并处死,分离血清,取出肝脏用4℃生理盐水冲洗,吸干多余水分。指标测定前,所有样品保存于-70℃。
1.2.3 生化指标测定
血清中Glu、TC、TG、GSP含量,ALT、AST、ALP活性,肝脏已糖激酶活性按试剂盒说明书方法测定;血清Ins含量采用放射免疫法测定,由复旦大学放射医学研究所测定;采用糖原测定试剂盒测定肝糖原含量,操作步骤及计算方法按试剂盒说明书进行。
1.2.4 抗氧化指标测定
血清及肝脏SOD活性、MDA含量、肝脏CAT、TAOC、GSH-PX活性测定按试剂盒说明书方法进行,组织蛋白含量按BCA蛋白浓度测定试剂盒(增强型)方法测定。
1.3 数据分析

表1 CAJ对STZ诱导的糖尿病大鼠空腹血糖水平的影响Table 1 Effect of CAJ on fasting serum glucose level in STZ-induced diabetic rats

aP<0.05,aaP<0.01与糖尿病模型对照组相比,下同。aP<0.05,aaP<0.01 compared with diabetic control.The same below.
2 结果
2.1 CAJ对STZ诱导的糖尿病大鼠血糖水平的影响
表1数据显示:腹腔注射STZ诱导糖尿病模型后,大鼠空腹血糖水平极显著高于正常对照组(P<0.01)。灌胃14 d及21 d时,模型组大鼠处于持续高血糖状态,而与之相比,CAJ低剂量(0.6 g/kg)、中剂量(1.2 g/kg)及阳性药物格列苯脲(20 mg/kg)均显著降低糖尿病大鼠的血糖水平(P<0.05),14 d时降糖率依次为38.00%,29.38%和39.38%,21 d时分别为37.02%,36.60%和39.64%,但CAJ高剂量组与对照相比差异不明显(P>0.05)。经统计学分析,给药7、14和21 d时CAJ 3个剂量组血糖无显著差异(P>0.05),提示CAJ具有一定的降血糖作用,但无剂量相关性。
2.2 CAJ对STZ诱导的糖尿病大鼠糖基化血清蛋白、血清胰岛素、肝糖原含量及肝脏己糖激酶活性的影响
如表2数据所示:与正常对照组相比,糖尿病模型大鼠的GSP极显著升高(P<0.01);而血清Ins和肝糖原水平极显著降低(P<0.01),已糖激酶活性显著降低(P<0.05)。连续给予0.6和1.2 g/kg的CAJ 21 d可明显降低糖尿病大鼠的GSP水平(P<0.01),增加肝糖原含量(P<0.05),2.0 g/kg的CAJ作用不明显(P>0.05);1.2 g/kg CAJ可明显提升糖尿病大鼠的血清胰岛素水平和肝脏已糖激酶活性(P<0.05),而0.6和2.0 g/kg的CAJ作用不明显(P>0.05)。经统计学分析,CAJ 3个剂量组的糖化血清蛋白、血清胰岛素、肝糖原和肝脏己糖激酶均无明显差异,无剂量相关性。
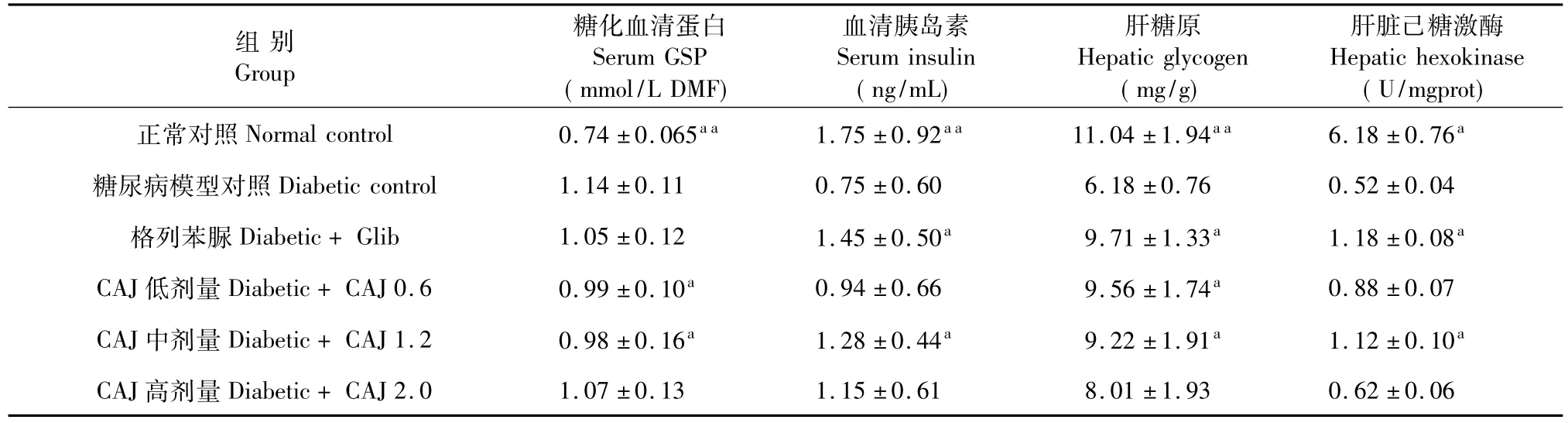
表2 CAJ对STZ诱导的糖尿病大鼠糖基化血清蛋白、血清胰岛素、肝糖原含量及肝脏己糖激酶活性的影响Table 2 Effect of CAJ on levels of serum GSP,insulin,hepatic glycogen and activity of hepatic hexokinase in STZ-induced diabetic rats
2.3 CAJ对STZ诱导的糖尿病大鼠血脂及体重水平的影响
表3数据显示:与正常组相比,模型对照组大鼠体重极显著降低而血清TC水平极显著升高(P<0.01)。与模型对照组相比,给予0.6和1.2 g/kg的CAJ 21 d可明显增加糖尿病大鼠的体重(P<0.01,P<0.05);1.2 g/kg CAJ还能极显著降低糖尿病大鼠的血清TC水平(P<0.01),而CAJ 3个剂量组间的血清TC水平无明显差异(P>0.05)。

表3 CAJ对STZ诱导的糖尿病大鼠体重、血清甘油三酯和总胆固醇水平的影响Table 3 Effect of CAJ on body weight,serum TG and TC levels in STZ-induced diabetic rats

糖尿病模型对照Diabetic control 248.20±18.68 234.87±18.01 1.34±0.45 1.54±0.21格列苯脲Diabetic+Glib 248.93±14.65 274.86±21.22aa 1.55±0.38 1.43±0.16 CAJ低剂量Diabetic+CAJ 0.6 247.29±15.34 277.38±19.62aa 1.34±0.63 1.40±0.18 CAJ中剂量Diabetic+CAJ 1.2 246.86±22.81 258.86±22.16a 1.16±0.56 1.30±0.12aa CAJ高剂量Diabetic+CAJ 2.0 249.79±13.70 254.69±23.45 1.39±0.57 1.46±0.22
2.4 CAJ对STZ诱导的糖尿病大鼠血清ALP、ALT和AST活性的影响
与正常对照组相比,糖尿病对照组大鼠血清ALP、ALT及 AST活性极显著升高(如表4,P<0.01),提示模型大鼠肝脏受损,连续给予0.6和 1.2 g/kg的CAJ 21 d可明显降低糖尿病大鼠血清ALP活性(P<0.01,P<0.05),使之趋向正常水平;同时0.6 g/kg CAJ还能显著降低糖尿病大鼠的血清ALT水平(P<0.05);CAJ各剂量对模型大鼠血清AST活性影响不明显(P>0.05)。
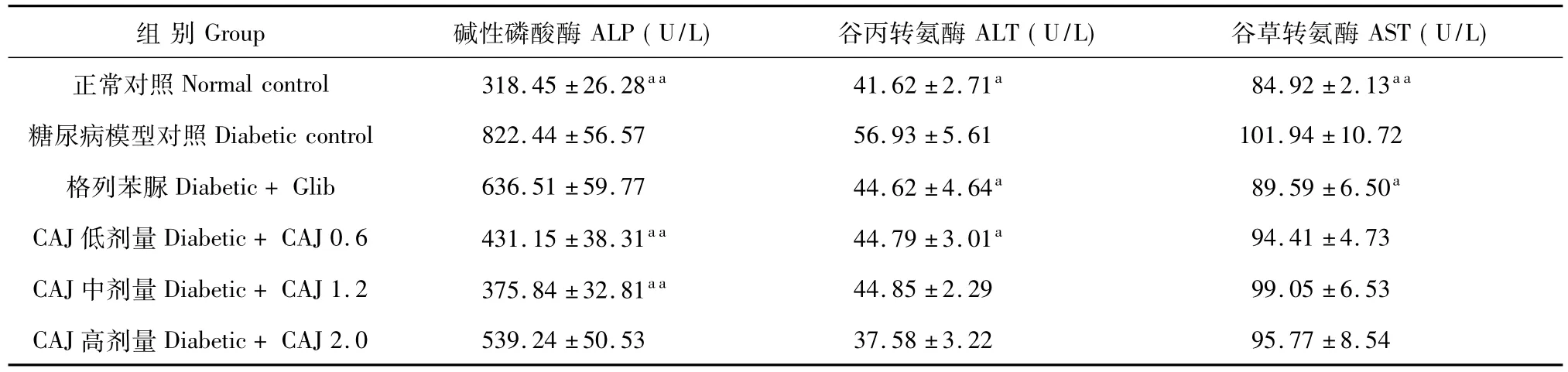
表4 CAJ对STZ诱导的糖尿病大鼠血清ALP、ALT和AST活性的影响Table 4 Effect of CAJ on activities of serum ALP,ALT and AST in STZ-induced diabetic rats
2.5 TMP对STZ诱导的糖尿病大鼠抗氧化能力的影响
表5结果显示:与正常大鼠相比,糖尿病模型对照组大鼠血清和肝脏的抗氧化酶SOD,CAT和GSHPx活性明显降低(P<0.05或P<0.01),而血清MDA含量显著升高(P<0.05),表明STZ诱导的糖尿病模型具有明显的氧化损伤。连续给予0.6 g/kg CAJ 21d可显著增加糖尿病大鼠血清 SOD(P<0.05)和肝脏CAT和GSH-Px活性(P<0.01),并能明显降低血清MDA含量(P<0.05);1.2 g/kg CAJ可明显增强糖尿病大鼠血清SOD,肝脏SOD,CAT和GSH-Px活性(P<0.05或P<0.01),并能显著降低血清MDA含量(P<0.05)。
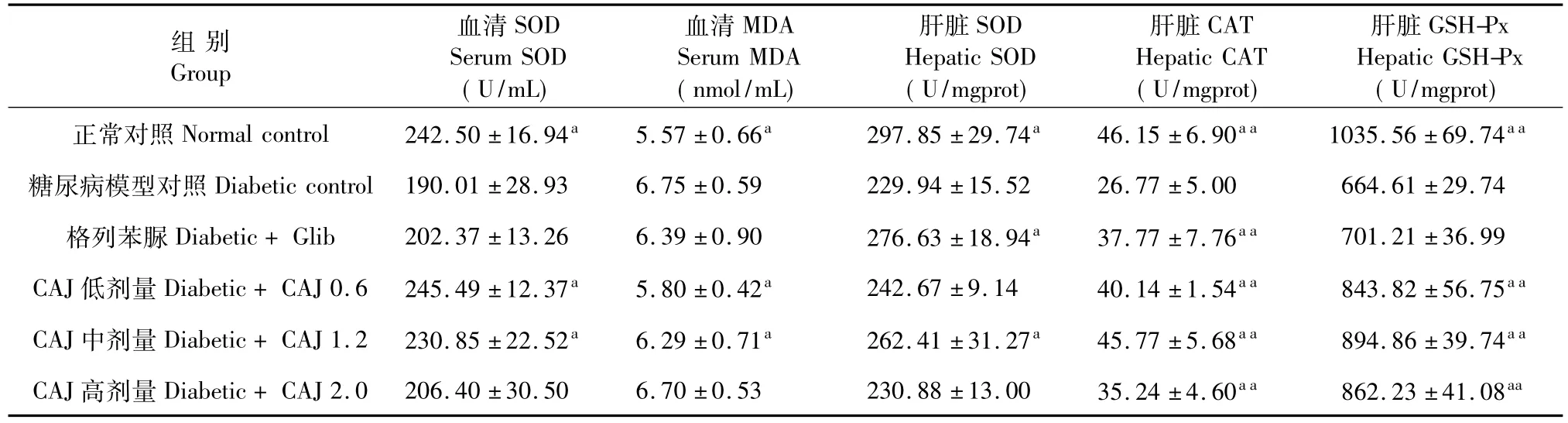
表5 CAJ对STZ诱导的糖尿病大鼠血清和肝脏部分抗氧化指标的影响Table 5 Effect of CAJ on antioxidant parameters in serum and liver of STZ-induced diabetic rats
3 讨论
STZ诱导的类似1型糖尿病动物模型是常见的评价降血糖药物的模型,该模型具有高血糖、胰岛素缺乏的症状;同时,由于胰岛素缺乏,脂解作用上升,有时甘油三酯和总胆固醇也会出现升高[8]。采用这一模型,本文研究了CAJ对类似1型糖尿病大鼠的影响。结果显示:通过口服途径,CAJ可有效降低类似1型糖尿病大鼠空腹血清葡萄糖和糖化血清蛋白水平,表现出显著的降血糖活性。糖化血清蛋白(GSP)是血液中葡萄糖与白蛋白及其它蛋白质分子末端的氨基发生非酶促糖化反应形成的具有酮胺键的糖化蛋白,可反映最近2~3周内的平均血糖水平,而和采血时的血糖浓度并不相关[9],本研究结果表明0.6和1.2 mg/kg CAJ在1型糖尿病动物模型上的降糖作用是持续稳定的。高血糖是糖尿病的核心症状[10],目前,糖尿病治疗的最主要目标还是有效控制血糖水平,0.6和1.2 mg/kg CAJ可明显抑制糖尿病大鼠血糖水平的上升,提示其可能对糖尿病的发展有一定的控制作用。
本研究中,1.2 mg/kg CAJ使类似1型糖尿病大鼠的血清胰岛素水平明显上升(P<0.05),提示CAJ可刺激大鼠胰岛素分泌,其降血糖作用可能通过刺激胰岛素分泌这一途径来实现。
肝脏糖原的分解与合成途径也是血糖水平的一个重要调节点。在糖尿病的状态下,肝脏合成糖原的能力减弱[11]。有研究显示STZ诱导的糖尿病大鼠肝糖原含量显著低于正常大鼠[12]。本研究中,模型大鼠肝糖原含量显著低于正常大鼠,而0.6和1.2 mg/kg CAJ可明显增加模型大鼠的肝糖原含量,提示CAJ可能通过刺激葡萄糖的外周组织利用来调节糖尿病大鼠的血糖水平,具体机制有待进一步研究。
活性氧自由基导致胰岛β细胞氧化损伤是STZ引发高血糖的重要原因,氧化损伤也会导致糖尿病并发症的发生与发展[13],由于抗氧化系统与自由基和氧化损伤密切相关,本文观测了CAJ对高血糖状态下的糖尿病大鼠部分氧化酶活性及MDA含量的影响。结果显示:0.6和1.2 mg/kg CAJ可增强模型大鼠降低的血清和肝脏SOD活性、肝脏CAT和GPx活性;降低血清中MDA含量,提示CAJ可能通过提高SOD、CAT和GSH-Px的活性来抑制脂质过氧化的产生,从而缓解STZ对胰岛β细胞的氧化损伤,或通过促进已损伤的β-细胞修复来增强胰岛素的分泌,从而缓解血糖升高。
本研究结果显示:所设定的CAJ三个剂量0.6、1.2 mg/kg和2.0 mg/kg并无显著的剂量依赖性,其中1.2 mg/kg CAJ在降糖、降胆固醇活性、刺激胰岛素分泌和增加肝糖原含量方面作用明显,是最佳剂量,而高剂量2.0 mg/kg CAJ的作用不明显。推测这一结果可能是由于CAJ是混合物,其中的一些成分影响了降糖活性成分的吸收与代谢所致。
有研究表明,STZ对高血糖大鼠肝脏产生毒性,导致存在于肝细胞内的AST、ALT、ALP等进入血液[14]。但也有学者指出,这类参与糖异生作用的酶,活性受胰岛素抑制,故其活性变化不仅反映肝脏损伤,也反映胰岛素信号的强弱[15]。本研究中,与正常大鼠相比,模型大鼠血清AST、ALT和ALP活性显著升高,可能由STZ造成的肝脏损伤引发,口服CAJ后,血清ALT和ALP活性显著下降,推测CAJ可能通过促进胰岛素分泌来抑制ALT和ALP的活性,也可能通过提高机体抗氧化保护酶活性、抑制脂质过氧化来缓解STZ对肝脏细胞的氧化损伤,从而减少了ALT和ALP进入血液,使之活性降低。
综合上述结果,CAJ可能通过刺激胰岛素分泌、增加外周组织对糖的利用以及增强抗氧化能力的途径来降低STZ诱导的类似1型糖尿病模型动物的血糖水平,其降血糖作用的分子机制还需进一步研究。
1 Zhou LH(周利亘),Wang CH(王春辉),Wang JH(王君虹),et al.Study progress on the bioactive components and biological function of Asparagus officinalis.Anhui Agric Sci Bull(安徽农学通报),2006,12:23-25.
2 Rodriguez R,Jaramillo S,Rodriguez G,et al.Antioxidant activity of ethanolic extracts from several asparagus cultivars.J Agric Food Chem,2005,53:5212-5217.
3 Jang DS,Cuendet M,Fong HH,et al.Constituents of Asparagus officinalis evaluated for inhibitory activity against cyclooxygenase-2.J Agric Food Chem,2004,52:2218-2222.
4 Mei HS(梅慧生),Wu YQMG(乌云其木格),Wu ZY(吴仲燕).The effects by eating asparagus spears on blood lipid levels of human body.Acta Sci Nat Univ Pek(北京大学学报,自科版),1990,26:369-373.
5 Zhang SH(张素华).Studies on asparagus juice processing and preparation of asparagus healthy drink.Food Ind(食品工业),2002,6:41-43.
6 Zhu D(朱丹),Zhao HJ(赵洪军),Qu WJ(瞿伟菁).Study on the optinum clarifying condition of juice with ZTC1+1-Ⅱ.Food Ferment Ind(食品与发酵工业),2010,36:118-121.
7 Zhao HJ(赵洪军),Zhu D(朱丹),Wang K(王珂),et al.Antioxidation,cytotoxicity and α-glucosidase inhibition activities of asparagus extract in vitro.Nat Prod Res Dev(天然产物研究与开发),2011,23:356-360.
8 Lemhadri A,Hajji L,Michel JB,et al.Cholesterol and triglycerides lowering activities of caraway fruits in normal and streptozotocin diabetic rats.J Ethnopharmacol,2006,106:321-326.
9 Deng SP(邓尚平).Cinical Diabetology(临床糖尿病学).1st Ed.Chengdu:Sichuan Publishing House of Sience&Technology,2000,78.
10 Bell GI.Molecular defects in diabetes mellitus.Diabetes,1991,40:413-417.
11 Whitton PD,Hems DA.Glycogen synthesis in the perfused liver of streptozotocin-diabetic rats.Biochem J,1975,150: 153-165.
12 Eliza J,Daisy P,Ignacimuthu S,et al.Antidiabetic and antilipidemic effect of eremanthin from Costus speciosus(Koen.) Sm.,in STZ-induced diabetic rats.Chem Biol Interact,2009,182:67-72.
13 Baynes JW.Role of oxidative stress in development of complications in diabetes.Diabetes,1991,40:405-412.
14 OhAEOri,OC.Effect of garlic oil on the levels of various enzymes in the serum and tissue of streptozotocin diabetic rats.Biosci Rep,2001,21:19-24.
15 O’Brien RM,Granner DK.Regulation of gene expression by insulin.Biochem J,1991,278:609-619.
Hypoglycemic Activity of Clarified Asparaagus Juice in Streptozotocin Induced Diabetic Rats
ZHAO Jing-jing,ZHAO Hong-jun,ZHAO Di,WANG Jie-qiong,QU Wei-jing*
School of Life Science,East China Normal University,Shanghai 200062,China
The present study was designed to evaluate the hypoglycemic effect of clarified juice of woody stem Asparagus officinalis L.(CAJ)in streptozotocin(STZ)-induced diabetic rats.Diabetes in rats was induced by a single intraperitoneal injection of STZ.0.6,1.2 and 2.0 g/kg body weight CAJ were orally administered to diabetic rats once a day lasting for 21 days.Results showed that administration of CAJ significantly lowered the fasting serum glucose,glycosylated serum protein,total cholesterol and malondialdehyde levels in diabetic rats,but markedly increased serum insulin level,hepatic glycogen content,activities of superoxide dismutase in serum and liver and activities of hepatic glutathione peroxidase and catalase.These results suggested that CAJ might have hypoglycemic,insulin-stimulating,hypotriglyceridemic and antioxidant effects in STZ induced diabetic rats.
clarified asparagus juice(CAJ);streptozotocin;diabetic rats;hypoglycemic activity
1001-6880(2012)04-0460-06
2011-07-18 接受日期:2011-11-15
国家自然科学基金项目(61172149)
*通讯作者 Tel:86-21-62232019;E-mail:wjqu@bio.ecnu.edu.cn
R151.2;Q946.8
A
