低聚壳聚糖与α-丙氨酸/天冬酰胺的美拉德反应及其衍生物的抗氧化性能研究
2012-11-24孙涛,朱云,谢晶,薛斌,毛芳
孙 涛,朱 云,谢 晶,薛 斌,毛 芳
1上海海洋大学食品学院;2上海海洋大学海洋科学研究院,上海201306
低聚壳聚糖与α-丙氨酸/天冬酰胺的美拉德反应及其衍生物的抗氧化性能研究
孙 涛1,2*,朱 云1,谢 晶1,薛 斌1,毛 芳1
1上海海洋大学食品学院;2上海海洋大学海洋科学研究院,上海201306
研究低聚壳聚糖(COS)与α-丙氨酸/天冬酰胺的美拉德反应,考察了两个体系(低聚壳聚糖的羰基与氨基的物质量比均为1∶1)的pH、吸光度和荧光值的变化。醇沉法提取低聚壳聚糖衍生物CA和CN。对两种衍生物进行红外表征和分子量测定,并研究其对超氧阳离子、DPPH自由基的清除能力以及还原能力。结果显示:抗氧化能力强弱次序为CA>CN>COS,即美拉德反应后低聚壳聚糖衍生物抗氧化能力得到显著提高,且CA的抗氧化活性优于CN,表明与小分子氨基酸进行美拉德反应制得的壳聚糖衍生物具有更好的抗氧化性。
低聚壳聚糖;α-丙氨酸;天冬酰胺;美拉德反应;抗氧化性能
美拉德反应是多指发生在食品加工和贮存过程中还原糖的羰基与蛋白质、氨基酸及一些含氮化合物的氨基产生的一系列复杂反应的集合,且产物结构复杂、种类繁多,这与反应温度、时间以及参与反应的氨基酸等有一定的关联[1]。美拉德反应产物含有类黑精、还原酮及一系列含N、S的杂环化合物,这类物质具有一定的抗氧化性能,其抗氧化活性可以与食品中常用的抗氧化剂相当[2]。
低聚壳聚糖的抗氧化作用日益受到广泛关注,低聚壳聚糖可以作为羰基的供应体与氨基酸发生美拉德反应。本文以美拉德反应作为低聚壳聚糖改性的手段,与α-丙氨酸和天冬酰胺反应制得低聚壳聚糖衍生物,监控了反应过程中pH、吸光度以及荧光值的变化,考察了其对、DPPH的清除能力以及还原能力,为拓宽低聚壳聚糖的改性和开发天然高效的抗氧化剂提供了新思路。
1 材料与方法
1.1 原料与试剂
低聚壳聚糖(纯度>90%,脱乙酰度>70%,凝胶色谱测定其分子量为9370 Da),购自浙江金壳生物化学有限公司;鲁米诺,DPPH,购自Sigma公司; α-丙氨酸,天冬酰胺,购自国药集团(沪试);其余试剂均为分析纯,购自上海化学试剂公司;抗氧化测试所需溶液由二次蒸馏水配制。
1.2 主要设备和仪器
WFZ UV2000型紫外分光光度计(上海合利仪器有限公司);970CRT荧光分光光度计(南京昕航科学仪器有限公司);EQUNOX55傅立叶红外-拉曼光谱仪(德国布鲁克公司);Waters 2410型凝胶色谱仪(美国Waters公司);IFFM 2D型流动注射化学发光分析仪(西安瑞迈科技有限公司)。
1.3 低聚壳聚糖衍生物的制备
称取低聚壳聚糖20.0 g两份,加入α-丙氨酸2.61 g/天冬酰胺3.87 g,使得低聚壳聚糖羰基和α-丙氨酸/天冬酰胺的氨基物量比为1∶1。用200 mL的二次蒸馏水溶解,在80℃下回流反应24 h,考察反应过程中pH、吸光度以及荧光值的变化。反复醇沉提取与α-丙氨酸/天冬酰胺反应的低聚壳聚糖衍生物CA和CN,为无味、深褐色粉末,得率分别为12.0%和32.3%。
1.4 测试表征
红外光谱在EQUNOX55傅立叶红外-拉曼光谱仪上进行,采用KBr压片法制样,测定波数范围为500~4000 cm-1,分辨率为0.8 cm-1。
产物的相对平均分子质量及其分布采用GPC法测定。GPC测试条件如下:流动相:0.1 mol/L醋酸钠水溶液;监测器:Waters 2410示差折光监测器;柱子:TOSOH BIOSEP G4000SWXL;温度:40℃;标准物质为:葡聚糖。
1.5 抗氧化性能测定
用pH=10.20的0.05 mol/L Na2CO3-NaHCO3缓冲溶液配制浓度为1.5×10-3mol/L的鲁米诺溶液,用1×10-3mol/L的盐酸配制浓度为0.1 mol/L的邻苯三酚储备液,使用前用去离子水稀释至1× 10-4mol/L。以缓冲液作为溶剂,配制不同浓度的样品溶液。用流动注射化学发光分析仪依次测定从稀到浓的样品溶液,读出峰面积[3]。清除率 =(A0-Ai)/A0×100%。其中A0为空白溶液峰面积;Ai为样品溶液峰面积。经SOD,过氧化氢酶及甘露醇检测,该体系产生的自由基为超氧阴离子。
1.5.2 对DPPH自由基的清除
在比色管中加入2.0 mL的浓度为1×10-4mol/ L DPPH无水乙醇溶液,再加入不同浓度的样品溶液2.0 mL,室温下避光静置半小时,在517 nm处测量吸光度Ai。用去离子水代替样品溶液,得吸光度A0,无水乙醇代替DPPH,得吸光度Aj。清除率=[1-(Ai-Aj)/A0]×100%[4]。
1.5.3 还原能力的测定
pH=6.60的0.2 mol/L磷酸缓冲液和1%铁氰化钾溶液各2.5 mL,加入到2.0 mL不同浓度的样品溶液中,混匀,50℃水浴20 min后迅速冷却,加入2.5 mL 10%三氯乙酸溶液,混匀后在3000 r/min下离心10 min,取上清液2.0 mL,加入2.5 mL去离子水和0.5 mL 0.1%的三氯化铁溶液,静置10 min后在700 nm处测定其吸光度[5]。
2 结果与分析
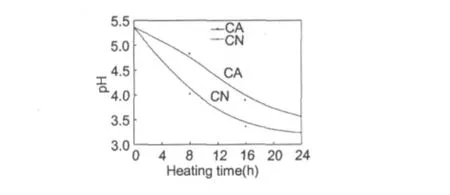
图1 低聚壳聚糖与α-丙氨酸和天冬酰胺美拉德反应过程中pH的变化Fig.1 The pH change of Maillard reaction with α-alanine/ asparagine
2.1 pH值的变化
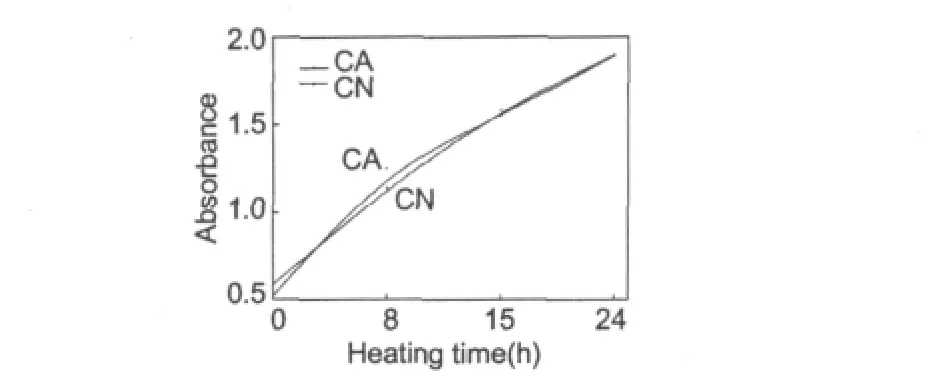
图2 低聚壳聚糖与α-丙氨酸/天冬酰胺美拉德反应过程中在280 nm处的吸光度的变化Fig.2 The UV-Vis absorbance of Maillard reaction with αalanine/asparagine at 280 nm
pH变化影响美拉德反应速率[6]。美拉德反应中一般形成一些有机酸,如甲酸和乙酸[7,8],引起体系pH下降。图1为低聚壳聚糖与α-丙氨酸和天冬酰胺美拉德反应过程中体系pH的变化图。两种反应体系pH值均呈下降趋势,其中低聚壳聚糖与天冬酰胺体系pH值下降较快,这可能是因为反应速率较快,产生了较多的甲酸和乙酸。

图3 低聚壳聚糖与α-丙氨酸/天冬酰胺美拉德反应过程中在420 nm处的吸光度Fig.3 The UV-Vis absorbance of Maillard reaction with αalanine/asparagine at 420 nm
2.2 吸光度的变化
图2、3描述了低聚壳聚糖分别与α-丙氨酸、天冬酰胺反应过程中的紫外-可见吸收光谱在280 nm和420 nm处的吸光度。如图所示,在280 nm处吸收峰有明显增强,表明美拉德反应过程中生成中间产物[9],表明有新的物质生成并不断积累;在420 nm处吸收峰随着反应时间的延长而增强,且与α-丙氨酸反应的体系增幅较大,表明美拉德反应产物增多[9,10]。
在酸性条件下,美拉德反应易发生糖的异构和脱水,产生糠醛类物质[11]。羟甲基糠醛是美拉德反应的标示物,在280 nm左右存在特征吸收峰[12]。紫外-可见吸收在280 nm和420 nm附近的吸收,分别代表美拉德中间产物羟甲基糠醛及褐变物质的量[13],如图所示,美拉德反应过程中褐变物质在不断积累。
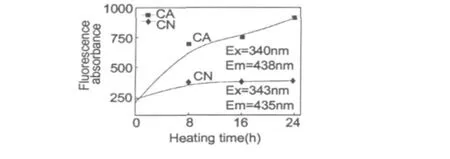
图4 低聚壳聚糖与α-丙氨酸和天冬酰胺美拉德反应的过程中荧光值的变化Fig.4 The fluorescence absorbance of Maillard reaction with α-alanine/asparagine
2.3 荧光值的变化
荧光物质被视为美拉德反应的指示剂,因为它们灵敏地反映了美拉德反应的早期过程,反应后期荧光物质将参与类黑素等大分子的形成,所以随着反应进行,荧光物质的积累会越来越少[14]。
图4描述的是在美拉德反应过程中,低聚壳聚糖与α-丙氨酸体系在340 nm激发波长和438 nm发射波长以及低聚壳聚糖与天冬酰胺体系在343 nm激发波长和435 nm发射波长下的荧光强度。CA体系的荧光强度增强明显,这表明具有荧光性质的美拉德产物的产生和积累;CN体系的荧光强度增强缓慢。这可能由于与α-丙氨酸反应体系荧光强度积累较快所致。
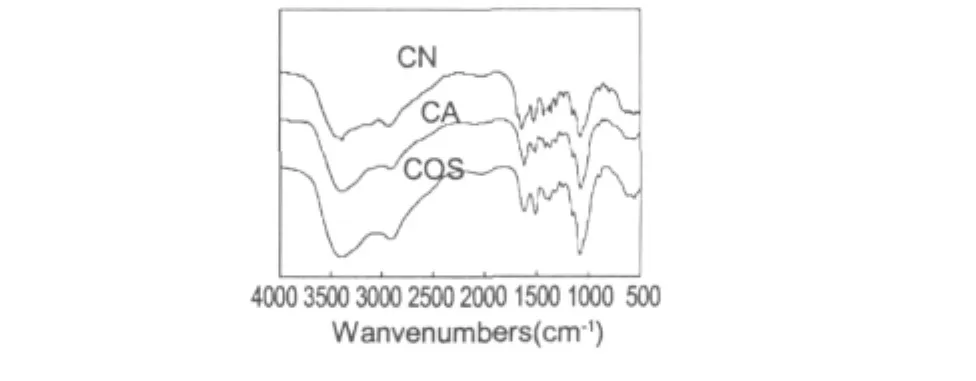
图5 低聚壳聚糖以及两种低聚壳聚糖美拉德衍生物的红外图Fig.5 FTIR spectra of COS,CA and CN
2.4 低聚壳聚糖美拉德产物的结构表征
图5是低聚壳聚糖及其衍生物的红外光谱图。壳聚糖及两种衍生物在1100 cm-1附近都有3个较强的多糖特征吸收峰,分别是895、1085 cm-1以及1155 cm-1,这些吸收峰都来自壳聚糖主链环状结构,可作为判定低聚壳聚糖及其衍生物存在的特征吸收峰[4]。低聚壳聚糖在1621、1515 cm-1和1381 cm-1附近的吸附带,分别归因于酰胺I(C=O)、自由氨基(-NH2)和酰胺Ⅲ[15]。且CA和CN在1621、1515 cm-1和1381 cm-1的峰较低聚壳聚糖有所降低,表明了酰胺I(C=O)、自由氨基(-NH2)和酰胺Ⅲ的改变[16],即低聚壳聚糖在美拉德反应后结构发生了改变。
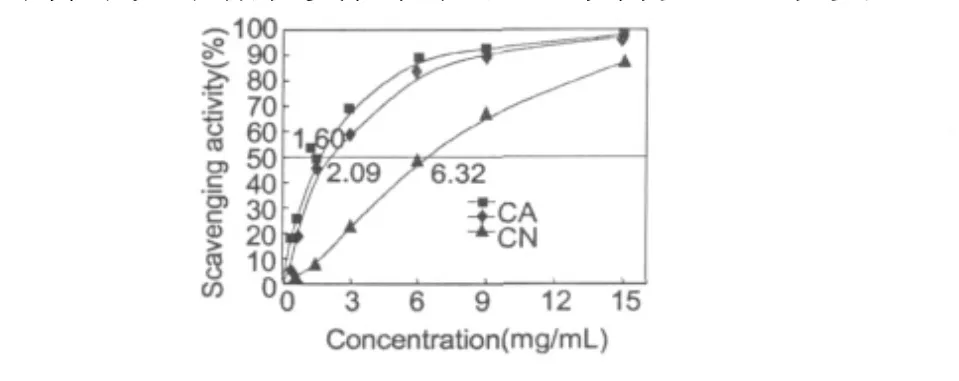
图6 低聚壳聚糖及其美拉德衍生物对超氧阴离子的清除能力Fig.6 Scavenging activities of COS,CA and CN on superoxide anion
采用Waters 2410型凝胶色谱仪,测得样品低聚壳聚糖的分子量为5654,美拉德反应制得的低聚壳聚糖衍生物CA、CN的分子量分别为5833和6391。美拉德衍生物的分子量较低聚壳聚糖都有所增加,表明低聚壳聚糖和氨基酸相互反应形成了更大的分子。
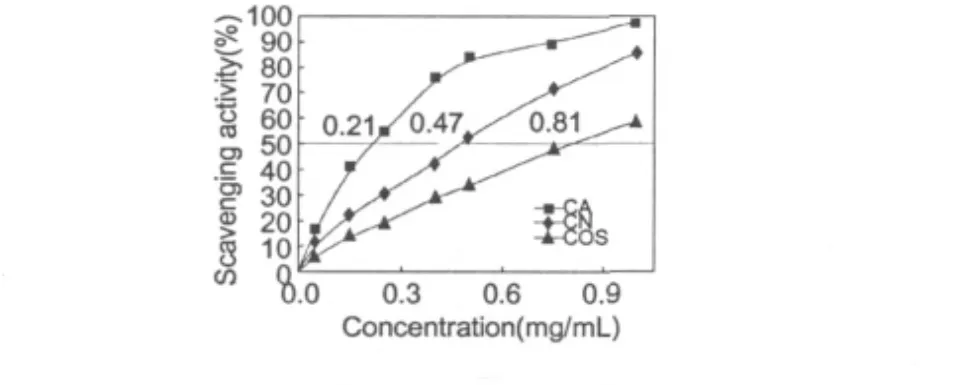
图7 低聚壳聚糖及其美拉德衍生物对DPPH的清除能力Fig.7 Scavenging activities of COS,CA and CN on DPPH radicals
2.6 对DPPH自由基的清除
图7描述了壳聚糖及其衍生物对DPPH自由基的清除能力。两种低聚壳聚糖衍生物CA和CN对DPPH自由基的清除能力均随着浓度的增加,且优于低聚壳聚糖,即抗氧化能力CA>CN>COS。这与对O-·2的清除效果保持一致。而CA和CN的IC50分别为0.21和0.47 mg/mL,可见CA对DPPH自由基的清除能力将近是CN的两倍多。
2.7 还原能力的测定
抗氧化活性和还原能力之间存在着密切的关系[18]。如图8所示,在浓度为2.5 mg/mL时,COS、 CN和CA的吸光度分别为0.48、0.55和1.03,还原能力强弱顺序为CA>CN>COS,这与前面的结果保持一致。
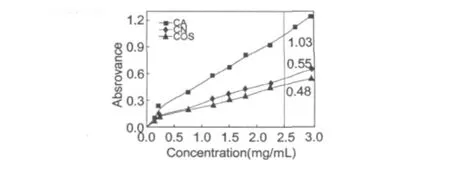
图8 低聚壳聚糖及其美拉德衍生物的还原能力测定Fig.8 Reducing power of COS,CA and CN
3 结论
本实验以美拉德反应为低聚壳聚糖的改性手段,分别与α-丙氨酸和天冬酰胺反应来制备低聚壳聚糖衍生物,并检测了低聚壳聚糖及其衍生物对、DPPH的清除能力以及还原能力。结果显示,衍生物的抗氧化性均优于低聚壳聚糖,故可以认为美拉德反应是低聚壳聚糖改性的有效手段;低聚壳聚糖与α-丙氨酸美拉德反应的衍生物抗氧化性更强,这可能是由于α-丙氨酸的分子较天冬酰胺小,更易于向羰基进攻发生美拉德反应,生成的衍生物抗氧化性能也更强。表明低聚壳聚糖与α-丙氨酸的美拉德反应是提高抗氧化性更有效的手段,其机理还有待进一步研究。本研究为制备天然、安全、高效的抗氧化剂提供了很好的思路。
1 Gong P(龚平),Kan JQ(阚建全).Study on the progress of Maillard reaction products.Food Ferment Ind,2009,35:141-145.
2 Wagner KH,Derkits S,Herr M,et al.Antioxidative potential of melanoidins isolated from a roasted glucose-glycine model.Food Chem,2002,78:375-382.
3 Yao Q(姚倩),Sun T(孙涛),Xu YX(徐轶霞).Preparation of chitosan oligosaccharide derivatives and their antioxidant activity.Nat Prod Res Dev(天然产物研究与开发),2008,20:530-533.
4 Yamaguchi T,Takamura H,Matoba T,et al.HPLC Method for evaluation of the free radical-scavenging activity of foods by using 1,1diphenyl-2-picrylhrazyl.Biosci Biotechnol Biochem,1998,62:1201-1204.
5 Yen GC,Chen HY.Antioxidant activity of various tea extracts in relation to their antimutagenicity.J Agric Food Chem,1995,43:27-32.
6 Zhao XR(赵希荣).Reaction conditions on Maillard reaction between chitosan and glucose and antioxidative ability of MRPs.CFA(中国食品添加剂),2004,25(6):63-67.
7 Ames JM.Applications of the Maillard reaction in the food industry.Food Chem,1998,62:431-439.
8 Brands CMJ,Van Boekel MAJS.Kinetics modeling of reactions in heated monosaccharide-casein systems.J Agric Food Chem,2002,50:6725-6739.
9 Ajandouz EH,Tchiakpe LS,Dalleore F,et al.Effect of pH on caramelization and Maillard reaction kinetics in fructose-lysine model systems.Food Sci,2001,66:926-931.
10 Sweetie RK,Ramesh C,Arun S.Chitosan glucose complex-A novel food preservative.Food Chem,2008,106:521-528.
11 Sun LP(孙丽平),Wang DF(汪东风),Xu Y(徐莹).Effect of pH and heating time on volatile products of Maillard reaction.Sci Technol Food Ind(食品工业科技),2009,30:122-125.
12 Moralew FJ,Romero C,Jimenez-perez S.Chromatographic determination of bound hydroxyl methyl furfural as an index of milk protein glycosylation.J Agric Food Chem,1997,45:1570-1573.
13 Wittayachai L,Soottawat B,Munehiko T.Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH.Food Chem,2007,100:669-677.
14 Kim D,Petrisor IG,Yen TF.Geopolymerization of biopolymers:A preliminary inquiry.Carbohydr Polym,2004,56:213-217.
15 Qin CQ,Du YM,Xiao L,et al.Enzymicpreparation of watersoluble chitosan and their antitumor activity.Int J Biol Macromol,2002,31:111-117.
16 Umemura K,Kawai S.Modification of chitosan by the Maillard reaction using cellulose model compounds.Carbohydr Polym,2007,68:242-248.
17 Xie WM,Xu PX,Liu Q.Antioxidant activity of water-soluble chitosan derivatives.Bioorg Med Chem Lett,2001,11:1699-1701.
18 Jing H,Kitts DD.Chemical and biochemical properties of casein-sugar Maillard reaction products.Food Chem Toxicol,2002,40:1007-1015.
Maillard Reaction of Chitosan Oligosaccharide and α-Alanine/ Asparagine and Antioxidant Acticity of Their Derivatives
SUN Tao1,2*,ZHU Yun1,XIE Jing1,XUE Bin1,MAO Fang11College of Food Science and Technology,Shanghai Ocean University;2Institute of Marine Science,Shanghai Ocean University,Shanghai 201306,China
Two kinds of the chitosan oligosaccharide derivatives were prepared through Maillard reaction by heating chitosan oligosaccharide and α-alanine/asparagine(the ratio of carbonyl group and amino group was 1∶1).The pH,absorbance and fluorescence were determined during the reaction.The chitosan oligosaccharide derivatives were characterized by FTIR and their molecular weight was determined by GPC.Their antioxidant activity was investigated by employing various established in vitro systems,such as superoxide,1,1-diphenyl-2-picrylhydrazyl(DPPH)radicals scavenging and reducing power.The results showed the chitosan oligosaccharide derivatives had strong antioxidant activity compared to chitosan oligosaccharide.The antioxidant activity was found to be in the order of CA>CN>COS.The results indicated that the derivatives prepared by chitosan oligosaccharide and α-alanine had better antioxidant activity than that prepared by chitosan oligosaccharide and asparagine.
chitosan oligosaccharide;α-alanine;asparagines;Maillard reaction;antioxidant activity
1001-6880(2012)04-0450-05
2011-05-03 接受日期:2011-07-29
“十二五”国家支撑计划(2011BAD24BO2);上海市教委重点学科建设项目(J50704)
*通讯作者 Tel:86-21-61900363;E-mail:taosun@shou.edu.cn
R285;Q539;TS202.3
A
