Coryfolia D的全合成
2012-11-21郭冬冬杨金会落俊山黄文倩
郭冬冬, 杨金会, 落俊山, 黄文倩
(宁夏大学 天然气转化国家重点实验室培育基地,宁夏 银川 750021)
中药补骨脂为豆科植物补骨脂的干燥成熟果实,它性温、味辛,具补肾助阳之功效,主治肾虚冷泻、小便频数、阳萎、腰膝冷痛、虚寒喘咳, 外用治白癜风。现代药理研究表明补骨脂具有多方面的生理活性。
Coryfolia D[(±)-7,8-(2,2-二甲基吡喃)-3,4-二羟基黄酮(1)]是从中药补骨脂中提取分离得到的一种新的异戊烯基黄酮天然产物[1],其全合成至今未见文献报道。研究Coryfolia D的全合成不仅具有重要的理论意义,还有较大的药用价值。
本文在本课题组[2~4]对黄酮类化合物的研究基础上,设计了1的全合成路线, 首次完成了1的全合成。以3,4-二羟基苯甲醛和2,4-二羟基苯乙酮为起始原料,经C-异戊烯基化、保护酚羟基、羟醛缩合、催化环化、DDQ脱氢及去保护基等反应合成1(Scheme 1),总收率11.8%。新化合物5~7和1的结构经1H NMR, IR和MS表征。
1 实验部分
1.1 仪器与试剂
X-5型熔点仪(温度计未校正);Bruker AM-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);FT-IR-8430S型红外光谱仪(KBr压片);5975C型和CAB073型质谱仪。



MOM=-CH2OCH3
Scheme1
硅胶(200目~300目),GF254硅胶,青岛海洋化工厂;3,4-二(甲氧基亚甲氧基)苯甲醛(4)[5]按文献方法合成;其余所用试剂均为分析纯。
1.2 合成
(1) 异戊烯基溴(1)的合成[5]
在反应瓶中加入异戊烯基醇2 mL(19.7 mmol)的乙醚(20 mL)溶液,搅拌下滴加吡啶0.1 mL,滴毕,冷却至0 ℃,剧烈搅拌下于0 ℃缓慢滴加三溴化磷1.9 mL(20 mmol),滴毕,反应1 h。倒入冰水中,用乙醚萃取,合并有机相层,依次用水、饱和食盐水洗涤,无水硫酸镁干燥,蒸除溶剂得淡黄色液体1,避光低温储存备用。
(2) 2,4-二羟基-3-异戊烯基苯乙酮(2)的合成[5]
在反应瓶加入KOH 560 mg(10 mmol)的水(10 mL)溶液,搅拌下于0 ℃加入2,4-二羟基苯乙酮760 mg(5 mmol);缓慢滴加1 0.6 mL(5 mmol),滴毕,反应1 h。自然升至室温,避光反应12 h;用3 mol·L-1盐酸调至pH <3,用乙酸乙酯(3×30 mL)萃取,合并有机相,依次用水、饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂后经硅胶柱层析[洗脱剂:A=V(石油醚) ∶V(乙酸乙酯)=6 ∶1]分离得白色固体2 385 mg,产率35%, m.p.155 ℃~158 ℃;1H NMRδ: 1.64, 1.77(s, 3H, CH3), 2.53(s, 3H, COCH3), 3.35(d,J=7.2 Hz, 2H, CH2), 5.26(t,J=7.2 Hz, 1H, CH=), 6.50(d,J=8.8 Hz, 1H, ArH), 7.64(d,J=8.8 Hz, 1H, ArH), 13.11(s, 1H, OH)。同时得2,4-二羟基-5-异戊烯基苯乙酮(107 mg)和2-羟基-4-异戊烯氧基苯乙酮(150 mg)。
(3) 2,2-二甲基-5-羟基-6-乙酰基-2H-1-苯并吡喃(3)的合成[5]
在反应瓶中加入2 440 mg(2.0 mmol)的苯(10 mL)溶液,搅拌下于室温加入2,3-二氯-5,6-二氰基-1,4-苯醌(DDQ)496 mg(2.2 mmol),回流反应5 min。冷却至室温,加水(10 mL),用乙酸乙酯(3×20 mL)萃取,合并有机层,依次用水、饱和食盐水洗涤,无水硫酸钠干燥,减压蒸去溶剂后经硅胶柱层析(洗脱剂:A=6 ∶1)纯化得白色固体3 367.4 mg, m.p.96 ℃~98 ℃,产率83%;1H NMRδ: 1.44(s, 6H, CH3), 2.52(s, 3H, COCH3), 5.57(d,J=10.0 Hz, 1H, 4″-H), 6.32(dd,J=8.8 Hz, 0.4 Hz, 1H, ArH), 6.70(dd,J=10.0 Hz, 1H, 3″-H), 7.49(d,J=8.8 Hz, 1H, ArH), 12.98(s, 1H, OH); IRν: 3 446, 2 974, 1 627, 1 365, 1 263, 1 052, 798 cm-1。
(4) 3′,4′-(2,2-二甲基吡喃)-2′-羟基-3,4-二甲氧甲氧基查尔酮(5)的合成[6,11]
在反应瓶中加入3 109 mg(0.50 mmol), 4 146 mg(0.65 mmol) 和乙醇1 mL,搅拌使其溶解;冰水浴冷却,于0 ℃缓慢滴加混合溶液[0 ℃, 氢氧化钾1.4 g(25 mmol)+水1.1 mL+乙醇1.7 mL],滴毕,氩气保护下于0 ℃反应1 h。自然升至室温,反应24 h。倒入冰水中,用3 mol·L-1盐酸调至pH<2,用二氯甲烷(3×20 mL)萃取,合并有机相,依次用蒸馏水、饱和食盐水洗涤,无水硫酸钠干燥,减压蒸去溶剂后经硅胶柱层析(洗脱剂:A=8 ∶1) 纯化得淡黄色黏稠物5 160 mg,产率75%;1H NMRδ: 1.47(s, 6H, CH3), 3.53(s, 3H, OCH3), 3.55(s, 3H, OCH3), 5.30(s, 4H, OCH2O), 5.69(d,J=10.0 Hz, 1H, 4″-H), 6.49(d,J=8.8 Hz, 1H, ArH), 6.75(d,J=10.0 Hz, 1H, 3″-H), 7.20(d,J=8.4 Hz, 1H, ArH), 7.28(d,J=1.6 Hz, 8.4 Hz, 1H, ArH), 7.43(d,J=15.6 Hz, 1H, =CH), 7.47(d,J=1.6 Hz, 1H, ArH), 7.72(d,J=8.8 Hz, 1H, ArH), 7.81(d,J=15.2 Hz, 1H, CH=), 13.76(s, 1H, OH); IRν: 3 467, 2 974, 1 513, 1 413, 1 351, 1 272, 1 153, 708 cm-1; MSm/z: 425{[M-1]+}。
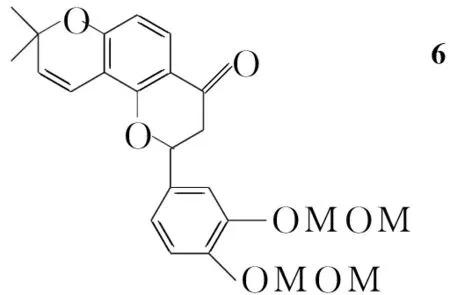
(5) (±)-7,8-(2,2-二甲基吡喃)-3,4-二甲氧甲氧基黄烷酮(6)的合成[7]
在反应瓶中加入5 107 mg(0.25 mmol)的乙醇(6.0 mL)溶液,搅拌下加入无水醋酸钠61.5 mg(0.75 mmol)和5滴水,回流反应25 h。冷却至室温,加少量水,用二氯甲烷(3×20 mL)萃取,合并有机相,依次用蒸馏水、饱和食盐水洗涤,无水硫酸镁干燥,蒸去溶剂后经硅胶柱层析(洗脱剂:A=3 ∶1) 纯化得淡绿状液体6 85.5 mg,产率82.5%;1H NMRδ: 1.43(s, 3H, CH3), 1.45(s, 3H, CH3), 2.80(dd,J=3.2 Hz, 16.8 Hz, 1H, H3β), 3.00(dd,J=13.2 Hz, 16.8 Hz, 1H, H3α), 3.52(s, 6H, OCH3), 5.26(s, 4H, OCH2O), 5.39(dd,J=2.8 Hz, 13.2 Hz, 1H, 2-H), 5.58(d,J=10.0 Hz, 1H, 3″-H), 6.48(d,J=8.8 Hz, 1H, ArH), 6.62(d,J=10.0 Hz, 1H, 4″-H), 7.07(dd,J=2.0 Hz, 8.4 Hz, 1H, ArH), 7.20(d,J=8.4 Hz, 1H, ArH,), 7.29(d,J=2.0 Hz, 1H, ArH), 7.72(d,J=8.8 Hz, 1H, ArH); IRν: 2 974, 2 359, 1 595, 1 513, 1 482, 1 377, 1 272, 1 237, 1 153, 1 037, 729 cm-1; MSm/z: 425{[M-1]+}。
(6) (±)-7,8-(2,2-二甲基吡喃)-3,4-二甲氧甲氧基黄酮(7)合成[8]
在反应瓶中加入6 65 mg(0.15 mmol)的1,4-二氧六环(2.0 mL)溶液,搅拌下加入DDQ 56.7 mg(0.25 mmol),回流反应10 h。冷却至室温,加少量水,用乙酸乙酯(3×20 mL)萃取,合并有机相,依次用蒸馏水、饱和食盐水洗涤,无水硫酸镁干燥,蒸去溶剂后经硅胶柱层析(洗脱剂:A=2 ∶1) 纯化得淡绿色黏稠物7 52.3 mg(回收6 11.5 mg),产率82.2%;1H NMRδ: 1.50(s, 6H, CH3), 3.52(s, 3H, OCH3), 3.56(s, 3H, OCH3), 5.31(s, 4H, OCH2O), 5.75(d,J=10.0 Hz, 1H, 3″-H), 6.69(s, 1H, 3-H), 6.84(d,J=8.8 Hz, 1H, ArH), 6.90(d,J=10.0 Hz, 1H, 4″-H), 7.28(d,J=8.8 Hz, 1H, ArH), 7.53(d,J=2.0 Hz, 8.4 Hz, 1H, ArH), 7.74(d,J=2.0 Hz, 1H, ArH), 7.96(d,J=8.4 Hz, 1H, ArH); IRν: 3 774, 3 447, 3 106, 2 927, 2 360, 1 537, 1 398, 1 334, 1 265, 1 114, 891, 782, 668 cm-1; MSm/z: 425{[M+1]+}。
(7) 1的合成
在反应瓶中加入7 42.4 mg(0.10 mmol)的甲醇(5 mL)溶液,搅拌下加入对甲基苯磺酸(TsOH)38.5 mg(0.20 mmol),于室温反应至终点(TLC跟踪)。加少量水,用乙酸乙酯(3×20 mL)萃取,合并有机相,依次用蒸馏水、饱和食盐水洗涤,无水硫酸镁干燥,减压蒸去溶剂后经硅胶柱层析[洗脱剂:V(氯仿) ∶V(甲醇)=20 ∶1]纯化得淡黄色油状液体1 26.8 mg,产率80%;1H NMR(CD3OD)δ: 1.47(s, 6H, CH3), 5.88(d,J=10.0 Hz, 1H, 3″-H), 6.62(s, 1H, 3-H), 6.83(d,J=8.8 Hz, 1H, ArH), 6.88(d,J=8.4 Hz, 1H, ArH), 6.95(d,J=10.0 Hz, 1H, 4″-H), 7.37(m, 2H, ArH), 7.83(d,J=8.8 Hz, 1H, ArH);13C NMR(CD3COCD3)δ: 145.7(C2), 113.0(C3), 176.2(C4), 123.4(C5), 114.5(C6), 157.1(C7), 105.0(C8), 162.6(C9), 116.0(C10), 125.4(C1′), 118.9(C2′), 146.0(C3′), 152.0(C4′) , 117.8(C5′), 125.4(C6′), 77.6(C2″), 130.9(C3″), 114.9(C4″), 28.6(C5″), 28.6(C6″); IRν: 3 852, 3 774, 3 017, 2 926, 2 360, 1 855, 1 700, 1 326, 1 114, 916, 668 cm-1; MSm/z: 335{[M-1]+}。
2 结果与讨论
2,4-二羟基苯乙酮在KOH/水的条件下与1反应,以35%的产率得到单C-异戊烯基化产物(2); 2在DDQ的作用下关环,异戊烯基优先和4-位羰基关环形成3,收率83%; 2-位羟基因为和邻位羰基形成分子内氢键,活性降低。3,4-二羟基苯甲醛在K2CO3作用下与氯甲基甲基醚(MOMCl)反应,保护羟基,以91%的产率得到保护酚羟基的醛(4); 3和4在氩气的保护下,在氢氧化钾/水/乙醇的作用下以75%的产率得5; 5在醋酸钠乙醇回流作用下以82.5%的收率得到黄烷酮6; 6在DDQ作用下得到7,收率82.2%; 7在TsOH和甲醇溶液在室温中反应以80%的产率脱去MOM保护得到预期的天然产物1。以11.8 %的总收率首次完成了天然产物1的全合成。
[1] 杨彤彤,李静,秦民坚,等. 两个新的黄酮类化合物[J].药学学报,2009,44(12):1387-1390.
[2] Zhang Y H, Yang J H, Li H J,etal. First total synthesis of (±)-puyanin and (±)-4′-O-methylbonannione[J].Chin J Chem,2011,29:521-524.
[3] Yang J H, Zhao Y M, Ji C B. First total synthesis of (±)-abyssinoflavanone V[J].Chin Chem Lett,2008,19:658.
[4] 杨金会,孟丽聪. 天然产物1,3-二-(2-羟基-4-甲氧基苯基)丙烷和1,3-二-(2,4-二羟基苯基)丙烷的合成[J].有机化学,2008,28(05):918-921.
[5] 薛吉军. 黄酮类化合物的合成[D].兰州:兰州大学,2004.
[6] 孙亚捷,李裕林,赵联运,等. 4′,5,7-三羟基-2′-甲氧基-6,8-二异戊烯基黄烷酮的全合成[J].合成化学,1995,(2):127-130.
[7] C S Huang, Z Zhang, Y L Li. Total synthesis of (R,S)-sophoraflavanone C[J].J Nature Product,1998,61:1283-1285.
[8] 汪秋安,吴峥,刘莉,等. 柑橘生物活性多甲氧基黄酮及其糖苷类的合成研究[J].有机化学,2010,30(11):1682-1688.
