新型刚性芳环桥连甲硫基-二茂铁苯胺化合物的合成及其电化学性质研究
2012-11-21何欢欢李长恭韩瑞杰郭素华王留成
何欢欢, 李长恭, 韩瑞杰, 郭素华, 王留成
(1. 郑州大学 化工与能源学院,河南 郑州 450001; 2. 河南科技学院 化学化工学院,河南 新乡 453003)
二茂铁(FcH)及其衍生物是一类具有特殊夹心结构的含铁有机配合物,具有良好的稳定性、芳香性、亲油性、氧化还原可逆性、低毒性等特点,在非线性光学材料、液晶材料、导电材料、磁性材料以及电分析、电催化和生物传感器等领域有着广泛的应用[1~5]。近年来,将二茂铁及其衍生物通过吸附、共价键结合、溶胶-凝胶法、电化学聚合法等修饰到电极表面应用于化学传感器的研究逐渐成为研究热点,特别是利用分子自组装技术所具有的稳定性和有序性,为研究表面和界面现象提供了在分子水平上精确控制界面性质的有效方法。通过Au-S键将具有柔性长链的二茂铁自组装修饰到电极上已有文献报导[6,7],但通过刚性的芳香环将二茂铁自组装修饰到电极上的方法还未见报导。


CompabcR -- -- --
Scheme1
本文设计通过对甲硫基苯甲醛分别与对二茂铁苯胺(3a),间二茂铁苯胺(3b)和邻二茂铁苯胺(3c)反应合成了三个新型的含对甲硫苯基的二茂铁席夫碱化合物(4a~4c); 4a和4b经硼氢化钠还原碳氮双键得到两个N-(对甲硫苄基)二茂铁苯胺化合物——N-(对甲硫苄基)对二茂铁苯胺(5a)和N-(对甲硫苄基)间二茂铁苯胺(5b, Scheme 1),其结构经1H NMR, IR和MS表征。并用循环伏安曲线研究了3~5的电化学性质。期望刚性的共轭芳环能加速电极与二茂铁氧化还原中心之间的电子传递。
1 实验部分
1.1 仪器与试剂
WRS-1B型数字熔点仪;Bruker AV-400型核磁共振仪(CDCl3为溶剂,TMS为内标);FT-IR-7600型红外光谱仪;7.0T型傅立叶变换离子回旋共振质谱仪;CHI620D型电化学分析仪。
1a~1c,分析纯,天津光复精细化工研究所;对甲硫基苯甲醛, Ward Blenkinsop公司;FcH,分析纯,天津市标准科技有限公司;其余所用试剂均为分析纯;溶剂使用前经干燥处理。
1.2 合成
(1) 二茂铁基硝基苯(2a~2c)的合成[8](以2a为例)
在反应瓶中依次加入对硝基苯胺(1a)14.00 g(100 mmol)和水30 mL,冰浴冷却,搅拌下缓慢滴加浓硫酸30 mL,加热使其完全溶解;于5 ℃缓慢滴加亚硝酸钠7 g的水(20 mL)溶液,滴毕,于5 ℃反应1 h。加入尿素54 mg分解未反应的亚硝酸得重氮盐溶液(A),冷却备用。
在反应瓶中加入二茂铁9.50 g(50 mmol),乙醚100 mL及十二烷基三甲溴化铵1 g,搅拌下于5 ℃滴加A(2 h内),反应30 min。蒸出乙醚,过滤,滤饼用水洗涤,用水蒸气蒸馏除去未反应的FcH,残余物用CH2Cl2溶解,依次用水、饱和食盐水洗涤,无水Na2SO4干燥,经TLC[展开剂:A=V(CH2Cl2) ∶V(石油醚)=1 ∶1,取集第一条紫色带]分离得紫色固体2a12.59 g,收率65.3%, m.p.168.5 ℃~169.0 ℃(169.5 ℃~170.0 ℃[8])。
用类似的方法合成紫色固体2b(收率61.2%, m.p.85.0 ℃~85.2 ℃)和2c(收率62.7%, m.p.114.9 ℃~115.2 ℃)。
(2) 二茂铁基苯胺(3a~3c)的合成[8](以3a为例)
在反应瓶中依次加入2a1.50 g(5.4 mmol),浓盐酸19 mL,乙醇30 mL及锡条3.38 g,搅拌下回流反应4 h。冷却至室温,加适量水,用30%NaOH溶液调至pH 8~9,过滤,滤液用CH2Cl2(3×15 mL)萃取,合并萃取液,用无水Na2SO4干燥,经TLC[展开剂:A=3 ∶1,取集第二条黄色带]分离得橘黄色固体3a0.93 g,收率62.1%, m.p.156.8 ℃~157.5 ℃(157 ℃~159 ℃[8])。
用类似的方法合成橘黄色固体3b(收率80.3%, m.p.117.5 ℃~117.8 ℃)和橘黄色液体3c(收率76.0%)。
(3) 4a~4c的合成(以4a为例)
氮气保护下,在干燥的三颈烧瓶中加入3a0.14 g(0.5 mmol)和新蒸乙醇10 mL,搅拌使其完全溶解;缓慢滴加对甲硫基苯甲醛0.087 mL(0.65 mmol),滴毕,回流反应至终点(TLC跟踪,展开剂:A=3 ∶1)。减压蒸出溶剂,残余物用冷乙醇洗涤,用混合溶剂[V(CH2Cl2) ∶V(正己烷)=1 ∶3]重结晶得橘黄色固体4a170 mg,收率82.7%, m.p.186.1 ℃~186.3 ℃。
用类似的方法合成橘黄色固体4b(收率62.5%, m.p.124.3 ℃~124.5 ℃)和4c(收率75.0%, m.p.133.6 ℃~133.9 ℃)。
(4) 5的合成(以5a为例)
在反应瓶中依次加入4a0.12 g(0.3 mmol)的THF(10 mL)溶液,搅拌下于室温缓慢滴加NaBH40.10 g的甲醇(0.5 mL)溶液,滴毕,反应至终点(TLC跟踪,展开剂:A=1 ∶1)。减压蒸出溶剂,残余物加适量水,用CH2Cl2(3×10 mL)萃取,合并有机相,用无水Na2SO4干燥,TLC(展开剂:A=3 ∶1,取集第一条黄色带)分离得橘黄色固体5a90 mg,收率75.3%, m.p.153.0 ℃~153.2 ℃。
用类似的方法合成亮橘黄色固体5b,收率82.0%, m.p.106.9 ℃~107.1 ℃。
1.3 电化学性质测定

2 结果与讨论
2.1 合成
在按文献[8]方法合成2a~2c时发现,1a~1c即使加热也不能溶于17%盐酸(60 mL)中,且几乎得不到2a~2c。我们改用等量的浓硫酸代替浓盐酸使1溶解,合成的2a~2c收率均在60.0%以上。
在用锡粒还原2a~2c合成3a~3c时发现,锡粒基本未反应,收率很低,可能是2与锡粒的接触面积小,反应不彻底所致。我们将锡粒压成小片再切成细丝与原料反应,得到了较满意的收率。
文献[9,10]报道用硼氢化钠还原二茂铁基席夫碱衍生物时以甲醇作溶剂,但实验中发现4a~4c即使在热甲醇中溶解度也很小,故合成5时改用THF为溶剂。硼氢化钠易溶于甲醇而微溶于THF,所以用少量的甲醇溶解硼氢化钠使反应较易进行。在反应初始需用冰水浴防止反应过于剧烈(以免生成较多副产物),当观察反应较缓和后再撤掉冰水浴(一般需2 h)。
2.2 表征
4a~4c, 5a和5b的表征数据见表1。从表1可见,4中的-SCH3在2.6附近为单峰;HC=N在8.4附近有一个单峰;取代茂环的α-H在4.3附近有个单峰,β-H在4.7附近有一个单峰,未取代茂环在4.0附近出现单峰。
4a~4c苯环质子的化学位移和裂分形状有差异。4a苯环质子在7.83, 7.50, 7.32和7.18呈双峰,积分面积比为2 ∶2 ∶2 ∶2; 4b苯环质子在7.84呈双峰,7.35~7.31呈多重峰,7.02呈双峰,积分面积约为2 ∶5 ∶1。4c苯环质子在7.87, 7.64, 7.36和6.87处为双峰,7.24~7.15处呈多重峰,积分面积比为2 ∶1 ∶2 ∶1 ∶2。从表1还可见,4a~4c分别在1 621 cm-1, 1 620 cm-1和1 619 cm-1出现了C=N键的强吸收峰,且在1 700 cm-1左右无醛基的特征吸收峰,说明C=N键已生成。4a~4c在1 100 cm-1和1 000 cm-1左右出现的两个中等强度的吸收峰表明其是单取代的二茂铁衍生物;在818 cm-1左右出现的强而尖的吸收峰是苯环上C-H面外弯曲振动的特征吸收峰。
5与4在1H NMR中最明显的区别是5在4.3左右出现了CH2的特征峰,且在8.4左右HC=N的特征峰消失。5的IR分析表明,3 400 cm-1附近出现一中等强度吸收峰,这是N-H伸缩振动吸收峰,且代表C=N键的1 620 cm-1左右的强吸收峰消失,表明C=N键已还原成了C-N键;1 613 cm-1和1 603 cm-1为苯环的共振吸收峰,其余特征吸收峰与4类似。4a~4c, 5a和5b的结构也得到了高分辨质谱的佐证(表1)。
2.3 电化学性质
由循环伏安实验发现,3a~5b在-0.35 V~0.50 V都只有一对氧化还原峰,且由恒电位库仑电解确证化合物经历的是单电子氧化还原过程,这应归属为其FcH电对的氧化还原。
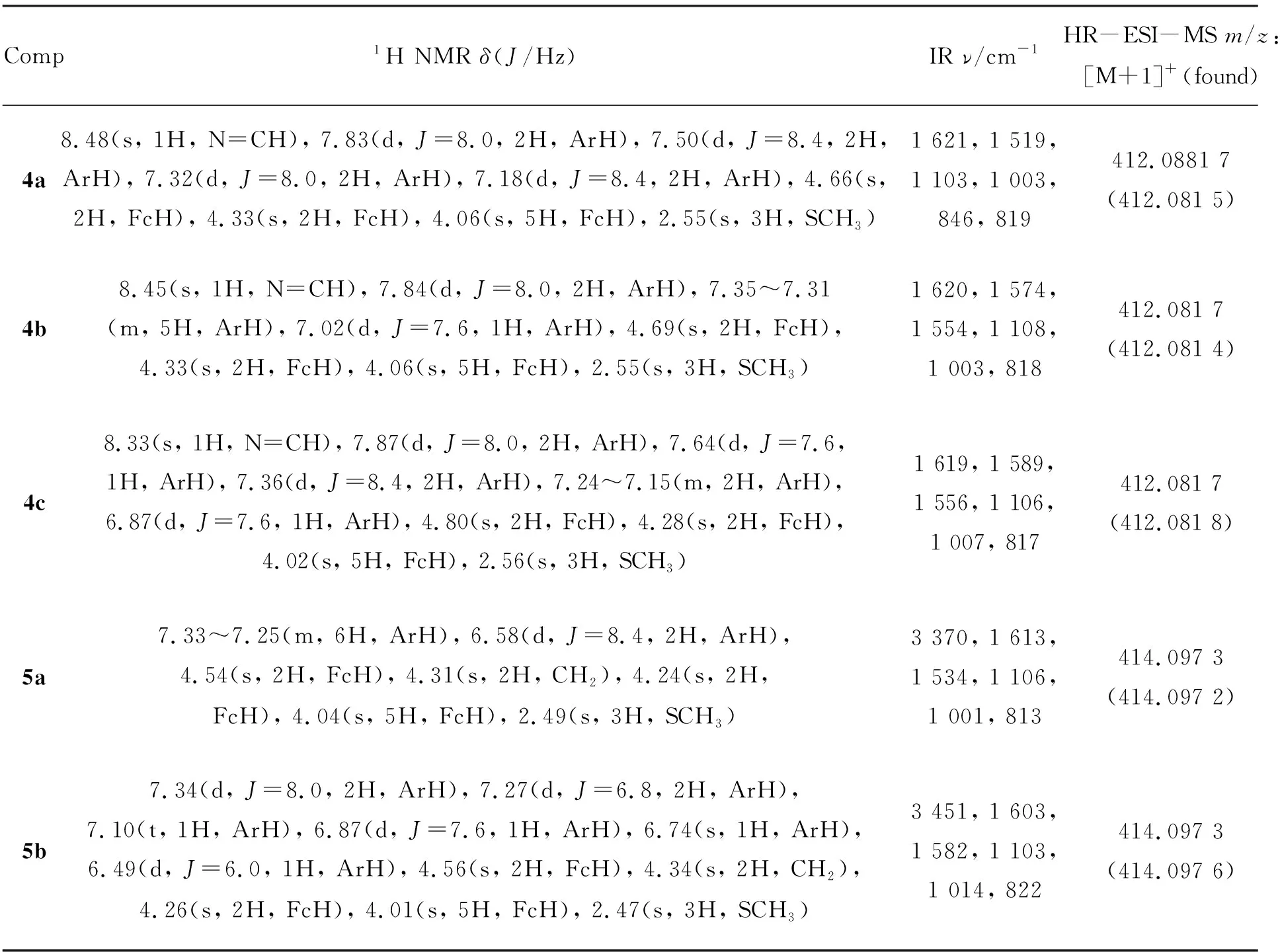
表 1 化合物的表征数据Table 1 Characteristic data of compounds
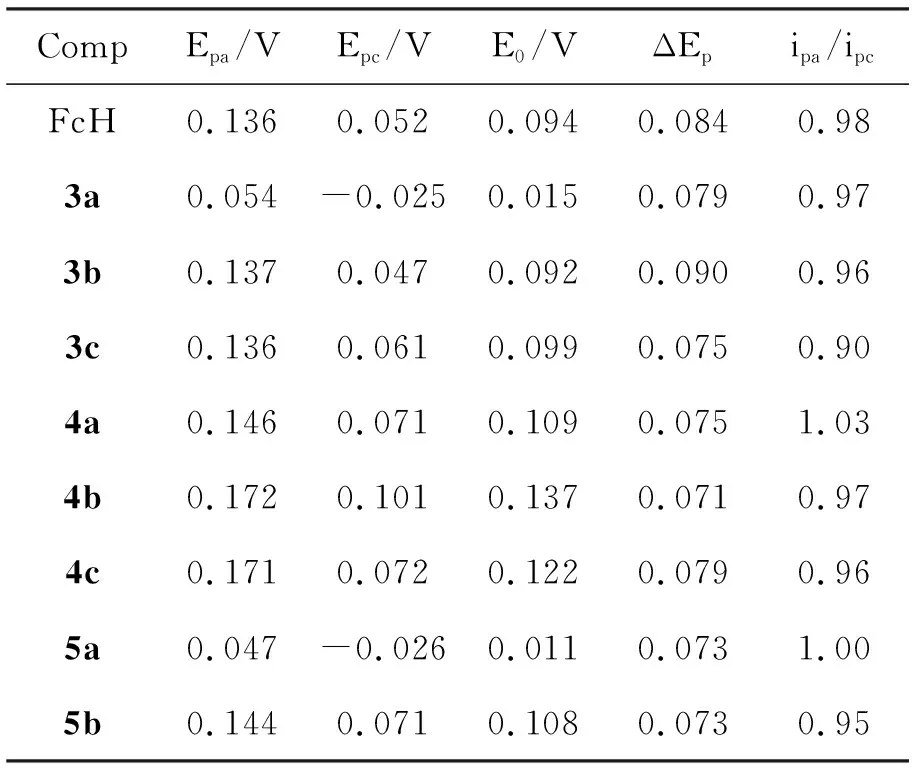
表 2 化合物的电化学数据Table 2 Electrochemical data of compounds
表2是化合物的相关电化学数据。由表2的电化学循环伏安数据可看出,取代基位置的不同,对二茂铁的氧化还原峰有一定影响。由ΔEp和ipa/ipc值(ΔEp=0.07 V~0.08 V, ipa/ipc≈1.00)可知,5a和5b在-0.35 V~0.5 V内都具有良好的氧化还原可逆性。而由式量电位[E0= (Epa+Epc)/2]可看出,取代基的位置对二茂铁得失电子能力有一定影响。在3a中,对胺基的供电子效应使得3a二茂铁环不易得到电子;而邻胺基的空间阻碍效应导致苯环与二茂铁环不能很好共轭,使得胺基的供电子效应对3c二茂铁环得失电子几乎没有影响;间胺基对3b二茂铁环得失电子影响甚微。在4a~4c中,由于C=N双键的存在,二茂铁环和苯环的共轭程度增加,电位正移,获得电子能力增强,这归因于苯环分散所得到的电子,使体系更稳定,但取代基的位置仍有差别,4a最难获得电子。随着C=N双键的还原,间或对仲胺基对二茂铁环得失电子的影响与3b, 3a中伯胺基的影响相似,5a,5b和4a,4b的得失电子能力非常相近。
图1为4a在乙腈中的CV曲线。从图1(A)可看出,随电位扫描速度的增加,氧化峰与还原峰的电位差ΔE没有发生明显变化,而氧化峰电流与还原峰电流在逐渐增加,Ip~ν1/2呈线性关系[如图1(B)],说明Fc/Fc+电对在电极上的反应过程是受扩散控制的。
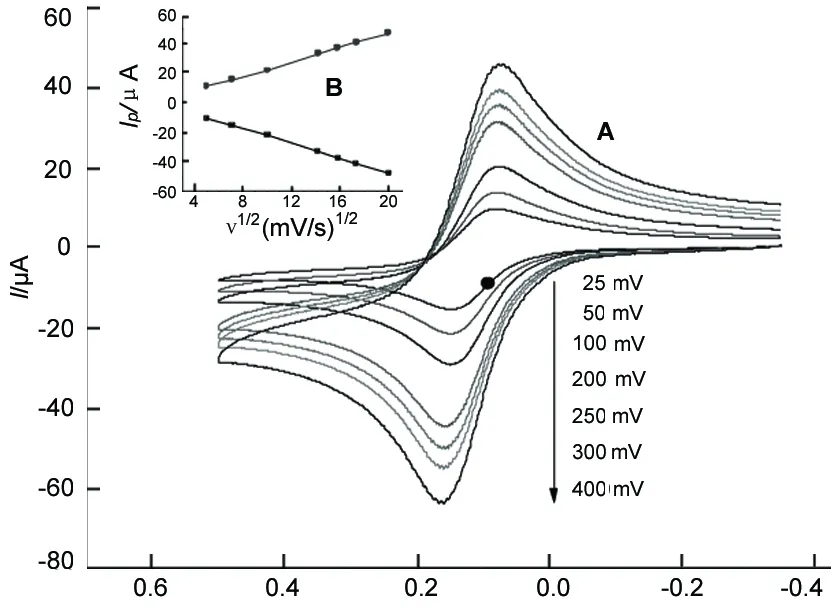
E/V vs Ag/Ag+图1 4a在乙腈中不同扫速的循环伏安图(A); 4a的Ip~ν1/2关系图(B)Figure 1 CV curves of 4a in acetonitrile at different scan rates(A); Ip~ν1/2of 4a (B)
3 结论
设计并合成了5个通过刚性芳香环连接的甲硫基二茂铁衍生物,其结构经1H NMR, IR和MS表征。电化学研究表明,和二茂铁处于邻,间,对-取代基对化合物的得失电子能力有一定影响,其中N-(对甲硫苄基)对二茂铁苯胺不易得到电子。由Ip~ν1/2的线性关系,说明化合物中Fc/Fc+电对在电极上的反应过程受扩散控制。将甲硫基转换成巯基或二硫键以及将其在金电极表面进行自组装的研究工作正在进行中。
[1] Sarhan A O, Izumi T. Design and synthesis of new functional compounds related to ferrrocene bearing heterocycolicmoieties: A new approach towards electrondomer organiomaterials[J].J Organomet Chem,2003,675:1-12.
[2] Zhang J, Constantine M M. Soot supression by ferrocene in laminar ethylene/air nonpremixed flames[J].Combustion and Flame,1996,105:528-540.
[3] Li L, Shi J L, Yan J,etal. Mesoporous SBA-15 material functionalized with ferrocene group and its use as heterogeneous catalyst for benzenehudroxylation[J].Applied Catalysis,2004,263:213-217.
[4] 陈灿辉,李红,刘彩红. 二茂铁及其衍生物修饰电极的研究[J].电子器件,2004,27(3):522-526.
[5] 吴校彬,郝卫东,黄河,等. 两种二茂铁基席夫碱的合成及其抑菌活性[J].化学试剂,2011,33(2):185-189.
[6] 杨梅,金葆康. 两种二茂铁巯基化合物的合成表征及其修饰金电极电化学性质的研究[J].分析科学学报,2008,24(4):373-376.
[7] 张校刚,史彦莉,力虎林. 一种结构新颖的二茂铁硫醇自组装膜的电化学行为[J].电化学,2003,9(2):235-239.
[8] 胡平,赵可清,张良辅. 二茂铁Schiff碱型金属有机液晶的合成、结构及介晶性研究[J].合成化学,1998,6(4):438-441.
[9] 徐琰,朱丽敏,冉春玲.N-2-亚甲基噻吩-二茂铁基芳胺衍生物的合成、晶体结构及电化学性质[J].无机化学学报,2007,23(4):589-596.
[10] 郭美卿,张峻,吕恩平.N-2-亚甲基-呋喃-二茂铁芳胺衍生物的合成与晶体结构及电化学性质[J].化学研究与应用,2007,19(10):1112-1117.
