细胞因子诱导的杀伤细胞免疫治疗肿瘤研究进展
2012-10-30吉海杰王黎明李会刘大庆史高娜李娜裴雪涛吴明远
吉海杰 王黎明 李会 刘大庆 史高娜 李娜 裴雪涛 吴明远
近年来,全球恶性肿瘤患者人数逐渐上升,新发病例数从2002年的1090万上升到2008年的1270万,因肿瘤导致死亡人数从670万上升到760万,成为人类死亡的首位原因[1]。手术、放疗和化疗的单一或联合应用对早发现恶性肿瘤的治疗能取得较好的疗效,但肿瘤复发、转移及肿瘤晚期患者由于体质差或治疗不敏感等原因导致上述疗法无法实施或疗效不佳[2]。因此,寻找能有效抑制肿瘤生长和转移且副作用小的治疗方法成为临床肿瘤治疗的迫切需要。
随着肿瘤免疫学的发展及对肿瘤抗原、肿瘤免疫逃逸机制和肿瘤微环境的认识深入,肿瘤免疫治疗成为治疗肿瘤的一种新模式:即通过激发或调动机体的免疫系统,增强肿瘤微环境抗肿瘤免疫力,从而控制和杀伤肿瘤细胞[3]。继淋巴因子激活杀伤细胞、肿瘤浸润淋巴细胞及CD3单抗激活的杀伤细胞后,细胞因子诱导的杀伤细胞(cytokine-induced killer, CIK)的杀瘤作用日益受到重视。1991年美国斯坦福大学Schmidt-Wolf利用多种细胞因子(干扰素-γ、CD3单克隆抗体、白介素-1和白介素-2)成功诱导外周血单核细胞快速增殖分化为具有肿瘤杀伤活性细胞,并命名为CIK细胞[4]。CIK细胞与其他过继性免疫治疗细胞相比具有增殖速度快、杀瘤活性高、杀瘤谱广、副作用小、对正常骨髓造血影响轻微等优点[5],因此CIK细胞被认为是新一代肿瘤过继免疫治疗的首选。现就CIK细胞的生物学特性、安全性和临床应用研究等方面的最新进展综述如下。
一、CIK细胞的生物学特性
(一)CIK细胞表型分析
CIK细胞多是采用IFN-γ、IL-2和CD3单克隆抗体等因子与外周血单核细胞体外共同培养一段时间获得的一群异质细胞,包括CD3-CD56+、CD3+CD56-和CD3+CD56+等 细 胞 亚 群,其 中CD3+CD56+细胞亚群是主要的细胞毒性效应细胞,共 表达 TCR-α/β、CD5 和 CD8,不 表达 CD16[6]。CD3+CD56+细胞在生理条件下外周血中的数量极 少 (1﹪~ 5﹪),外 周 血 中 CD3+CD56-T 细 胞亚群在体外多细胞因子的诱导下表达CD56分化为无增殖活性的CD3+CD56+细胞;以CD4和CD8为标准对T淋巴细胞分类发现增殖活性具有 CD4-CD8+>CD4+CD8->CD4+CD8+>CD4-CD8-的特点,除CD4+CD8-T亚群外,其余T细胞亚群均可通过体外多因子培养而获得CD56分子的表达[7]。由于CD4+CD8+细胞和CD4-CD8-细胞在正常人外周血中数量极少,提示CD3+CD56+主要来源于CD3+CD8+CD56-T淋巴细胞。成熟的CD3+CD56+细胞具有大颗粒淋巴细胞形态,能表达 NKG2D/CD134、LFA-1/CD11α、CD27、MIP-1α、Perforin、FasL和CD45RA,不表达CCR7和CD28;CD3+CD56+细胞虽然被称为自然杀伤细胞(Natural killer, NK)样T淋巴细胞,但不完全具备NK细胞表型,例如不表达NK细胞特异性活化受体NKp30、NKp44 和 NKp46,抑制性受体 KIR2DL1-2、KIR3DL1 和 NKG2A[7]。但表达 DNAM-1、NKG2D和NKp30等NK细胞活化受体[8]。CD3+CD56+细胞不表达Ⅰ型自然杀伤T细胞标志分子TCRVα24-JαQ,故被认为属于Ⅱ型自然杀伤T细胞[9]。CIK细胞高度表达CD3、CD54和CD11α,中度表达 CD3CD56、HLA-DR、CD28CD54和 CD28,不表达CD86和CD80[10]。研究还发现CIK细胞能分泌IFN-γ和 TNF-α 等细胞因子[11]。
值得注意的是,不同细胞因子诱导的CIK细胞表型具有多样性,各亚群比例具有差异性,例如比较分别用IL-2、IL-7及IL-12诱导的CIK细胞,发现IL-12能诱导更多CD3+CD56+细胞,而IL-7能诱导CD11和CD28表达[12];与IL-2比较IL-15更能诱导NKG2D表达[13];与CD3单克隆抗体比较兔抗胸腺细胞球蛋白能诱导CIK细胞表达NK细胞受体 CD158a、CD158b、NKp46、NKG2D 和 NKG2A或CD94,并能分泌IL-12p40[14]。
(二)CIK细胞生物活性
自从Schmidt-Wolf等[4]发现CIK细胞在体内外对人B淋巴瘤SU-DHL4细胞均有杀伤活性以来,其杀瘤活性得到广泛关注。由于CIK细胞具有T淋巴细胞杀瘤活性和NK细胞非主要组织相容性复合体限制性杀瘤的特点,对多种肿瘤细胞表现出强大的杀伤活性[15]。目前研究表明CIK细胞对多种血液肿瘤细胞和实体瘤细胞在体内外均具有杀伤活性(表1)。
(三)CIK细胞杀瘤机制研究
1.溶解靶细胞:早期研究发现CIK细胞能通过溶解靶细胞发挥杀瘤效应,可被表面黏附分子LFA-1或ICAM-1的单克隆抗体所阻滞[29]。进一步研究证实CIK细胞通过释放含有胞质颗粒直接溶解肿瘤细胞,其脱颗粒主要有两条途径:一条为CIK细胞表面黏附分子LFA-1与ICAM-1相互作用刺激其脱颗粒;另一条为CIK细胞表面CD3或CD3样受体与CD3单抗相互作用刺激其脱颗粒[30]。
2.诱导凋亡:研究发现CIK细胞表达分泌Fas配体(FasL),可通过Fas-FasL途径诱导Fas+肿瘤细胞凋亡,同时CIK细胞抗凋亡基因如cFLIP、Bc1-2、Bcl-xL、DAD1和survivin表达上调,能抵抗FasL+肿瘤细胞对CIK的反作用[31]。另外CIK细胞还能分泌肿瘤坏死因子相关的凋亡诱导配体可诱导Jurkat细胞凋亡[32]。CIK细胞与MGC-803胃癌细胞混合培养5 h后,可见靶细胞表面有孔洞形成;培养14 h后,靶细胞表面可见直径不一的圆形凋亡小体及孔洞;培养24 h后,可见靶细胞发生破裂[33]。CIK细胞体外可影响卵巢癌耐药细胞SKOV3或CDDP细胞周期,能诱导其发生凋亡[34]。
二、CIK细胞安全性研究
粒细胞-单核细胞集落形成实验表明CIK细胞对正常骨髓细胞毒性较小[4]。异体CIK细胞在动物模型可引起轻微移植物抗宿主疾病(graftversus-host disease, GVHD),萤光素酶标记的 CIK细胞骨髓移植后发现其浸润在发生GVHD靶组织数量较少且持续时间短暂[35]。此外,CIK细胞分泌大量的IFN-γ能抑制GVHD发生[36]。对5例脐带血移植后复发的急性白血病患者进行脐带血CIK细胞输注,除1例发生急性Ⅲ级GVHD外,其他4例均未发现异常反应[37]。对18例造血干细胞移植后血液病复发患者进行CIK细胞治疗,除2例发生急性Ⅰ-Ⅱ级GVHD和1例限制性慢性GVHD外未出现严重不良反应[38]。
三、CIK细胞临床应用研究
1999年Schmidt-Wolf等[39]首次将IL-2基因转染的自体CIK细胞用于肾癌、结直肠癌和淋巴瘤患者进行Ⅰ期临床试验研究,10例患者中除3例出现2级发热症状外没有严重不良反应事件发生;6例患者疾病进展,3例患者病情稳定,1例滤泡性淋巴瘤的患者完全缓解。目前CIK细胞单独或联合手术或(和)放化疗用于临床多种肿瘤的治疗。对以“CIK cells clinical trial”为关键词在 Pubmed 检索到的11项CIK细胞治疗肿瘤临床试验进行分析,381例患者中24例完全缓解,27例部分缓解,40例轻度缓解,161例病情稳定,129例疾病进展;总体来看CIK细胞治疗的副作用较小且能显著提高患者生存率[40]。近年来,我国学者在CIK细胞临床研究方面取得了显著进展,受到国际同行的关注。例如对以“CIK”或“细胞因子诱导的杀伤细胞”为关键词在中国科学技术期刊数据库检索到24项临床试验进行分析,563例患者中40例完全缓解,126例部分缓解,125例轻度缓解,135例病情稳定和58例疾病进展[41]。作者以“CIK cell”为关键词在clinicaltrials.gov检索到16项临床试验,涵盖血液肿瘤、肺癌、肝癌、肾癌及乳腺癌等肿瘤的治疗,其中9项是由我国学者注册。
(一)CIK细胞治疗血液肿瘤
7例霍奇金淋巴瘤及2例非霍奇金淋巴瘤晚期患者在造血干细胞移植失败后接受CIK细胞治疗,1例发生无症状的轻度低血压,1例轻度发热和1例由于疾病进展出现血小板减少症;短期疗效表明2例部分缓解,2例病情稳定[42]。对11例血液病患者在造血干细胞移植失败后反复进行CIK细胞输入,除4例发生急性GVHD外没有严重不良事件发生;6例疾病进展并死亡,1例病情稳定,1例病情改善,3例完全缓解[43]。24例血液肿瘤患者在造血干细胞移植失败后接受CIK细胞治疗,5例完全缓解[44]。9例弥漫性大B细胞淋巴瘤老年患者接受自体CIK细胞治疗,淋巴瘤症状和生活质量均显著提高,试验结束时9例均完全缓解且无不良反应发生[45]。以上研究表明CIK细胞用于血液肿瘤的治疗具有安全性和有效性。
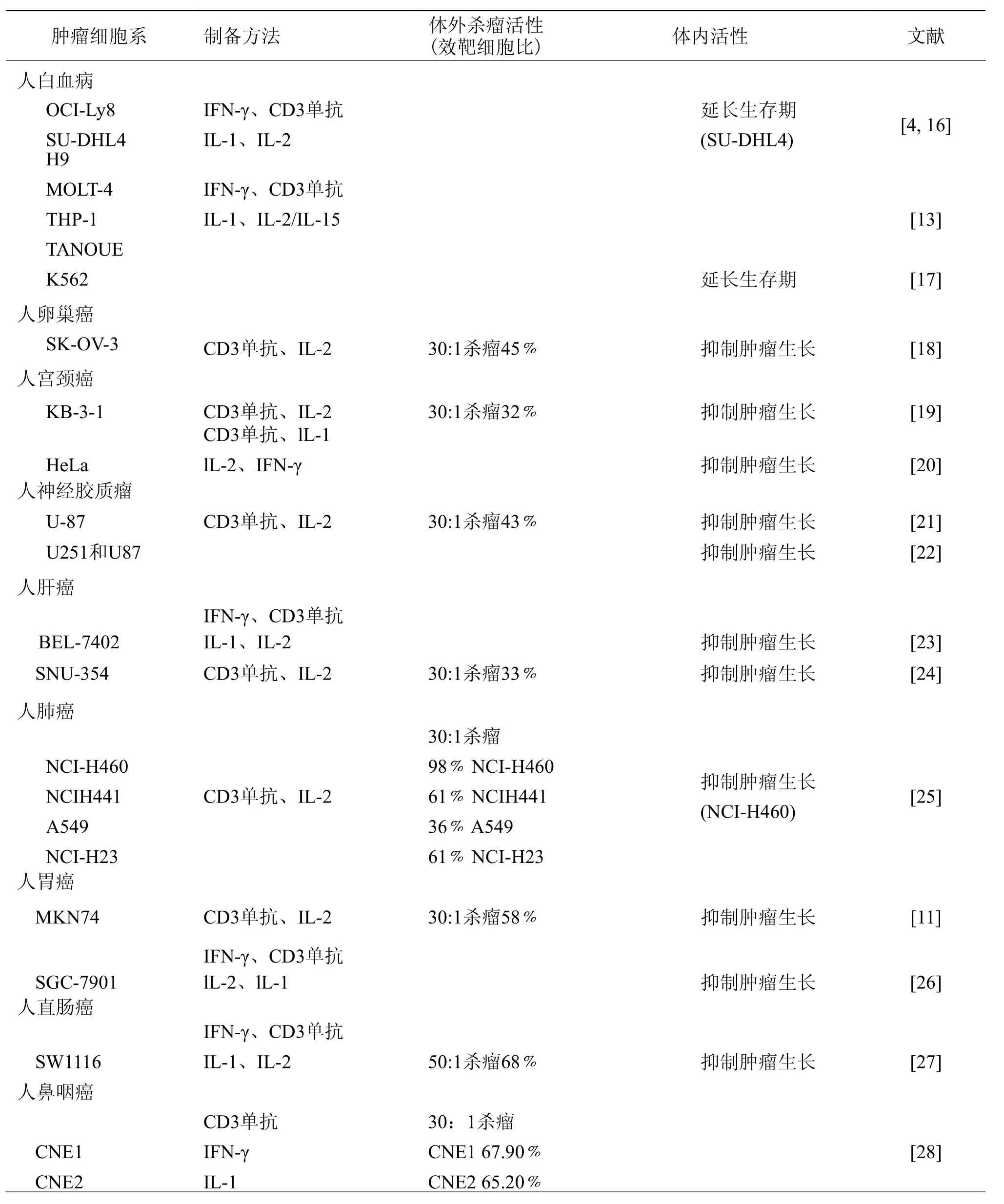
表1 CIK细胞杀瘤活性
(二)CIK细胞治疗实体瘤
目前已有CIK细胞治疗肾癌、乳腺癌、肝癌、肺癌及胃癌等肿瘤的临床研究报道。自体CIK细胞治疗16例肾癌转移患者,其中3例完全缓解,1例部分缓解,6例病情稳定[46]。自体CIK细胞治疗肾癌转移患者表明CIK能改善预后,且输入CIK细胞频率与疗效呈正相关性[47]。18例肾癌患者术后进行化疗联合CIK细胞治疗,其中3例治疗1年后肺转移且2年后死亡,15例病情稳定;对照组10例患者接受单独化疗,其中6例治疗1年后出现肺和腹腔癌转移(6例3年内死亡),其余4例病情稳定[48]。CIK细胞过继免疫治疗35例乳腺癌患者,其中24例完全缓解,6例部分缓解,1例病情稳定,近期有效率为85.71﹪,疾病控制率为88.57﹪,中位无进展期15个月;仅1例出现一过性发热反应[49]。13例原发性肝癌患者接受自体CIK细胞治疗,其病情得到好转且无不良反应发生[50]。一项随机对照临床研究表明肝癌根治性手术联合CIK治疗能降低肿瘤复发和进展,并显著延长无进展生存期[51]。微创联合CIK细胞治疗肝癌,治疗组1年和18个月的复发率显著低于对照组[52]。CIK细胞联合化疗治疗Ⅲ期非小细胞肺癌表明支气管动脉灌注化疗联合CIK治疗组临床有效率高于全身化疗组,且骨髓抑制毒性和非骨髓抑制毒性发生率低于全身化疗组[53]。Ⅳ期胃癌患者化疗联合CIK细胞免疫治疗,患者短期缓解率为56.3﹪,而单独化疗组为48﹪[54]。一项随机对照临床研究表明胃癌术后化疗联合CIK细胞治疗组患者中位生存期为49个月,而单独化疗组仅为27个月;2年和5年的存活率CIK细胞治疗组分别为73.5﹪和40.4﹪,单独化疗组分别为52.6﹪和23.9﹪;CIK细胞治疗不同频次组间具有显著差异,增加CIK细胞治疗频次能降低死亡风险[55]。
一项回顾性临床研究表明40例实体瘤患者接受自体CIK细胞治疗临床症状得到显著改善,其6个月、1年和3年的存活率分别为70.0﹪、60.0﹪和57.5﹪[56]。另一项对CIK细胞治疗实体瘤的Ⅱ/Ⅲ期临床试验系统性分析研究,表明CIK细胞能显著增加患者6个月、1年和2年生存率,延长平均生存期;CIK细胞治疗组患者6个月、1年和2年无进展生存期率显著增加,中位进展期明显延长[57]。
四、存在问题和展望
过继性细胞免疫疗法是向肿瘤患者输入具有抗肿瘤活性的免疫细胞,直接杀伤肿瘤或激发机体免疫反应来杀伤肿瘤细胞,对早期或手术或(和)放化疗后肿瘤治疗具有重要价值。CIK细胞作为新一代过继免疫细胞,大量研究已证明其抗肿瘤作用比其他免疫活性细胞更具有优势。根据卫生部第三类医疗技术的管理办法,越来越多医疗机构具备提供CIK细胞免疫疗法服务的能力,但目前尚无CIK细胞疗法的临床应用技术规范,使此项新技术应用受到限制。
传统CIK细胞主要通过分离患者自体外周血单核细胞经体外细胞因子诱导培养获得,由于多数患者手术及放化疗后体质较弱,一方面外周血采集比较困难,另一方面所分离的单核细胞数量少、质量差导致后期CIK细胞扩增周期长和数量不足不利于自体免疫细胞治疗,限制自体CIK细胞临床治疗肿瘤的应用。脐带血中富含多功能干细胞,除造血干细胞外,还有大量免疫细胞前体细胞,是一种重要的人类生物资源[58]。近年来研究发现脐带血单核细胞来源的CIK细胞免疫原性低、增殖和杀瘤活性更高,而且脐带血来源丰富、质量可控[59]。采用脐带血来源的CIK细胞辅助常规疗法治疗晚期恶性实体瘤患者,总缓解率、无病生存期和总生存率显著高于单独化疗[60],这提示脐带血来源的CIK细胞具有良好的临床应用价值和前景。
CIK细胞免疫治疗肿瘤临床疗效确切,但还没有形成完善和完备的应用和监管体系,通过CIK细胞基础和临床应用研究的结合制定出CIK细胞治疗恶性肿瘤的技术规范迫在眉睫,其中如何获得足够数量并具有高细胞毒活性的效应细胞,如何更好地将CIK细胞治疗和其他治疗手段有效结合成为重点与难点。
1 Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010,127(12):2893-2917.
2 Thanendrarajan S, Nowak M, Abken H, et al. Combining cytokine-induced killer cells with vaccination in cancer immunotherapy: more than one plus one?[J]. Leuk Res,2011,35(9):1136-1142.
3 Mellman I, Coukos G, Dranoff G. Cancer immunotherapy comes of age[J]. Nature, 2011,480(7378):480-489.
4 Schmidt-Wolf IG, Negrin RS, Kiem HP, et al. Use of a SCID mouse/human lymphoma model to evaluate cytokineinduced killer cells with potent antitumor cell activity[J]. J Exp Med, 1991,174(1):139-149.
5 Thanendrarajan S, Kim Y, Schmidt-Wolf I. New adoptive immunotherapy strategies for solid tumours with CIK cells [J]. Expert Opin Biol Ther, 2012, 12(5):565-572.
6 Schmidt-Wolf IG, Lefterova P, Johnston V, et al. Propagation of large numbers of T cells with natural killer cell markers[J]. Br J Haematol, 1994,87(3):453-458.
7 Franceschetti M, Pievani A, Borleri G, et al. Cytokineinduced killer cells are terminally differentiated activated CD8 cytotoxic T-EMRA lymphocytes[J]. Exp Hematol, 2009,37(5):616-628.
8 Pievani A, Borleri G, Pende D, et al. Dual-functional capability of CD3+CD56+CIK cells, a T-cell subset that acquires NK function and retains TCR-mediated specific cytotoxicity[J]. Blood, 2011,118(12):3301-3310.
9 Gutgemann S, Frank S, Strehl J, et al. Cytokine-induced killer cells are type II natural killer T cells[J]. Ger Med Sci, 2007,5: Doc07.
10 Linn YC, Lau SK, Liu BH, et al. Characterization of the recognition and functional heterogeneity exhibited by cytokine-induced killer cell subsets against acute myeloid leukaemia target cell[J]. Immunology, 2009,126(3):423-435.
11 Kim YJ, Lim J, Kang JS, et al. Adoptive immunotherapy of human gastric cancer with ex vivo expanded T cells[J]. Arch Pharm Res, 2010,33(11):1789-1795.
12 Zoll B, Lefterova P, Ebert O, et al. Modulation of cell surface markers on NK-like T lymphocytes by using IL-2, IL-7 or IL-12 in vitro stimulation[J]. Cytokine, 2000,12(9):1385-1390.
13 Rettinger E, Kuci S, Naumann I, et al. The cytotoxic potential of interleukin-15-stimulated cytokine-induced killer cells against leukemia cells[J]. Cytotherapy, 2012,14(1):91-103.
14 Bonanno G, Iudicone P, Mariotti A, et al. Thymoglobulin, interferon-gamma and interleukin-2 efficiently expand cytokine-induced killer (CIK) cells in clinical-grade cultures[J]. J Transl Med, 2010,8:129.
15 Linn YC, Hui KM. Cytokine-induced NK-like T cells: from bench to bedside[J]. J Biomed Biotechnol, 2010, (2010):1-8.
16 Lu PH, Negrin RS. A novel population of expanded human CD3+CD56+ cells derived from T cells with potent in vivo antitumor activity in mice with severe combined immunodeficiency[J]. J Immunol, 1994,153(4):1687-1696.
17 Li Y, Qu YH, Wu YF, et al. Bone marrow mesenchymal stem cells reduce the antitumor activity of cytokine-induced killer/natural killer cells in K562 NOD/SCID mice[J]. Ann Hematol, 2011,90(8):873-885.
18 Kim HM, Kang JS, Lim J, et al. Inhibition of human ovarian tumor growth by cytokine-induced killer cells[J]. Arch Pharm Res, 2007,30(11):1464-1470.
19 Kim HM, Lim J, Kang JS, et al. Inhibition of human cervical carcinoma growth by cytokine-induced killer cells in nude mouse xenograft model[J]. Int Immunopharmacol, 2009,9(3):375-380.
20 刘 爱民 , 霍红 旗 , 李鹏 , 等 . CIK 细胞体内外 抗 宫颈癌HeLa细胞活性的研究[J]. 癌变•畸变•突变, 2011,23(5):353-356.
21 Kim HM, Kang JS, Lim J, et al. Antitumor activity of cytokine-induced killer cells in nude mouse xenograft model[J]. Arch Pharm Res, 2009,32(5):781-787.
22 Wang P, Yu JP, Gao SY, et al. Experimental study on the treatment of intracerebral glioma xenograft with human cytokine-induced killer cells[J]. Cell Immunol, 2008,253(1-2):59-65.
23 Wang FS, Liu MX, Zhang B, et al. Antitumor activities of human autologous cytokine-induced killer (CIK) cells against hepatocellular carcinoma cells in vitro and in vivo[J]. World J Gastroenterol, 2002,8(3):464-468.
24 Kim HM, Lim J, Yoon YD, et al. Anti-tumor activity of ex vivo expanded cytokine-induced killer cells against human hepatocellular carcinoma[J]. Int Immunopharmacol, 2007,7(13):1793-1801.
25 Kim HM, Lim J, Park SK, et al. Antitumor activity of cytokine-induced killer cells against human lung cancer[J]. Int Immunopharmacol, 2007,7(13):1802-1807.
26 孙利兵, 杨光. CIK细胞对裸鼠人胃癌移植瘤生长的抑制作用 [J]. 世界华人消化杂志, 2009,(35):3627-3629.
27 Wang Y, Dai H, Li H, et al. Growth of human colorectal cancer SW1116 cells is inhibited by cytokine-induced killer cells[J]. Clin Dev Immunol, 2011, (2011):1-9.
28 程 伟民 , 方慧 云 , 李晓玲 , 等 . CIK 细胞对鼻 咽 癌细胞体外杀伤活性的研究[J]. 肿瘤基础与临床, 2009,22(6):507-508.
29 Schmidt-Wolf IG, Lefterova P, Johnston V, et al. Sensitivity of multidrug-resistant tumor cell lines to immunologic effector cells[J]. Cell Immunol, 1996,169(1):85-90.
30 Mehta BA, Schmidt-Wolf IG, Weissman IL, et al. Two pathways of exocytosis of cytoplasmic granule contents and target cell killing by cytokine-induced CD3+CD56+killer cells[J]. Blood, 1995,86(9):3493-3499.
31 Verneris MR, Kornacker M, Mailander V, et al. Resistance of ex vivo expanded CD3+CD56+T cells to Fasmediated apoptosis[J]. Cancer Immunol Immunother, 2000,49(6):335-345.
32 Martinez-Lorenzo MJ, Alava MA, Gamen S, et al. Involvement of APO2 ligand/TRAIL in activation-induced death of Jurkat and human peripheral blood T cells[J]. Eur J Immunol, 1998,28(9):2714-2725.
33 Sun S, Li XM, Li XD, et al. Studies on inducing apoptosis effects and mechanism of CIK cells for MGC-803 gastric cancer cell lines[J]. Cancer Biother Radiopharm, 2005,20(2):173-180.
34 张辉 , 赵群 , 左连富 , 等 . 细胞因子诱导的杀伤细胞对卵巢癌耐药细胞SKOV3/CDDP的作用机制[J]. 细胞与分子免疫学杂志, 2007,23(12):1167-1169.
35 Nishimura R, Baker J, Beilhack A, et al. In vivo trafficking and survival of cytokine-induced killer cells resulting in minimal GVHD with retention of antitumor activity[J]. Blood, 2008,112(6):2563-2574.
36 Baker J, Verneris MR, Ito M, et al. Expansion of cytolytic CD8(+) natural killer T cells with limited capacity for graftversus-host disease induction due to interferon gamma production[J]. Blood, 2001,97(10):2923-2931.
37 Introna M, Pievani A, Borleri G, et al. Feasibility and safety of adoptive immunotherapy with CIK cells after cord blood transplantation[J]. Biol Blood Marrow Transplant, 2010,16(11):1603-1607.
38 Laport GG, Sheehan K, Baker J, et al. Adoptive immunotherapy with cytokine-induced killer cells for patients with relapsed hematologic malignancies after allogeneic hematopoietic cell transplantation[J]. Biol Blood Marrow Transplant, 2011,17(11):1679-1687.
39 Schmidt-Wolf IG, Finke S, Trojaneck B, et al. Phase I clinical study applying autologous immunological effector cells transfected with the interleukin-2 gene in patients with metastatic renal cancer, colorectal cancer and lymphoma[J]. Br J Cancer, 1999,81(6):1009-1016.
40 Hontscha C, Borck Y, Zhou H, et al. Clinical trials on CIK cells: first report of the international registry on CIK cells(IRCC)[J]. J Cancer Res Clin Oncol, 2011,137(2):305-310.
41 Li XD, Xu B, Wu J, et al. Review of Chinese clinical trials on CIK cell treatment for malignancies[J]. Clin Transl Oncol, 2012,14(2):102-108.
42 Leemhuis T, Wells S, Scheffold C, et al. A phase I trial of autologous cytokine-induced killer cells for the treatment of relapsed Hodgkin disease and non-Hodgkin lymphoma[J]. Biol Blood Marrow Transplant, 2005,11(3):181-187.
43 Introna M, Borleri G, Conti E, et al. Repeated infusions of donor-derived cytokine-induced killer cells in patients relapsing after allogeneic stem cell transplantation: a phase I study[J]. Haematologica, 2007,92(7):952-959.
44 Linn YC, Niam M, Chu S, et al. The anti-tumour activity of allogeneic cytokine-induced killer cells in patients who relapse after allogeneic transplant for haematological malignancies[J]. Bone Marrow Transplant, 2012,47(7):957-966.
45 Lu XC, Yang B, Yu RL, et al. Clinical study of autologous cytokine-induced killer cells for the treatment of elderly patients with diffuse large B-cell lymphoma[J]. Cell Biochem Biophys, 2012,62(1):257-265.
46 Su X, Zhang L, Jin L, et al. Immunotherapy with cytokineinduced killer cells in metastatic renal cell carcinoma[J]. Cancer Biother Radiopharm, 2010,25(4):465-470.
47 Liu L, Zhang W, Qi X, et al. Randomized study of autologous cytokine-induced killer cell immunotherapy in metastatic renal carcinoma[J]. Clin Cancer Res, 2012,18(6):1751-1759.
48 Lei KJ, Wang J, Jia YM, et al. The effects of CIK cells on the treatment of renal cell carcinoma[J]. Chinese-German Journal of Clinical Oncology, 2009,(6):346-348.
49 解燕华 , 左铁 , 孟明耀 , 等 . CIK 细胞治疗乳腺癌的临床疗效评估 [J]. 云南医药 , 2011,32(4):390-393.
50 Shi M, Zhang B, Tang ZR, et al. Autologous cytokineinduced killer cell therapy in clinical trial phase Ⅰ is safe in patients with primary hepatocellular carcinoma[J]. World J Gastroenterol, 2004,10(8):1146-1151.
51 Hui D, Qiang L, Jian W, et al. A randomized, controlled trial of postoperative adjuvant cytokine-induced killer cells immunotherapy after radical resection of hepatocellular carcinoma[J]. Dig Liver Dis, 2009,41(1):36-41.
52 Weng DS, Zhou J, Zhou QM, et al. Minimally invasive treatment combined with cytokine-induced killer cells therapy lower the short-term recurrence rates of hepatocellular carcinomas[J]. J Immunother, 2008,31(1):63-71.
53 赵光强 , 叶联华 , 段林灿 , 等 . 全身化疗和支气管动脉灌注联合CIK过继免疫治疗Ⅲ期非小细胞肺癌的临床研究 [J]. 中国肺癌杂志 , 2009,12(6):493-494.
54 Jiang J, Xu N, Wu C, et al. Treatment of advanced gastric cancer by chemotherapy combined with autologous cytokine-induced killer cells[J]. Anticancer Res, 2006,26(3B):2237-2242.
55 Jiang JT, Shen YP, Wu CP, et al. Increasing the frequency of CIK cells adoptive immunotherapy may decrease risk of death in gastric cancer patients[J]. World J Gastroenterol, 2010,16(48):6155-6162.
56 Zhang J, Zhu L, Wei J, et al. The effects of cytokine-induced killer cells for the treatment of patients with solid tumors: a clinical retrospective study[J]. J Cancer Res Clin Oncol, 2012,138(6):1057-1062.
57 Ma Y, Zhang Z, Tang L, et al. Cytokine-induced killer cells in the treatment of patients with solid carcinomas: a systematic review and pooled analysis[J]. Cytotherapy, 2012,14(4):483-493.
58 de Ven C v, Collins D, Bradley MB, et al. The potential of umbilical cord blood multipotent stem cells for nonhematopoietic tissue and cell regeneration[J]. Exp Hematol, 2007,35(12):1753-1765.
59 Germenis AE, Karanikas V. Cord blood as a source of nonsenescent lymphocytes for tumor immunotherapy[J]. J Reprod Immunol, 2010,85(1):47-50.
60 Niu Q, Wang W, Li Y, et al. Cord blood-derived cytokine-induced killer cells biotherapy combined with second-line chemotherapy in the treatment of advanced solid malignancies[J]. Int Immunopharmacol, 2011,11(4):449-456.
