酶法制备豆粕抗氧化蛋白肽的研究火麻乳饮料制浆工艺的研究
2012-10-25马利华秦卫东陈学红
马利华,秦卫东,陈学红
(徐州工程学院食品学院,江苏徐州 221008)
酶法制备豆粕抗氧化蛋白肽的研究火麻乳饮料制浆工艺的研究
马利华,秦卫东*,陈学红
(徐州工程学院食品学院,江苏徐州 221008)
研究复合酶制备豆粕抗氧化蛋白肽的条件,采用响应曲面实验设计,优化酶解工艺,并采用高效液相色谱法对多肽酶解液进行分离纯化及抗氧化性能的测定。结果表明:胰蛋白酶与碱性蛋白酶的比例为2∶1,制备豆粕抗氧化蛋白肽的最佳酶解条件为:温度60℃,时间1.5h,底物浓度8%,酶用量0.4AU/g,得到蛋白肽含量14.08mg/g。高效液相色谱法分离出3个组分,且组分1的抗氧化效果好于其他组分。
复合酶,大豆多肽,响应曲面,抗氧化性
大豆是我国大面积种植的油料作物,含有丰富的营养物质,尤其是蛋白质、亚油酸以及一些必需氨基酸,对人体均有良好的调节、保健功能[1-2]。随着生物技术的进步和生命科学的发展,研究发现某些蛋白质无生理活性或活性很低,而其水解后产生的肽类却具有很强的生理活性[3]。近年来,研究人员利用酶技术得到的大豆酶水解物即大豆生物活性肽,具有营养全面、易消化吸收等诸多特性[4-6],尤其是具有清除羟基自由基[7]、终止单线态氧的生成[8]、络合促氧化的过渡[9]、抗氧化、降胆固醇、抗辐射、调节免疫、抗疲劳、增强肌肉运动能力、抑制肿瘤等非特异性作用[10-12],还能降低自动氧化速率和脂肪的过氧化物含量[13]等功效。因此,开发大豆生物活性肽可以大幅度提高大豆制品的附加值,拓宽大豆的用途,应用前景十分广阔。本实验以脱脂后的豆粕为原料,采用复合酶对豆粕进行有效的酶解,并进行抗氧化性的研究,使其成为豆粕高值化利用的有效途径之一。
1 材料与方法
1.1 材料与仪器
冰乙酸、无水乙醇、三氯乙酸、95%乙醇、考马斯亮蓝G-250、牛血清白蛋白、硫代巴比妥酸、硫酸亚铁等 均为分析纯,国药集团化学试剂有限公司;胰蛋白酶、酸性蛋白酶、碱性蛋白酶、中性蛋白酶、木瓜蛋白酶 酶活均为15AU/g,无锡市雪梅酶制剂科技有限公司;DPPH 生化试剂,SIGMA。
DHG9140型电热恒温鼓风干燥箱、7230G型可见分光光度计、精密酸度计PHS-3CA 上海精宏实验设备有限公司;Agilent100高效液相色谱仪 美国Agilent公司。
1.2 实验方法
1.2.1 酶种类的确定 分别称取酸性蛋白酶、碱性蛋白酶、中性蛋白酶、胰蛋白酶、木瓜蛋白酶各1g,加入豆粕,调整酶用量为0.5AU/g,酶解温度45℃,酶解时间2h,自然条件下酶解后,4000r/min离心15min,上清液在100℃的沸水中灭酶3min,测定多肽含量。
1.2.2 复配酶比例的确定[14]将选取的两种酶调节为3∶1,2∶1,1∶1,1∶2,1∶3的比例,加入豆粕,酶用量0.5AU/g,酶解温度45℃,酶解时间2h,自然条件下酶解后,4000r/min离心15min,上清液在100℃的沸水中灭酶3min,测定多肽含量。
1.2.3 豆粕多肽酶解[15]调节酶用量分别为 0.1、0.2、0.3、0.4、0.5、0.6AU/g,在自然条件下,加入蒸馏水,调节底物浓度分别为6%、7%、8%、9%、10%、11%,分别在40、45、50、55、60、65℃条件下酶解0.5、 1、1.5、2、2.5、3h后,4000r/min离心15min,上清液在100℃的沸水中灭酶3min,测定多肽含量。
根据上述单因素实验,进行响应曲面(Design Expert 7.0)实验。以酶解温度,底物浓度,酶解时间,酶用量做四因素三水平的响应曲面实验。
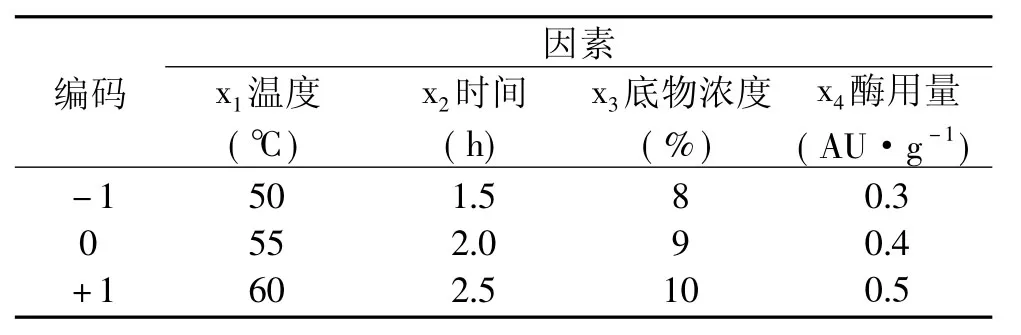
表1 响应面实验因素水平表Table 1 Factors and levels of RAS test
1.2.4 超滤膜分离纯化[16]蛋白溶液酶解之后,酶解产物分子量分布较广,其中大分子肽含量高,束缚了肽在食品行业中的应用,因此利用超滤膜的选择性,使大分子溶质和微粒被粒膜阻留,从而达到分离纯化酶解液的目的。酶解产物用截流分子量为5000ku的超滤膜进行处理。
1.2.5 HPLC对豆粕多肽的分离纯化[17]流动相: A,90%乙腈(含0.1%TFA);B,去离子水(含0.1% TFA);洗脱条件:0~3min,10%~100%A,10~20min,100%A~0;进样量:10μL;流速:0.5mL/min;检测波长:220nm。
1.2.6 蛋白肽抗氧化性测定
1.2.6.1 DPPH自由基清除活性 根据 Brand-Williams等[18]的方法测定。称取0.0128g DPPH加水溶解于小烧杯中,移至50mL容量瓶,定容,摇匀。取DPPH溶液5mL,加入样品及参照液,用二次蒸馏水定容于 10mL容量瓶中,置于 20℃水浴锅恒温30min,于517nm波长下测定吸光度。
样品对DPPH自由基的清除能力SA:
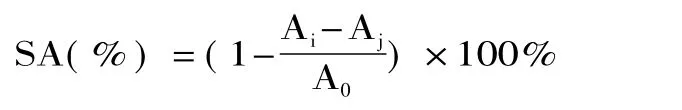
其中:A0:DPPH+80%乙醇溶液;Ai:DPPH+样品溶液;Aj:样品溶液+80%乙醇溶液。
1.2.6.2 羟基自由基清除活性 根据Zhang等[19]的方法测定。取8支具塞试管,每支试管各加入9mmol/L FeSO41mL,9mmol/L水杨酸一乙醇溶液2mL,按试管编号各加入不同浓度的多糖溶液2mL,最后加入8.8mol/L H2O22mL启动反应,37℃反应0.5h。以蒸馏水作空白调零,在510nm处测定样品的吸光度。
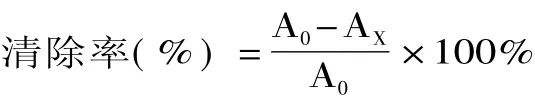
式中,A0-空白对照液的吸光度;AX-加入提取液的吸光度。
1.2.6.3 脂质过氧化反应的抑制作用 根据秦卫东等[20]的方法测定。用pH 7.4,0.1mol/L PBS配制1∶25稀释的卵磷脂悬浊液,取此悬浊液lmL,分别加入
2mL不同浓度的样品溶液,0.5mmol/L硫酸亚铁溶液,用上述PBS补足至5mL,对照管除不加样品溶液外其他试剂同前,并提前加入20%TCA溶液0.5mL,
对照管和样品管37℃水浴15min,取出后加入20% TCA溶液 0.5mL,静置 10min,于 3500r/min离心10min,取上清液2mL,分别加入0.8%硫代巴比妥酸1mL混匀,沸水浴15min,取出冷却,在532nm测吸光值。
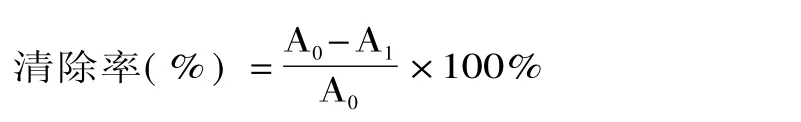
式中,A0-对照管的吸光度;A1-样品管的吸光度。
1.2.7 豆粕蛋白肽含量测定 以牛血清白蛋白为标准品,参照鲁伟等[21]的方法测定:
蛋白肽含量(mg/g)=蛋白肽液浓度×稀释倍数×(提取液体积/测定时使用体积)/原料质量
实验每组重复三次,每次取两个平行样,数据分析采用EXCEL软件得到方程:Y=0.046C+0.0249,R2为0.9972。
2 结果与分析
2.1 酶种类的确定
结果表明,每种酶水解豆粕后都能提高豆粕的蛋白肽含量,蛋白酶的来源不同,其酶学特性不同,对同一种蛋白质的水解作用也会存在差异。本研究表明(图1),水解效果最好的酶依次为:碱性蛋白酶>胰蛋白酶>中性蛋白酶>酸性蛋白酶>木瓜蛋白酶。
2.2 两种酶最佳比例的确定
酶反应的专一性导致单一酶作用范围小,本实验采用碱性蛋白酶和胰蛋白酶复合酶水解,可有效地提高蛋白质的水解效果,本实验也证明了这点,通过比较图1、图2可知,不同蛋白酶混合后,水解效果均好于单一酶,且胰蛋白酶与碱蛋白酶比例为2∶1时豆粕多肽的水解效果最佳。
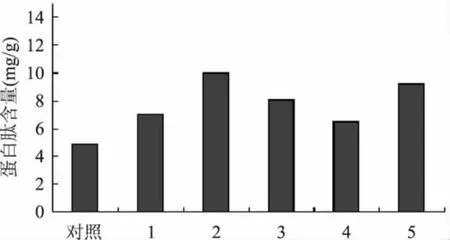
图1 不同蛋白酶酶解效果比较Fig.1 The comparison of hydrolyzates effects of different prolease
2.3 豆粕多肽酶解
2.3.1 温度对多肽提取的影响 酶催化反应都有其最适温度,一般在酶的最适温度以下,随着温度的升高反应物的能量和分子间有效接触的频率增加,因而反应速度加快。超过最适温度,则酶分子的空间结构由于能量的增加而发生改变,导致酶活性减弱或丧失。由图3可知,复合酶在55~65℃都具有较强的酶活性。
2.3.2 酶解时间对多肽提取的影响 从图4可知,随着酶作用时间的延长,水解出的蛋白肽越多,在2h后水解蛋白肽含量趋于稳定。说明复合酶在作用2h后,其酶解作用基本完成。
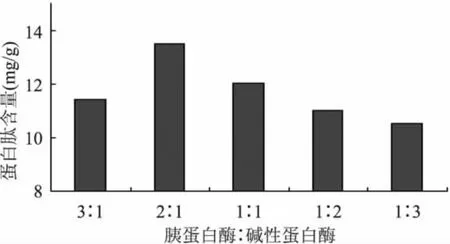
图2 不同比例复合酶酶解效果比较Fig.2 The comparison of hydrolyzates effects of different scale prolease
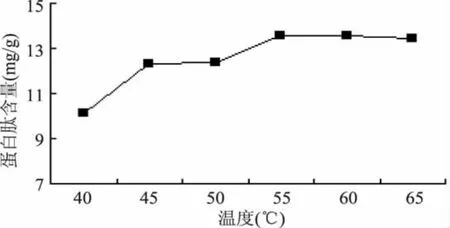
图3 温度对酶解效果的影响Fig.3 Influence of the temperature to extract the peptides
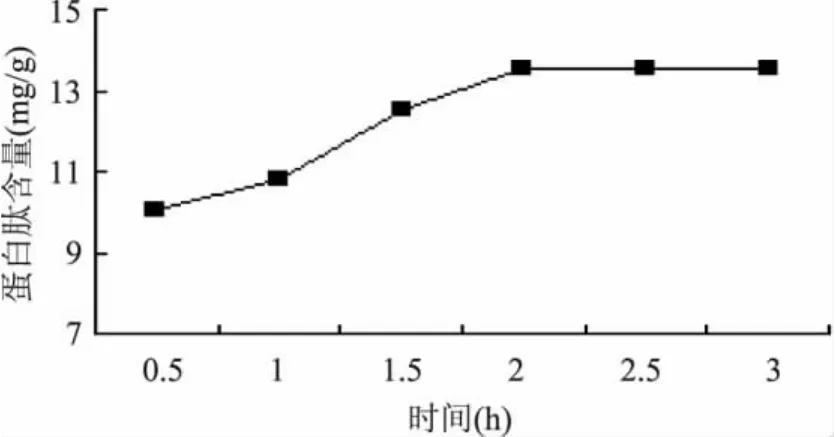
图4 时间对酶解效果的影响Fig.4 Influence of the time to extract the peptides
2.3.3 底物浓度对提取多肽的影响 由图5可知,在酶用量一定,且底物浓度在一定范围内,理论上讲底物浓度越大则酶与底物之间作用越频繁,酶解效果越佳。随着底物浓度的增加,底物相对于酶的浓度减少,当底物浓度达到9%(W/V)以后,底物的数量就趋于过剩,造成水解程度增加变缓慢。
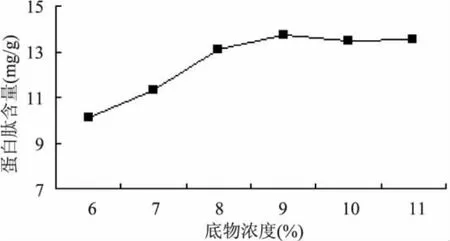
图5 底物浓度对酶解效果的影响Fig.5 Influence of the concentration to extract the peptides
2.3.4 酶用量对提取多肽的影响 由图6可知,随着酶量的增加,蛋白肽含量也不断增加。当酶量增加到一定值后,曲线的上升趋缓。酶用量的增加可以大大增加酶与底物结合的几率,从而增强水解程度。但其本身也是蛋白,也会发生酶解,所以量太大了则会干扰酶解物的组成。因此确定酶用量为0.4AU/g左右。

图6 酶用量对酶解效果的影响Fig.6 Influence of the enzyme dosage to extract the peptides
2.3.5 响应曲面分析 根据Box-Benhnken的中心组合实验设计原理,以酶解温度、酶解时间、底物浓度、酶用量为自变量,以蛋白肽含量为指标,设计四因素三水平响应曲面实验,结果见表2。
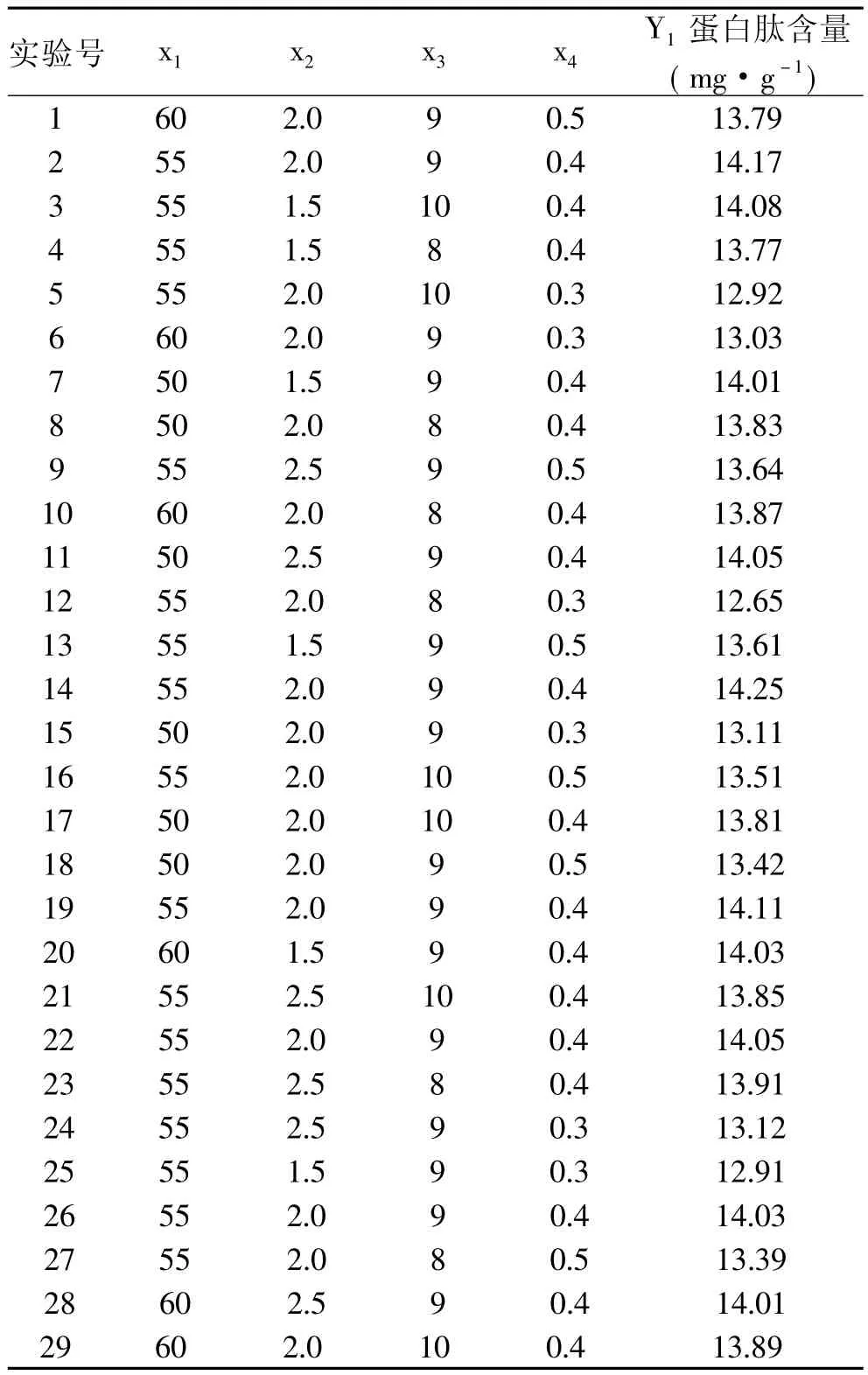
表2 响应曲面实验结果Table 2 Results of response surface test
由表3看出,多肽含量整体模型的P值均<0.0001,说明模型极显著,失拟项的P值是0.0665(大于0.05),说明实验方法是可靠的,使用这个模型模拟真实的四因素三水平的分析是可行的。相关系数R2=0.9819,表明水解效果的预测值与实际值之间具有较好的拟合度。其校正决定系数=0.9638,表明只有约3.37%的总变异不能用此模型来解释,模型的信噪比为23.013>4,进一步说明本模型设计是非常成功的。酶用量对指标的线性效应显著,影响顺序为酶用量>底物浓度>酶解温度>酶解时间。
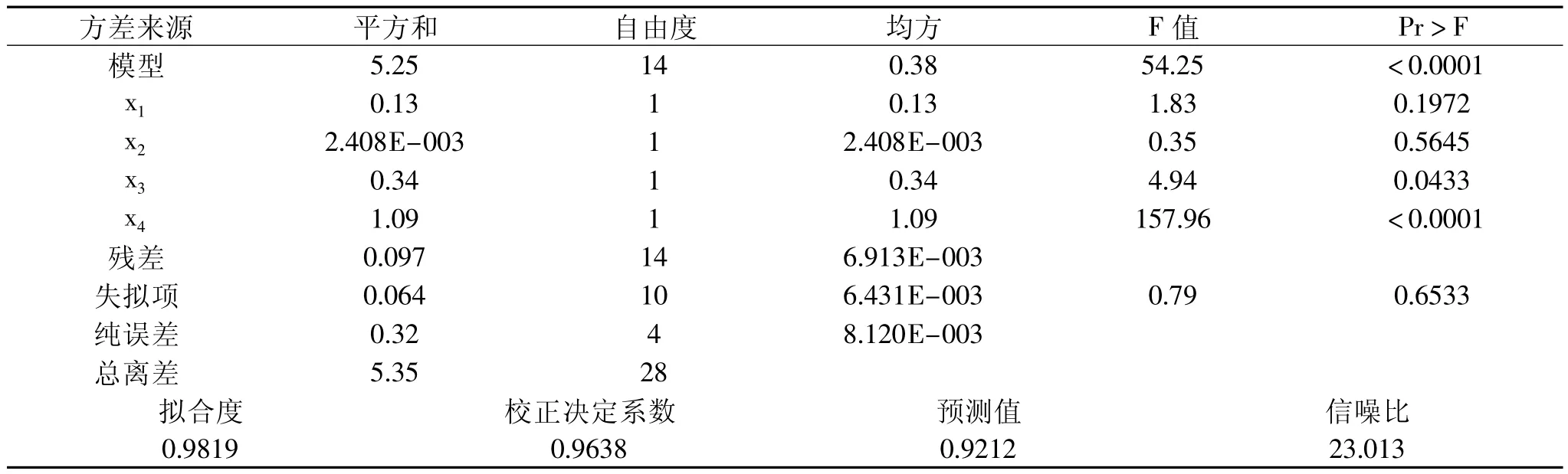
表3 蛋白肽含量方差分析表Table 3 Analysis of variance table
按照Box-Behnken实验设计的统计学要求,对实验进行回归拟合,实验设计及结果见表3。利用Design Expert软件,通过对表3中的数据进行分析,得到二次多项回归方程分别为:
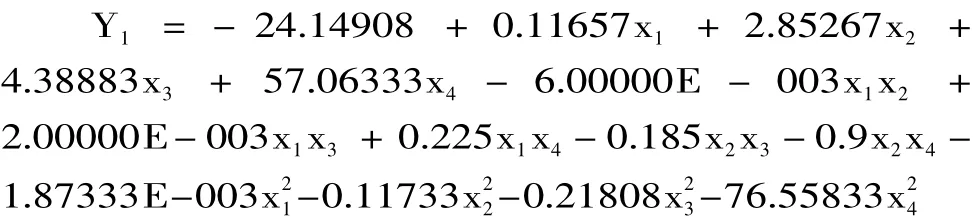
由回归方程可求得此曲面响应的最优方案为:温度为59.98℃,时间为1.5h,底物浓度为8%,酶用量为0.39AU/g。对响应面法优化结果进行验证实验:温度为60℃,时间为1.5h,底物浓度为8%,酶用量为0.4AU/g,在此条件下得到蛋白肽含量14.08mg/g,高于预测值3.15%。由此证明实验模型合理,实验结果理想。
2.4 HPLC法分离纯化豆粕多肽
采用HPLC法对豆粕多肽的酶解液进行分离纯化,得到的图谱如图7所示。
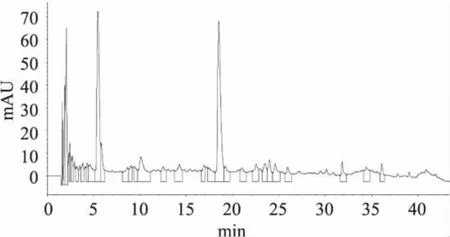
图7 豆粕多肽的酶解液的HPLC图谱Fig.7 HPLC chromatogram of hydrolyzates
经HPLC法分析得出:豆粕多肽酶解液出现许多峰,说明存在许多组分,其中在2.0、5.4、18.4min左右分离出三个组分(组分1、2、3)峰值最大。
2.5 豆粕多肽抗氧化性的测定
2.5.1 DPPH法 由图8可知,豆粕多肽的3个组分清除DPPH自由基的活性均与蛋白肽含量有良好的线性关系,得到各组分的拟合方程,组分1:Y1= 5.924X+16.532,R2=0.9028,IC50为5.65mg/g;组分2:Y1=4.3X+4.59,R2=0.9123,IC50为10.56mg/g;组分 3:Y1=3.906X+6.354,R2=0.9341,IC50为11.17mg/g;VC:Y1=7.192X+10.086,R2=0.938,IC50为5.55mg/g。表明在相同浓度下,组分1对清除DPPH自由基活性好于组分2、3,且与同浓度范围的VC相当。
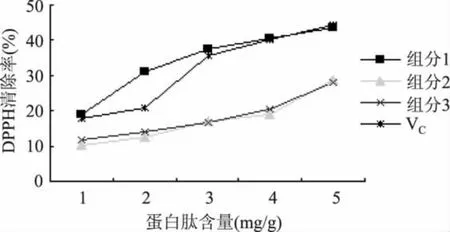
图8 豆粕多肽清除DPPH自由基活性Fig.8 Scavenging activity ofsoybean peptides on DPPH free radicals
2.5.2 脂质过氧化反应抑制作用 由图9可知,豆粕多肽的3个组分对脂质过氧化反应的抑制均与蛋白肽含量有良好的线性关系,得到各组分的拟合方程,组分 1:Y1=8.913X-1.933,R2=0.8982,IC50为5.83mg/g;组分2:Y1=5.948X-2.868,R2=0.8868,IC50为 8.83mg/g;组分 3:Y1=4.498X-1.318,R2= 0.8843,IC50为 11.41mg/g;VC:Y1=8.703X+0.951,R2=0.9465,IC50为5.64mg/g。表明在相同浓度下,组分1对脂质过氧化反应的抑制作用好于组分2、3,略逊于VC。
2.5.3 清除羟基自由基 由图10可知,豆粕多肽的3个组分对羟基自由基的清除作用均与蛋白肽含量有良好的线性关系,得到各组分的拟合方程,组分1: Y1=3.62X-2.572,R2=0.8429,IC50为14.52mg/g;组分2: Y1=2.895X-3.411,R2=0.827,IC50为18.45mg/g;组分3: Y1=2.078X-2.266,R2=0.8174,IC50为 25.15mg/g; VC:Y1=8.7X+8.09,R2=0.9372,IC50为4.82mg/g。表明相同浓度下组分1对脂质过氧化反应的抑制作用好于组分2、3,但各组分清除羟基自由基能力均不如VC。
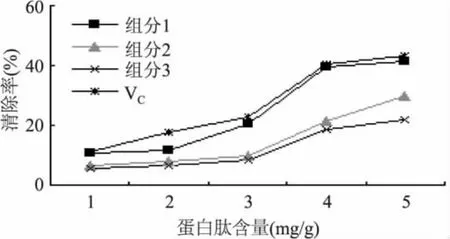
图9 豆粕多肽对脂质过氧化反应的抑制作用Fig.9 Inhibitory effect of soybean peptides on lipid peroxidation
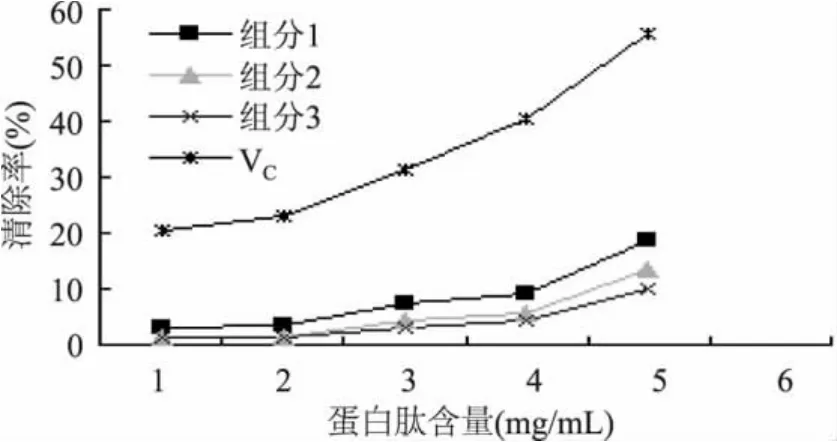
图10 豆粕多肽清除羟基自由基的活性Fig.10 Scavenging activity of soybean peptides on hydroxyl free radicals
2.5.4 各组分抗氧化性比较 由图11可知,酶解后的豆粕多肽各组分表现出一定的抗氧化性,其中清除DPPH自由基和抑制脂质过氧化物自由基能力较强,且分离出的组分1的抗氧化能力强于组分2、3,清除DPPH自由基和抑制脂质过氧化物自由基能力与VC相当。其原因可能主要由于各组分的分子量大小的影响。何荣等[22]在研究菜籽肽清除自由基能力时发现,分子质量越小的菜籽肽对DPPH自由基的清除能力越强。庞宗文等[23]用毛霉发酵豆粕后所产大豆肽分子质量主要集中在10ku以下。对于本实验结果还有待进一步的实验证实。

图11 各组分抗氧化性比较Fig.11 The comparison of antioxidation of components
3 结论
本实验以脱脂豆粕为原料,采用复合酶法制备抗氧化肽。响应面实验确定最佳酶解条件是:温度为60℃,时间为1.5h,底物浓度为8%,酶用量为0.4AU/g,在此条件下得到蛋白肽含量14.08mg/g。
在此条件下制备的豆粕多肽液经离心、超滤纯化后,采用高效液相色谱法分离,得到主要的3个组分。以清除DPPH自由基和羟基自由基及对脂质过氧化反应产物抑制作用等方法测定豆粕多肽的抗氧化性,结果表明:豆粕多肽的这3个组分均具有一定的抗氧化性,其中清除DPPH自由基和抑制脂质过氧化物自由基能力较强,抗氧化活性与其质量呈现良好的线性关系,且组分1的抗氧化效果好于其他组分,与VC相当。
[1]郑云兰,李霞辉.大豆营养分析技术[M].哈尔滨:黑龙江科学技术出版社,1997.
[2]李里特,王海.功能性大豆食品[M].北京:轻工业出版社,2003.
[3]汪建斌,邓勇.大豆多肽的生理功能及开发利用[J].广州食品工业科技,2001,17(3):52-53.
[4]潘进权,刘耘.大豆多肽研究概况[J].中国调味品,2003 (2):6-10.
[5]刘传富,董海洲,刘晓婷.大豆多肽及其在食品工业中的应用[J].粮食与油脂,2002(10):31-32.
[6]Thomas M Badger,Martin J J Ronis,Reza Hakkak,et al.The health consequences of early soy consumption[J].J Nutr,2002,132:359-361.
[7]陈美珍,余杰,郭慧敏.大豆分离蛋白酶解物清除羟自由基作用的研究[J].食品科学,2002,23(1):43-47.
[8]黄莉,江连洲,朱秀清.大豆蛋白抗氧性肽的研究[J].大豆通报,2005(5):20-21.
[9]安毅,张君文.大豆蛋白活性肽在功能性食品中的应用及发展前景[J].大豆通报,2004(4):27-29.
[10]Hellers M.Antimitotic peptid characterized from soybean: role in proection from cancer[J].Nutr Rev,1999,57(11): 359-361.
[11]胡文琴,王恬,孟庆利.抗氧化活性肽的研究进展[J].中国油脂,2004,29(5):42-45.
[12]Mark J Messina,Charies L.Loprina soy for breast cancer survivors:A critical review of the literaturel[R].American Institute for Cancer Research 11thAnnual,Research Conference on Diet,Nutrition and Cancer,2001.
[13]Prokomy R.Naturalantioxidantsforfooduse[J].Trends Food Sci Technol,1991(2):223-227.
[14]涂宗财,黎鹏,刘成梅,等.复合酶法制备植物小分子肽的研究[J].食品工业科技,2008,29(4):169-170,173.
[15]高梅娟,刘平,兰小红,等.双酶酶解豆粕蛋白制备低苦味肽[J].食品工业科技,2010,31(2):193-196.
[16]张艳萍,戴志远,张虹.紫贻贝酶解物中降血压肽的超滤分离[J].食品与发酵工业,2010,36(9):47-51.
[17]夏明,应铁进.高效液相色谱检测乳制品中如铁蛋白含量[J].食品科学,2010,31(2):165-167.
[18]BRAND-WILLIAMS W,CUVELIER M E,BERSET C.Use of a free radical method to evaluate antioxidant activity[J]. Lebensmittel-Wissenschaft und-Technogie,1995,28(1): 25-30.
[19]ZHANG Liangshuan,WANG Xuan,DONG Lulu. Antioxidation and antiglycation of polysaccharides from Misgunus anguillicandatus[J].Food Chemistry,2010,124(1):183-187.
[20]秦卫东,陈学红,马利华,等.黑曲霉发酵豆粕制备抗氧化肽研究[J].食品科学,2010,31(23):289-293.
[21]鲁伟,任国谱,宋俊梅.蛋白水解液中多肽含量的测定[J].食品科学,2005,26(7):169-171.
[22]何荣,鞠兴荣,袁建,等.固态发酵生产菜籽肽及其清除自由基能力的研究[J].食品科学,2009,30(19):259-262.
[23]庞宗文,李敏,李树波,等.产蛋白酶毛霉的分离筛选及发酵豆粕产大豆肽的初步研究[J].现代食品科技,2010,26(9): 956-961.
Perparation of antioxidant peptides from soybean meal by complex enzyme
MA Li-hua,QIN Wei-dong*,CHEN Xue-hong
(Food Engineering College of Xuzhou Institute,Xuzhou 221008,China)
The optimal conditions of oxidationresist soybean peptides by complex enzyme were investigated with RSM.The zymohydrolysis supernatant of soybean peptide were separation and purification by HPLC and its inoxidability were determined.The results showed that the optimal zymohydrolysis proportion was:trypsinase:alkali protease 2∶1,temperature 60℃,time 1.5h,the concentration 8%,enzyme dosage 0.4AU/g,the contents of oxidationresist soybean peptides was 14.08mg/g.The zymohydrolysis supernatant of soybean meal were three component with HPLC,and fraction 1 was superior to others.
complex enzyme;soybean peptide;RSM;inoxidizability
TS201.2+1
B
1002-0306(2012)06-0340-06
2011-06-13 *通讯联系人
马利华(1966-),女,硕士,副教授,研究方向:天然产物的研究与食品加工。
