注射用糜蛋白酶的比活与纯度研究
2012-10-19上海医药工业研究院200040史卓维
上海医药工业研究院(200040)史卓维
上海市食品药品检验所(201203)史芳亮 陈钢Δ
糜蛋白酶(Chymotrypsin),又称胰凝乳蛋白酶,系从牛或猪胰腺中提取的一种蛋白水解酶,具有肽链内切酶的作用,临床上主要用于眼科手术,也可用于创口或局部炎症,以减少局部分泌和水肿[1]。注射用糜蛋白酶为无菌冻干粉末,辅料为20%甘露醇和右旋糖酐20,现行质量标准为2010版中国药典。
比活是单位蛋白质重量下的酶活力,它是在理化方法无法控制酶的纯度或有关物质时可采用的最有效的控制酶纯度的方法之一。由于注射用糜蛋白酶现行质量标准中仅有效价测定,而没有比活或者纯度检查项,因此无法对企业低效价原料多投料的情况进行监控,从而可能对患者的用药安全性造成潜在危害。目前,国内外文献尚未有注射用糜蛋白酶比活测定与纯度测定方法的报道。本文旨在分别建立一种适用于注射用糜蛋白酶比活测定的方法以及RP-HPLC纯度测定方法。
1 仪器与试药
Agilent 1200高效液相色谱仪(美国安捷伦公司),LC-20A型高效液相色谱仪(日本岛津公司),Spectra max 340pc酶标仪(美国分子仪器公司),Foss Kjeltec 2400自动凯氏定氮仪(瑞典FOSS公司),UV-2550紫外可见分光光度计(日本岛津公司),瑞士Mettler Toledo AB204-S电子天平(瑞士梅特勒-托利多公司),Grace 214TP C4色谱柱(250mm×4.6mm,5μm,美国格雷斯公司)。

附表1 凯氏定氮法加样回收率测定结果

附表4 注射用糜蛋白酶RP-HPLC纯度测定结果
考马斯亮蓝试剂盒(货号23200,美国Thermo公司),BCA试剂盒(货号QPBCA,美国Sigma公司),牛血清白蛋白标准品(BSA,批号14619-200919,中国药品生物制品检定所),USP糜蛋白酶标准品(货号1134007,美国药典会),硫酸铜、酒石酸钠、氢氧化钠、碳酸钠、硫酸铵均为分析纯,乙腈、三氟乙酸为色谱纯,水为去离子水。
注射用糜蛋白酶共5个批号,规格均为4000单位/瓶,批号为20090709、20110315、20110316和批号为0905031、1101021的制剂来自两家国内生产企业。
2 比活测定方法
比活是单位蛋白质重量下的酶活力,因此要分别测定每瓶制剂中的总蛋白量以及酶活力(即效价)。
2.1 凯氏定氮法 取各批号样品5瓶,用适量水完全转移至定氮管中,120℃浓缩至5ml左右后,参照中国药典2010版二部附录Ⅶ M蛋白质测定法中的凯氏定氮法测定总氮,按照中国药典2010版三部附录Ⅵ B中三氯乙酸法测定非蛋白氮。根据公式:蛋白氮=总氮-非蛋白氮、真蛋白=蛋白氮×氮转换为蛋白质的系数6.25[2]计算得到每瓶制剂中所含的总蛋白量。
2.2 考马斯亮蓝法(Bradford法)、2,2’-联喹啉-4,4’-二羧酸法(BCA法) 将各批号样品用水稀释至蛋白质浓度为250μg/ml和10μg/ml左右,然后分别参照Bradford和BCA试剂盒说明书进行蛋白质含量测定。
2.3 福林酚法 将样品用水稀释至蛋白质浓度为100μg/ml左右,参照中国药典2010版二部附录Ⅶ M蛋白质测定法中的福林酚法进行操作。
2.4 比活计算 按照2010版中国药典二部中注射用糜蛋白酶效价测定项下的方法对5批制剂进行效价测定,再结合所测得的总蛋白量计算比活,公式:比活(单位/mg)=效价(单位/瓶)/蛋白质含量(mg/瓶)。
3 纯度测定方法
3.1 溶液的制备
3.1.1 对照品溶液 取USP糜蛋白酶标准品,加0.1%三氟乙酸水溶液溶解并稀释制成1mg/ml的溶液。
3.1.2 供试品溶液 取样品,加0.1%三氟乙酸水溶液溶解并稀释制成每1ml中约含1000单位的溶液。
3.1.3 空白辅料溶液 按2家生产企业的处方称取辅料,用0.1%三氟乙酸水溶液溶解并稀释制成不含糜蛋白酶的空白辅料溶液。
3.2 色谱条件 色谱柱采用Grace 214TP C4色谱柱(250mm×4.6mm,5μm),流动相为0.09%三氟乙酸水溶液(A)和0.1%三氟乙酸乙腈(B),梯度洗脱[0~5min,A:B维持95:5不变;5~30min,A:B比例从95:5下降至40:60;30~40min,A:B比例维持40:60不变],流速1.0ml/min,检测波长214 nm,进样量10μL,柱温30℃。
4 比活结果
4.1 辅料干扰试验 由于甘露醇与右旋糖酐20均不含氮元素,因此不会对凯氏定氮法造成影响。采用考马斯亮蓝法对空白辅料溶液进行测定时,辅料溶液无紫外吸收。而采用BCA法和福林酚法时,空白辅料溶液有明显紫外吸收,因此会影响样品的测定,故排除BCA法和福林酚法,仅对凯氏定氮法和考马斯亮蓝法进行进一步的试验。
4.2 方法学试验
4.2.1 准确度 用水分别准确转移5瓶供试品(批号20090709)至定氮管中,按低、中、高浓度分别精密加入10.0mg/ml的硫酸铵溶液0.5ml,1.0ml,1.5ml,参照“2.1”项下方法操作。所得的加样回收率结果见附表1。
取供试品(批号20090709)用水溶解并稀释成蛋白质浓度约为250μg/ml的溶液,取该溶液1ml,分别与250μg/ml的BSA蛋白标准品0.5ml,1.0ml,1.5ml混匀后,按考马斯亮蓝试剂盒说明书上方法操作,所得加样回收率的结果见附表2。
4.2.2 精密度
4.2.2.1 重复性 取供试品(批号20090709)5瓶,参照“2.1”项下方法连续测定6次,滴定蛋白氮所消耗的硫酸量的SD为0.2054,RSD为1.25%,置信度为0.95的置信区间为[16.1870,16.5972]。
取供试品(批号20090709),用水溶解并稀释成蛋白质浓度约为200μg/ml的溶液,参照考马斯亮蓝试剂盒说明书方法上连续测定6次,测得吸光度的SD为0.005,RSD为0.89%,置信度为0.95的置信区间为[0.518,0.528]。
4.2.2.2 中间精密度

附表2 考马斯亮蓝法加样回收率测定结果
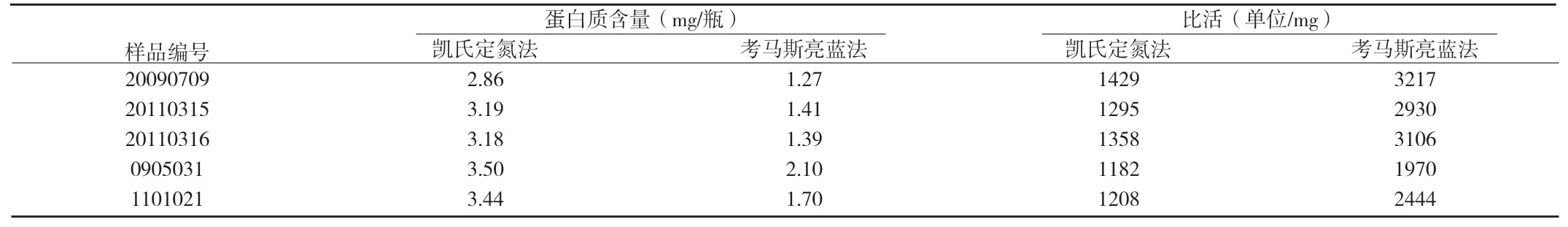
附表3 注射用糜蛋白酶的蛋白质含量和比活结果
取供试品(批号20090709),参照“2.1”项下方法每天平行测定6次,连续测定3d,记录消耗的硫酸量并计算蛋白质含量,日间精密度RSD为0.95%。
取供试品(批号20090709),用水溶解并稀释成蛋白质浓度约为200μg/ml的溶液,参照考马斯亮蓝试剂盒说明书方法上每天平行测定6次,连续测定3d,记录吸光度值并计算蛋白质浓度,日间精密度RSD为1.33%。
4.2.3 考马斯亮蓝法线性考察 照考马斯亮蓝试剂盒说明书配制标准曲线,日内重复配制并测定5次,以BSA的浓度为横坐标,吸光度为纵坐标绘制标准曲线,回归方程为Y=0.0007X+0.0135,相关系数为0.9978。
4.2.4 考马斯亮蓝法耐用性 试验中发现,标准品和供试品与考马斯亮蓝试液混合后,颜色均会随着放置时间的增加而加深,但对标准曲线的线性和蛋白质含量结果的计算并没有影响。因此,为了保证结果的准确性,每次进行蛋白质含量测定时,都要平行绘制标准曲线。
4.3 样品测定结果 采用凯氏定氮法和考马斯亮蓝法测得的蛋白质含量结果与计算得到的比活结果见附表3。我们对两种方法得到的蛋白质含量结果进行直线相关性分析,发现二者存在较显著的正相关(r=0.875,P<0.01,n=5)。
5 纯度结果
5.1 方法选择性 本文考察了2家生产企业的空白辅料处方溶液,均无干扰。主成分与相邻杂质的色谱峰均能达到基线分离,分离度大于1.5。
5.2 破坏性试验 取样品(批号20110316),分别加入0.1mol/L氢氧化钠溶液1.0ml、0.1mol/L盐酸溶液1.0ml和30%过氧化氢溶液1.0ml,放置1小时,再加入0.1mol/L盐酸溶液1.0ml、0.1mol/L氢氧化钠溶液1.0ml和0.1%三氟乙酸水溶液1.0ml,混匀,分别作为碱、酸、氧化破坏的样品溶液,另取同一批号样品于60℃水浴中放置1小时,再加0.1%三氟乙酸水溶液2ml,作为热破坏试验的样品溶液。将以上溶液按“3.2”项下的色谱条件进样,结果表明,样品对碱、氧化最不稳定,其次为酸,样品对热最稳定。30%过氧化氢可使样品直接沉淀变性。各降解产物与主成分峰均有良好分离,不影响纯度的测定。
5.3 精密度试验 取“3.1.1”项下的糜蛋白酶对照品连续进样6次,记录色谱图,峰面积的RSD为0.07%。
5.4 重复性试验 按“3.1.2”项下配制6份供试品(批号20110316)溶液,连续进样6次,记录色谱图,样品纯度的RSD为0.11%。
5.5 溶液稳定性试验 取“5.4”项下供试品溶液,置4℃恒温的Agilent 1200高效液相色谱仪自动进样器中放置,分别于0、3、6、9、12、15、18、24小时进样分析,记录色谱图,按峰面积归一化法计算纯度。8次测得的纯度结果的平均值为86.59%,RSD=0.14%,说明样品在0.1%三氟乙酸流动相中稳定。
5.6 样品测定 取样品,照“3.1”项下方法配制溶液后,精密量取各10μL注入液相色谱仪,记录色谱图。按归一化法计算主峰的纯度,各批号样品的纯度结果见附表4。
5.7 比活与纯度结果的数据统计 将凯氏定氮法得到的制剂比活与用RP-HPLC法测得的纯度结果进行直线相关性的考察,发现二者存在显著的正相关,r=0.940,P<0.01,n=5。
6 讨论
6.1 蛋白质含量测定方法的选择 通过辅料干扰试验发现,福林酚法和BCA法均不适用于该品种的制剂测定,而考马斯亮蓝法和凯氏定氮法无辅料干扰,可以用于注射用糜蛋白酶的蛋白质含量测定。
考马斯亮蓝法测得的总蛋白质含量明显低于凯氏定氮法,这可能是由于反应机制造成的,据报道[3],采用考马斯亮蓝法对碱性蛋白酶酶解前后的牛血清白蛋白进行含量测定,发现酶解后的蛋白质含量测定值大幅度下降,说明当供试品中含有混合蛋白质和多肽时,考马斯亮蓝法仅对蛋白质有显色反应。由于待测样品是主成分与杂蛋白和杂多肽的混合物,我们要测的总蛋白量不仅包括大分子蛋白还包括样品中的杂多肽,因此凯氏定氮法更适合注射用糜蛋白酶中总蛋白量的测定。
6.2 比活与纯度的相关性考察 比活与纯度结果的数据统计显示二者存在显著的正相关,由于酶的提取效果越好,纯度也越高,单位蛋白质重量下的活力(即比活)也高,提高比活即提高了该酶的纯度,而比活或纯度值越高,酶制剂所投原料的质量就越高。由于本品纯度较高,能够通过液相色谱方法进行纯度控制,考虑到方法的简便性,可以用纯度代替比活来控制原料质量。对于其它组分较为复杂的生化类药物,在没有理化手段控制样品纯度时,则可以通过测定比活来监控制剂的投料质量及控制纯度。
7 小结
本文通过对各种蛋白质含量测定法的筛选[4],最终选定凯氏定氮法用于注射用糜蛋白酶中总蛋白质含量的测定,并计算出比活。同时也建立了RP-HPLC测定注射用糜蛋白酶纯度的方法。两法所得结果间存在着显著的正相关,即比活越高,纯度越高。对于多组分的生化药物,在主成分能与杂质分离的情况下,可采用纯度法来控制投料质量,而对于成分复杂无法用理化手段控制质量的样品,则可考虑用比活代替纯度来进行质量控制。
