人端粒酶逆转录酶基因转染对犬髓核细胞生物学活性的影响
2012-10-16辛洪奎王德利吴剑宏王超峰阮狄克
辛洪奎,张 超,王德利,吴剑宏,王超峰,何 勍,阮狄克
椎间盘退变所导致的椎间盘突出、椎管狭窄等疾病是临床常见病。传统外科治疗手段存在可能的稳定性丢失及相邻节段退变等不足。近年来再生医学的迅速发展,启发了从事骨科临床及基础研究工作的学者们以重建的角度审视椎间盘退行性疾病,积极探索通过生物技术修复甚至重建病变的椎间盘,以期在不远的将来代替传统治疗措施。椎间盘退变最为重要的机制就是髓核组织内细胞数量的减少及活性的降低[1],从这一角度来说,通过补充退变髓核内的细胞数量来修复椎间盘退变是良好的选择。本课题小组前期开展了以髓核细胞为基础的组织工程技术修复退变椎间盘的探索性研究[2],研究结果提示通过组织工程手段将髓核细胞植入退变椎间盘内的确可以起到延缓退变的效果。虽然髓核细胞增殖能力的有限性及其体外培养的去分化现象限制了其在这一领域的应用前景[3-4],但天然髓核细胞表型的固有优越性是其他细胞来源如骨髓间充质干细胞、脂肪干细胞无法比拟的,因此需通过适当的技术手段促进髓核细胞的活性及其增殖能力。
本研究通过人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)基因转染的方式将外源性基因导入髓核细胞,以期获得增殖能力及生物学活性更强的细胞作为椎间盘退行性疾病生物治疗的种子细胞。在完成基因转染后,拟通过目的基因表达及细胞功能蛋白表达水平评估hTERT基因对犬髓核细胞生物学活性的影响。
1 材料与方法
1.1 犬髓核细胞的体外培养 8周龄幼犬,肌内注射氯胺酮与速眠新麻醉,按背部正中切口备皮及消毒,切开皮肤及皮下组织,分离椎旁肌,切断肋骨,离断胸段及腰段脊柱,水平切开椎间盘,刮取胶冻状髓核置于15 ml离心管中,2 g/L胶原酶(GIBCO公司,美国)消化2 h后1 000 r/min离心5 min,磷酸盐缓冲液(phosphate buffered solution,PBS)冲洗 2 次,收集细胞接种于100 ml培养瓶,加入含10%胎牛血清(fetal bovine serum,FBS)的F12培养基(GIBCO公司,美国),37℃,5%CO2,饱和湿度下培养,倒置显微镜观察生长情况。细胞贴壁生长后换液,每周换液2次,细胞融合单层后传代,取传2代细胞作为种子细胞进行基因转染。
1.2 rAAV2-hTERT体外转染髓核细胞 本实验所使用2型重组腺相关病毒(recombinant adeno-associated virus type-2,rAAV2)-hTERT病毒载体由北京五加和生物技术有限公司完成。病毒滴度=1×1012cfu/ml。实验分组:实验组用 rAAV2-hTERT病毒载体以复合感染(multiplicity of infection,MOI)为1×105v.g/cell转染犬髓核细胞;rAAV2-EGFP(enhanced green fluorescent protein,增强绿色荧光蛋白)病毒以相同的MOI转染髓核细胞作为阴性对照。具体的转染方法:6孔板内单层培养的传2代髓核细胞达80%融合后,弃去上清,PBS漂洗3次,取1孔细胞消化计数以确定每个培养孔所需病毒数量。向每个培养孔内加入适量病毒使得转染复数保持于1×105v.g/cell。向每孔内加入达尔伯克改良伊格尔培养基(Dulbecco's modified Eagle's medium,DMEM)2 ml,37℃,5%CO2,饱和湿度下孵育 2 h 完成病毒转染。2 h后弃去上清,PBS漂洗3次,10%FBS,37℃,5%CO2,饱和湿度下培养。转染后的细胞3 d换液1次,转染后5 d起激光共聚焦显微镜(Bio-Rad Radiance 2100TMconfocal system in conjunction with a Nikon TE300 microscope)观察EGFP表达情况。
1.3 转基因髓核细胞hTERT蛋白及mRNA的表达
1.3.1 反转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)检测 hTERT mRNA的表达 在转染后5、10、15、30 d以及60 d分别收集实验组及对照组细胞,Trizol法提取总RNA。利用AMV逆转录酶random dT primer和AMV逆转录酶在42℃条件下孵育1 h,将RNA反转录成cDNA,以cDNA为模板在PCR仪上进行PCR反应检测基因转染后髓核细胞hTERT mRNA的表达,选择犬甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参。RT-PCR引物序列为:

对于PCR产物以2%的琼脂糖凝胶电泳检测。溴化乙锭(ethidium bromide,EB)染色后紫外灯下观测,hTERT mRNA的阳性表达可扩增出128 bp的阳性条带。采集结果,并进行目的条带与内参条带之间的灰度值比较,对结果进行半定量分析。
1.3.2 Western-blot检测hTERT蛋白的表达 转染后5、10、15、30 d以及60 d分别收集实验组及对照组细胞,冷PBS洗涤3次后加入预冷的细胞裂解液裂解(1%髓核细胞40.20 mmol/L三羟甲基氨基甲烷 Tris pH 7.4,150 mmol/L NaC1,10% 甘油,1 mmol/L苯甲基磺酰氟,10 ml抑菌肽,1 g/ml亮肽素,500 mmol/L正矾酸钠)。混匀,冰上放置30 min后4℃ 12 000×g离心20 min,提取总蛋白,Bio-Rad酶定量法蛋白定量后调整蛋白浓度一致。94℃变性10 min。配制150 L的聚丙烯酰胺分离胶,每孔上样60 μg蛋白,8%十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)电泳分离蛋白后,转移至硝酸纤维素膜,5%的脱脂牛奶封闭l h后,以鼠抗 hTERT(Abcam公司,美国)单克隆抗体4℃孵育过夜。Tris缓冲液(Tris buffered saline,TBS)/0.1%聚氧乙烯山梨醇单月桂酸酯(Tween)-20洗涤3次后,加入辣根过氧化物酶标记的羊抗兔/鼠(1∶2 000),37℃孵育l h,TBS/0.1%Tween-20洗膜后,用增强化学发光法检测目的条带的表达。图像扫描进行Western blot免疫印迹分析。另配置120 g/L的分离胶,按传统方法作为内参GAPDH的Western-blot免疫印迹。以发光条带的灰度值进行半定量分析。
1.4 实时定量PCR法检测PG及COL1、COL2 mRNA含量 实时定量(real-time quantitative)PCR法是目前被广泛应用的具有较高准确性及较强可重复性的检测目的基因mRNA表达的方法。其原理为SYBR Green荧光染料在双链DNA中可发出荧光,且荧光强度在一定范围内与DNA双链数量成正比。通过使用实时定量PCR热循环仪(MinOpticon real-time PCR,Bio-Rad)检测荧光强度对mRNA含量进行半定量分析。本研究选择对基因转染后的髓核细胞表达的PG及COL1、COL2 mRNA行实时定量PCR分析。在转染后5、10、15、30 d以及60 d分别收集实验组及对照组细胞,细胞各自混匀后,Trizol法提取各组RNA,反转录成cDNA,方法同前,以cDNA为模板,按照SYBR Premix Ex Taq试剂盒说明书进行操作,ABI 7500实时荧光定量PCR仪上进行PCR反应。使用GAPDH作为内参对PG及COL1、COL2 mRNA的含量进行标准化。
1.5 酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法检测Ⅱ型胶原及蛋白多糖表达量 于基因转染后的5、10、15、30 d以及60 d,收集达80%~90%融合的细胞培养液上清2 ml,每组细胞平均取3孔细胞培养上清,将脑源性神经营养因子(brain deried neurotrophic factor,BDNF)标准品和细胞培养上清液加人96孔板,每个样品设3个复孔。牛Ⅰ型和Ⅱ型胶原蛋白(Sigma-Aldrich公司,美国)溶液配制Ⅰ型和Ⅱ型胶原蛋白标品,分别加入96孔板。4℃孵育过夜,0.01 mol/L PBS和0.5%Tween-20洗涤后1%牛血清室温下封闭1 h。0.01 mol/L PBS和0.5%Tween-20洗涤,以鼠源性Ⅰ型、Ⅱ型胶原单克隆抗体(1∶1 000,Sigma-Aldrich公司,美国)室温下孵育2 h,0.01 mol/L PBS和 0.5%Tween-20洗涤。抗鼠 IgG抗体 (Sigma-Aldrich公司,美国)室温下孵育1 h,再次洗涤后,以交联磷酸酶的生物素(Sigma-Aldrich公司,美国)孵育1 h,每孔中加入p-nitrophenyl phosphate(Sigma-Aldrich公司,美国)20 μl孵育 20 min,3 mol/L NaOH 中和反应,置入酶标仪(Bio-Rad公司,美国)中,读取405 nm处吸光度,按绘制的标准曲线计算各样本中Ⅱ型胶原及蛋白多糖含量。
1.6 统计学处理 应用统计软件SPSS 13.0进行统计分析。计量资料用均数±标准差(±s)表示,各组均数间的比较用方差分析,均数间两两比较用q检验,P<0.05为差异有统计学意义。
2 结果
2.1 犬髓核细胞的分离培养及荧光标记 8周龄幼犬髓核呈半透明胶冻状。经胶原酶消化2 h后,大量椎间盘细胞可被分离出来形成细胞悬液。接种培养瓶后48 h内细胞即可贴壁伸展。镜下可见细胞胞质丰富,胞体饱满,呈短梭形,有2个或2个以上长短不一的突起,并随培养时间延长而向外延展(图1)。原代椎间盘细胞生长迅速,培养1周即可铺满瓶底80%,达到传代要求。随传代次数增加,细胞极性逐渐增强,呈长梭形,似成纤维细胞,生长变缓。
图1 传2代犬髓核细胞
2.2 rAAV2病毒载体体外转染髓核细胞 以rAAV2-EGFP作为标记基因的测定结果显示,使用rAAV2可成功转染犬髓核细胞,EGFP可在被转染髓核细胞中正确表达。在转染后的第10天,EGFP的表达达到高峰,随着细胞传代次数的增加,其表达量逐渐减低,至第30天时其表达量明显减少(图2)。rAAV2-hTERT转染髓核细胞后5 d,即可检测到hTERT mRNA及蛋白的表达,而阴性对照组未检测到相应mRNA及蛋白的表达(图3、4)。
2.3 hTERT基因表达结果的动态检测 在转染后5、10、15、30 d 以及 60 d,均可于基因和蛋白水平检测到hTERT基因在髓核细胞内的表达,而在所有观察时间点内,对照组未能检测到hTERT基因表达。通过对不同时间点的实验组细胞进行目的条带与内参条带灰度值的比较显示,转染后第10天hTERT基因的表达的相对水平最高,而随着细胞传代次数的增加,hTERT基因表达的相对水平也逐渐降低(图5)。

图2 激光共聚焦显微镜观察EGFP在髓核细胞中的表达

图3 RT-PCR检测rAAV2-hTERT转染后5 d髓核细胞hTERT mRNA的表达

图4 Westernblot检测rAAV2-hTERT转染后5 d髓核细胞hTERT蛋白的表达
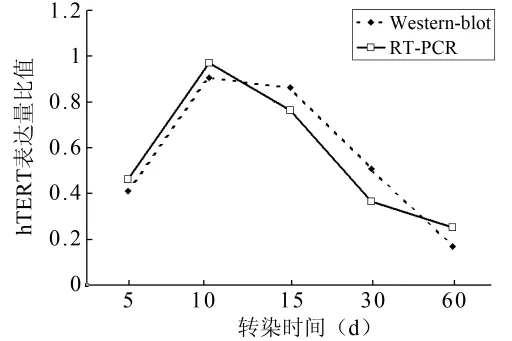
图5 实验组髓核细胞hTERT基因表达结果的动态观察
2.4 实时定量PCR法检测PG及COL1、COL2 mRNA含量 实时定量PCR检测结果显示:rAAV2-hTERT转染后第5天,实验组细胞PG及COL1、COL2 mRNA含量较EGFP对照组未见明显增加;而在转染后的第10天,实验组PG、COL2 mRNA的表达量分别较对照组增加了62%和50%(P<0.05);而这一mRNA表达量的增加在随后的观察中继续升高,在第15天分别达到了最高的132%和87%(P<0.05)。15 d后,虽然mRNA表达量增加的幅度较最高峰有所下降,但仍明显高于对照组细胞的mRNA表达(P<0.05)。而对COL1 mRNA表达的分析可见虽然实验组髓核细胞转染后COL1 mRNA表达量有小幅增加,但同对照组相比无明显差别,结果无统计学意义(P>0.05)。见图6。

图6 PG及COL1、COL2 mRNA表达量的实时定量PCR分析
2.5 蛋白多糖及Ⅱ型胶原表达量的检测 通过ELISA法对蛋白多糖及Ⅱ型胶原表达量的分析提示:rAAV-hTERT在转染后第5天,实验组细胞PG、COL2的表达量较EGFP对照组未见明显增加;而在转染后的第10天,实验组PG、COL2的表达量显著增加,并在第15天达到52.48 ng/ml及4.69 ng/ml的高值。在30 d和60 d时,实验组PG、COL2的表达量仍维持在较高水平;对照组细胞随着培养时间及代次的延长,在第30天后蛋白多糖表达量出现较为明显的下调。通过单因素方差分析进行两组间的统计比较,自第10天至第60天,实验组PG、COL2的表达量均明显高于对照组(P<0.05)。见图7、8。
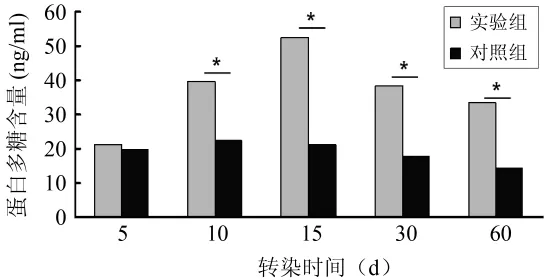
图7 PG表达量的ELISA分析

图8 COL2表达量的ELISA分析
3 讨论
许多因素在椎间盘退变的过程中发挥重要作用,包括年龄、吸烟、喝酒、机械应力、营养缺乏以及遗传因素等[5-7]。椎间盘退变的实质是椎间盘组织及细胞在这些因素的作用下所产生的一系列复杂病理生理改变。首先出现的是髓核内细胞数量的不足或由于缺乏足够的营养导致的细胞功能的下降[8],这引起细胞外基质成分Ⅱ型胶原及蛋白多糖等表达量的降低,从而导致髓核及纤维环组织强度及韧性的减低,在外力的作用下更易发生纤维环或髓核组织的破坏,继发椎间盘突出、椎管狭窄等退变相关疾病,引起临床症状,从而影响患者工作及生活。
运用生物技术手段延缓甚至逆转椎间盘退变的进展,从结构及功能上实现椎间盘的修复重建,理论上具有巨大的优势。椎间盘退变最直接的原因在于椎间盘内细胞数量的减少及活力的下降。因此,通过生物技术增强椎间盘内细胞的活力或直接增加细胞的数量具有相当的可行性。
20世纪90年代医学研究成果证实[9-10],端粒长度会随着细胞的分裂增殖而逐渐缩短,细胞每增殖1倍,端粒长度可能会损失50~200个核苷酸,而当端粒缩短到一定程度时,则会导致细胞的死亡[11]。端粒酶是一种RNA和蛋白质构成的复合体,具有逆转录酶的活性,它能以自身RNA(人端粒酶反向hTR)为模板,从头合成端粒DNA并加到染色体末端,维持染色体的稳定性[12]。运用hTERT来延长细胞的生命周期是近年来发现的一种新促进细胞增殖的方法。迄今为止学者们已经利用hTERT基因成功构建了多种组织“永生化”细胞[13-14]。同时,相关研究表明hTERT基因转染在促进细胞生物学活性的同时可有效避免致瘤性的出现[15]。本实验借鉴上述研究的成功经验,拟通过 rAAV2病毒将hTERT基因转入髓核细胞,以期促进髓核细胞的增殖能力及表型维持,为椎间盘退行性疾病的生物治疗提供较为理想的种子细胞选择。通过转染后第5天对实验组细胞hTERT基因及蛋白表达的分析,证实rAAV2-hTERT病毒载体可成功转染犬髓核细胞并实现表达hTERT基因及蛋白的目的。
永生化细胞的实质是细胞获得了无限增殖的能力。从这一意义上来说,除了肿瘤细胞之外,目前多数“永生化”的细胞都只是相对的,即细胞的增殖潜能被相对放大,并非真正意义上的永生化。本研究使用rAAV2-hTERT病毒载体转染髓核细胞的目的在于使髓核细胞获得更长的生命周期,在其生命周期内,可以更好地维持细胞表型,实现更长时间的功能表达,而不是一味追求将其“永生化”。实验中我们发现rAAV2-hTERT转染后的60 d之内,hTERT基因及蛋白的表达得到了很好的保持,其高峰出现在转染后的第10天,虽然此后有一定程度下降,但在第60天仍可以明显地观察到其阳性表达。我们认为hTERT基因及蛋白表达在第10天之后出现下调的原因在于随着培养时间的延长及传代次数的增加,rAAV2-hTERT阳性转染细胞逐渐丢失,从而降低了其调节髓核细胞活性的效率。峰值之后hTERT基因及蛋白表达的下行趋势进一步证实使用rAAV2-hTERT转染髓核细胞无法实现真正意义的永生化,而是相对于未处理的髓核细胞,获得了更长的生命周期。
hTERT基因转染髓核细胞及其mRNA与蛋白的表达只是本研究的第一步,基因转染的目的是获得活力更强的种子细胞以进一步探索椎间盘退行性疾病的生物治疗。同对照组相比,实验组细胞Ⅱ型胶原及蛋白多糖表达量的显著上调充分验证了hTERT蛋白对于体外培养的髓核细胞表型及功能的良好维持。Ⅱ型胶原和蛋白多糖是椎间盘细胞外基质的重要组成成分,当髓核细胞由于发生退变而导致两者表达量下降时,椎间盘的结构和形状就会发生改变,从而降低其吸收和分散负荷的能力,在长期机械负荷的作用下,退行性变进一步进展,从而形成椎间盘退变的恶性循环[8,16]。本实验中,通过hTERT基因的作用,我们实现了体外培养髓核细胞Ⅱ型胶原及蛋白多糖表达量的提高,这一结果对于rAAV2-hTERT-髓核细胞在椎间盘退行性疾病治疗中的应用具有相当的意义。通过对实验结果的RTPCR半定量及ELISA定量分析,可见两者表达量在转染后的第15天达到高峰,这一峰值较hTERT基因及蛋白表达高峰相对滞后,可能原因在于hTERT主要通过保证细胞增殖过程中的端粒长度来维持细胞的正常代谢,同时上调细胞周期中同细胞增殖、DNA修复及染色质重组相关的基因表达水平[17-18],这些机制传到细胞蛋白的表达需要相对较为缓慢的过程。因此,在以Ⅱ型胶原及蛋白多糖为指标衡量细胞表型及功能时,其表达量的提升要相对滞后。但hTERT基因对于细胞功能的调节和保持效果具有相对的持续性,这反应在至第60天时,实验组Ⅱ型胶原及蛋白多糖表达量仍明显高于对照组。正常髓核细胞少量表达Ⅰ型胶原。通过RT-PCR对不同时间点Ⅰ型胶原表达量进行分析,发现实验组同对照组无明显区别,说明rAAV2-hTERT转染对髓核细胞Ⅰ型胶原的表达无明显促进或抑制作用。
综上所述,本研究结果提示rAAV2-hTERT病毒转染可成功实现体外培养条件下髓核细胞增殖能力及细胞功能蛋白表达的上调,这将可能提高其在椎间盘退行性疾病中的应用潜力。
[1]Loreto C,Musumeci G,Castorina A,et al.Degenerative disc disease of herniated intervertebral discs is associated with extracellular matrix remodeling,vimentin-positive cells and cell death[J].Ann Anat,2011,193(2):156-162.
[2]Ruan DK,Xin H,Zhang C,et al.Experimental intervertebral disc regeneration with tissue-engineered composite in a canine model[J].Tissue Eng Part A,2010,16(7):2381-2389.
[3]Kluba T,Niemeyer T,Gaissmaier C,et al.Human anulus fibrosis and nucleus pulposus cells of the intervertebral disc:effect of degeneration and culture system on cell phenotype[J].Spine(Phila Pa 1976),2005,30(24):2743-2748.
[4]Hu MH,Hung LW,Yang SH,et al.Lovastatin promotes redifferentiation of human nucleus pulposus cells during expansion in monolayer culture[J].Artif Organs,2011,35(4):411-416.
[5]Inoue N,Espinoza Orías AA.Biomechanics of intervertebral disk degeneration[J].Orthop Clin North Am,2011,42(4):487-499.
[6]Claus A,Hides J,Moseley GL,et al.Sitting versus standing:does the intradiscal pressure cause disc degeneration or low back pain[J]?J Electromyogr Kinesiol,2008,18(4):550-558.
[7]Kepler CK,Anderson DG,Tannoury C,et al.Intervertebral disk degeneration and emerging biologic treatments[J].J Am Acad Orthop Surg,2011,19(9):543-553.
[8]Loreto C,Musumeci G,Castorina A,et al.Degenerative disc disease of herniated intervertebral discs is associated with extracellular matrix remodeling,vimentin-positive cells and cell death[J].Ann Anat,2011,193(2):156-162.
[9]Allsopp RC,Vaziri H,Patterson C,et al.Telomere length predicts replicative capacity of human fibroblasts[J].Proc Natl Acad Sci USA,1992,89(21):10114-10118.
[10]Harley CB,Futcher AB,Greider CW.Telomeres shorten during ageing of human fibroblasts[J].Nature,1990,345(6274):458-460.
[11]Shay JW,Wright WE.Senescence and immortalization:role of telomeres and telomerase[J].Carcinogenesis,2005,26(5):867-874.
[12]Shay JW,Gazdar AF.Telomerase in the early detection of cancer[J].J Clin Pathol,1997,50(2):106-109.
[13]Wege H,Heim D,Lütgehetmann M,et al.Forced activation of β-catenin signaling supports the transformation of hTERT-immortalized human fetal hepatocytes[J].Mol Cancer Res,2011,9(9):1222-1231.
[14]Zhao CF,Hu HY,Meng L,et al.Immortalization of bovine mammary epithelial cells alone by human telomerase reverse transcriptase[J].Cell Biol Int,2010,34(6):579-586.
[15]Wu J,Wang D,Zhang C,et al.Extending the activities of human nucleus pulposus cells with recombinant adeno-associated virus vector-mediated human telomerase reverse transcriptase gene transfer[J].Tissue Eng Part A,2011,17(19/20):2407-2415.
[16]Inoue N,Espinoza Orías AA.Biomechanics of intervertebral disk degeneration[J].Orthop Clin North Am,2011,42(4):487-499.
[17]Sharma GG,Gupta A,Wang H,et al.hTERT associates with human telomeres and enhances genomic stability and DNA repair[J].Oncogene,2003,22(1):131-146.
[18]Smith LL,Coller HA,Roberts JM.Telomerase modulates expression of growth-controlling genes and enhances cell proliferation[J].Nat Cell Biol,2003,5(5):474-479.
