溶酶体酶抑制剂对神经细胞内Nicastrin表达水平的影响
2012-09-21彭雪华龙志敏骆世芳贺桂琼重庆医科大学儿童医院放射科重庆40006
彭雪华 龙志敏 骆世芳 贺桂琼 (重庆医科大学儿童医院放射科,重庆 40006)
Nicastrin(NCT)是Yu等〔1〕在2000年分离出的一种与γ-分泌酶功能和β淀粉样蛋白(Aβ)产生有关的重要蛋白质。NCT的构象及蛋白表达水平在γ-分泌酶的激活、AD中Aβ的产生和降解中起重要调节作用〔1~4〕。NCT作为一种蛋白质,它在体内的代谢过程,包括被降解的过程及在细胞中的平衡调节与路径仍无知晓。真核细胞有两条蛋白降解途径:溶酶体途径和蛋白酶体途径。本课题组的前期工作〔5〕初步表明NCT的降解与蛋白酶体途径有关,但是否与溶酶体途径有关尚不清楚。本研究拟用溶酶体酶抑制剂处理稳定表达NCT的细胞株,探讨溶酶体途径是否介导了神经细胞内NCT的蛋白降解。
1 材料与方法
1.1 材料 人神经母细胞瘤细胞SH-SY5Y,由加拿大不列颠哥伦比亚大学脑研究中心AD病研究室提供;SH-SY5Y稳定表达NCT的细胞株NCT2(本课题组自制)。
兔抗 NCT N端抗体(Covance Inc,USA);脂质体 Lipofectamine 2000,氯喹(Chloroquine),NH4Cl(Sigma,USA)。兔抗LAMP2 抗体(abc CAM.Inc,USA),抗兔 Cy3-IgG、抗鼠 FITC-IgG(Jackson ImmunoResearch,USA);抗mychis抗体9E10由加拿大不列颠哥伦比亚大学脑研究中心AD病研究室馈赠。
1.2 方法
1.2.1 细胞培养和溶酶体酶抑制剂处理 SH-SY5Y稳定表达NCT的细胞株NCT2或未经转染的SH-SY5Y细胞生长至90%融合度时,进行传代,根据实验需求,将细胞种在不同的培养皿,常规37℃、5%CO2孵箱培养。
溶酶体酶抑制剂处理细胞:用溶酶体酶抑制剂氯喹(50 μmol/L)、NH4Cl 50 mmol/L 处理 NCT2 细胞株 24 h。同时,用氯喹处理 NCT2细胞时,设立不同剂量组(0,25,50,100 μmol/L,处理 24 h)和不同处理时间组(0、6、12、24 h,浓度为50 μmol/L)。通过Western印迹检测上述抑制剂对外源性NCT表达的影响。实验中还用氯喹50 μmol/L处理未经NCT质粒转染的SH-SY5Y细胞24 h,通过Western印迹检测该抑制剂对内源性NCT表达的影响。
1.2.2 Western印迹 收集细胞,裂解法提取蛋白,取上清液用Bradford法测定总蛋白量。10%Tris-Glycine SDS-PAGE凝胶电泳,电泳后将蛋白转至PVDF膜,封闭缓冲液(5% 脱脂奶粉,3%BSA,1×PBST配制)室温封闭2 h;加入Ⅰ抗4℃过夜,1×PBST漂洗15 min×4次;Ⅱ抗,室温摇床1 h,1×PBST漂洗10 min×4次,PVDF膜置于ECL反应液中1 min,曝光显色并扫描。采用Kodak Image Station 1000软件对各蛋白条带进行密度计量学分析以测定条带的强弱。
1.2.3 亚细胞器分级分离实验(Cell fractionation)检测正常情况下NCT在亚细胞水平的分布 采用NCT稳定细胞株。收集细胞,裂解,取上清液加入预先制备好的梯度蔗糖溶液,然后高速离心(24 000 r/min)20 h(4℃),经10%Tris-Glycine凝胶电泳,用9E10识别NCTmychis蛋白,再根据各细胞器在蔗糖溶液中的密度,分析NCT在各细胞器的分布。内质网、高尔基复合体、溶酶体在梯度蔗糖溶液中的密度为1.16~1.18、1.06~1.10和1.21 g/cm3。
1.2.4 免疫荧光双标检测溶酶体酶抑制剂处理后NCT在特定细胞器的表达变化 Chloroquine处理NCT2细胞12 h后,进行免疫荧光双标:用预热的 D-PBS洗 3次,4%PFA固定30 min,0.1%Triton X-100 30 min,5%BSA 封闭 1 h 后,加入 I抗:用鼠抗9E10、抗鼠FITC-IgG识别NCT;兔抗LAMP2抗体、抗兔Cy3-IgG识别溶酶体。Hoechest染色用于识别细胞核。封片后,在倒置荧光显微镜下观察NCT在溶酶体的表达变化。
2 结果
2.1 正常情况下NCT在亚细胞水平的分布 亚细胞器分级分离实验结果显示,绝大多数的NCT分布于内质网和高尔基复合体,极少量的NCT分布于溶酶体,其中内质网内的NCT主要是未成熟NCT(imNCT)和成熟NCT(mNCT),而高尔基复合体和溶酶体内的NCT为mNCT。见图1。
2.2 溶酶体酶抑制剂处理后,NCT在溶酶体的表达变化 应用免疫荧光双标技术检测结果显示,溶酶体标记物兔抗溶酶体膜蛋白2(LAMP2)和羊抗兔Cy3-IgG用于识别Lysosome(红色荧光),9E10抗体和兔抗鼠FITC-IgG用于识别NCT(绿色荧光)。对照组和氯喹处理组均出现NCT与LAMP2共存,且氯喹处理组NCT与LAMP2共表达明显增强。见图2。

图1 亚细胞器分级分离实验
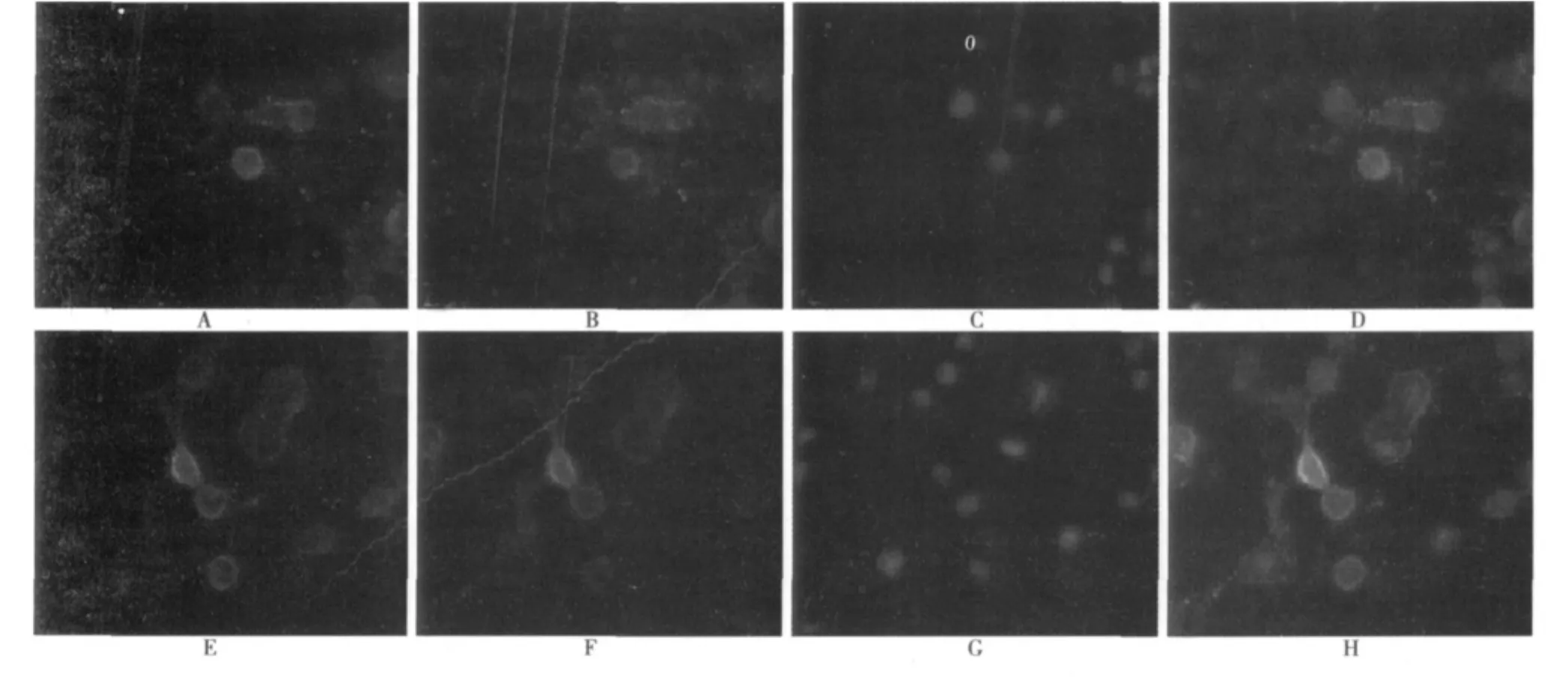
图2 免疫荧光双标检测氯喹处理后NCT在溶酶体的表达变化
2.3 溶酶体酶抑制剂处理后,神经细胞内源性和外源性NCT的表达变化 SDS-PAGE凝胶电泳及对蛋白条带定量分析的结果显示:与对照组(100±2.16)相比,NH4Cl和氯喹处理NCT2细胞24 h后,mNCT蛋白水平为(147.09±9.44,t=8.81)、(206.67±6.72,t=32.78),二者均显著增强了 mNCT的表达(P<0.01),氯喹对 mNCT的增强效应较 NH4Cl更显著(图3A)。为进一步验证溶酶体酶抑制剂对NCT的抑制效果,实验中分别设立了剂量依赖组和时间依赖组以处理NCT2细胞株,结果显示:氯喹对mNCT表达的影响随剂量的增加而增强,当氯喹的浓度达到50 μmol/L时,mNCT的表达(185.00±5.57)最强,对照组、25、100 μmol/L氯喹处理 NCT2后 mNCT蛋白条带光密度分别为99.31±2.10,116.33±5.78,153.96±10.97。随着浓度的再增高,mNCT的表达逐渐降低(图3B);同时,氯喹对mNCT表达的影响也随处理时间的延长而增强,对照组、6、12、24 h组 mNCT蛋白条带光密度值分别为95.95±5.58,113.03±5.29,188.09±10.15,245.33±10.97(图 3C)。各种溶酶体酶抑制剂对imNCT表达的影响不显著。
为检测溶酶体酶抑制剂是否也影响内源性NCT的表达,实验中应用氯喹50 μmol/L处理未转染的SH-SY5Y细胞,抗NCT抗体用于内源性NCT的识别。SDS-PAGE凝胶电泳结果显示:与对照组(100±2.64)相比,氯喹处理后内源性mNCT的表达显著提高(213.02±17.73,t=10.79,P<0.01),这一结果与在NCT2细胞内检测的结果一致,初步表明mNCT的降解与溶酶体途径有关(图3D)。

图3 溶酶体酶抑制剂处理后神经细胞内NCT的表达变化
3 讨论
Aβ产生过多并沉积在阿尔茨海默病(AD)发病机制中占重要位置,因此,减少Aβ生成及加速Aβ降解成为治疗AD的关键。Aβ是淀粉样前体蛋白(APP)经β-分泌酶和γ-分泌酶的酶切作用产生的。NCT蛋白可与其他三种蛋白早老素(Presenilin,PS)、APH-1和Pen-2相互作用形成γ-分泌酶。NCT属I型跨膜蛋白,它首先在内质网中合成,然后向高尔基复合体转运,转运过程中NCT经历不同程度的糖基化和磷酸化修饰而成熟。NCT蛋白主要有两种形式,不成熟NCT(~110 kD,imNCT)和成熟NCT(~130 kD,mNCT),其中只有mNCT参与有活性γ-分泌酶的组成〔6~8〕。imNCT完全转变成 mNCT大概需要5 h,imNCT极不稳定,半衰期短(t1/2<30 min),但mNCT的半衰期长(t1/2约为24 h)〔9〕。研究发现,NCT缺乏会使γ-分泌酶活性下降,Aβ产生减少;过度表达的NCT可增加Aβ的生成;NCT胞外功能区DYIGS基序的人工缺失及人工诱导的突变产物会使Aβ尤其是Aβ42明显增多。以上研究提示,NCT的结构变异或表达水平的改变将导致Aβ生成量的异常,可能与AD的发生发展有密切的相关性。由此推测,通过调节NCT的表达水平来抑制γ-分泌酶活性、减少Aβ的生成量,有望延缓或阻止AD的进程。但NCT作为一种新蛋白,目前关于其在体内的合成、分布及功能已有不少报道,而其蛋白降解过程尚不清楚。
蛋白降解是调节蛋白质水平和功能的重要途径。真核细胞中的蛋白降解途径包括蛋白酶体途径和溶酶体途径,前者主要降解半衰期短的正常蛋白和变性、错误折叠的、过量表达的蛋白质,机体中绝大多数(80% ~90%)蛋白质的降解由这条途径介导;自噬溶酶体途径主要作用于半衰期长的细胞膜蛋白和内吞的蛋白质。
本课题组的前期工作发现,蛋白酶体抑制剂可抑制半衰期短的imNCT降解,同时也可抑制半衰期长的mNCT降解〔5〕,那么,溶酶体酶抑制剂是否会影响imNCT和mNCT的降解?为解决这一问题,我们首先检测了NCT在亚细胞水平的分布。亚细胞器分级分离实验表明,imNCT仅见于ER,而mNCT除存在于内质网和高尔基复合体内,还发现溶酶体内也含少量mNCT,那么,溶酶体内的mNCT是否会受到溶酶体酶抑制剂的影响?
溶酶体通常呈圆形,由单层界膜包被,内含电子致密物,在酸性范围内含70多种水解酶,其主要功能是清除细胞内的外源性异物和内源性残余物,与机体的防御功能和细胞结构的自我更新过程密切相关。在细胞衰老、死亡时,溶酶体膜脆性及通透性增强,致使溶酶体内水解酶渗入胞质,从而加速细胞变性、坏死过程,清除凋亡的细胞。弱碱如氯喹或NH4Cl可以自由地透过生物膜,在溶酶体的酸性环境中积累并使溶酶体内pH值升高而降低对蛋白质的降解,因此是理想的溶酶体酶抑制剂。
本实验应用溶酶体酶抑制剂氯喹和NH4Cl处理神经细胞,结果发现,溶酶体酶抑制剂可显著提高SH-SY5Y稳定表达NCT细胞株(NCT2)外源性mNCT的表达,且氯喹对mNCT的增强效应呈剂量依赖性和时间依赖性;同时,此类抑制剂还可使SHSY5Y细胞的内源性mNCT的表达显著提高,但氯喹不影响内源性和外源性imNCT的表达。免疫荧光双标结果显示,当用溶酶体酶抑制剂处理后,细胞内的NCT与溶酶体标记物LAMP2的共表达增强,提示细胞内因降解受阻所致的增多的NCT主要聚集在溶酶体。
根据本实验的结果及前期工作的研究结果提示,神经细胞内imNCT的降解主要由蛋白酶体途径介导,而mNCT的降解由蛋白酶体途径和溶酶体途径共同介导。那么,为什么mNCT的降解受两条途径调控,这两条途径在mNCT降解中分别起什么作用?哪一条途径居主导地位?根据蛋白酶体和溶酶体的功能,笔者推测,蛋白酶体途径主要负责对合成和转运过程中错误折叠、受损的NCT蛋白的降解,而溶酶体主要负责维持NCT的更新。关于这一推测尚需进一步验证。蛋白酶体功能障碍并诱导神经细胞死亡和细胞内包涵体的形成,从而诱发AD的研究已有大量报道〔10,11〕。但作为细胞内另一条蛋白降解途径——溶酶体途径与AD关系的研究却较少。近年来大量研究发现,溶酶体非正常损伤可导致各种疾病,包括心肌缺血/再灌注损伤、神经退行性疾病(如AD)、肿瘤、感染等。已有研究表明,自噬溶酶体活性降低导致神经细胞中错误折叠蛋白的积累以及溶酶体失稳是AD的早期症状〔12〕。研究发现,AD中具有神经毒性的可溶性Aβ主要在溶酶体中产生并降解,而催化Aβ生成的 β-分泌酶(BACE1)也主要经溶酶体途径降解〔13,14〕。虽然溶酶体降解Aβ被认为可清除其细胞毒性,但体外实验表明,Aβ可刺激细胞增加溶酶体的数量和体积,神经细胞退变前,溶酶体和酸性水解酶增多,存在大量结构异常的溶酶体。异常溶酶体可促进细胞内产生非正常的或具有神经毒性的APP片段,从而加速溶酶体结构和功能失常,引起内含物的释放,并导致细胞死亡。可见,溶酶体结构及功能的异常与AD的发病关系密切,探讨AD相关蛋白是否经溶酶体途径降解将有助于对AD的发病机制及防治策略提出新见解。
1 Yu G,Nishimura GM,Arawaka S,et al.Nicastrin modulates presenilinmediated notch/glp-1 signal transduction and betaAPP processing〔J〕.Nature,2000;407:48-54.
2 Pardossi-Piquard R,Dunys J,Yu G,et al.Neprilysin activity and expression are controlled by nicastrin〔J〕.J Neurochem,2006;97:1052-6.
3 Morais VA,Leight S,Pijak DS,et al.Cellular localization of Nicastrin affects amyloid beta species production〔J〕.FEBS Lett,2008;582(3):427-33.
4 Hiltunen M,Mannermaa A,Thompson D,et al.Genome-wide linkage disequilibrium mapping of late-onset Alzheimer's disease in Finland〔J〕.Neurology,2001;57(9):1663-8.
5 骆世芳,高宝兵,龙志敏,等.蛋白酶体抑制剂处理对神经细胞Nicastrin表达的影响〔J〕.中国病理生理杂志,2010;26(6):1085-90.
6 Kodam A,Vetrivel KS,Thinakaran G,et al.Cellular distribution of gamma-secretase subunit nicastrin in the developing and adult rat brains〔J〕.Neurobiol Aging,2008;29(5):724-38.
7 Confaloni A,Crestini A,Albani D,et al.Rat nicastrin gene:cDNA isolation,mRNA variants and expression pattern analysis〔J〕.Brain Res Mol Brain Res,2005;136(1-2):12-22.
8 Morais VA,Brito C,Pijak DS,et al.N-glycosylation of human nicastrin is required for interaction with the lectins from the secretory pathway calnexin and ERGIC-53〔J〕.Biochim Biophys Acta,2006;1762(9):802-10.
9 Edbauer D,Winkler E,Haass C,et al.Presenilin and nicastrin regulate each other and determine amyloid beta-peptide production via complex formation〔J〕.Proc Natl Acad Sci U S A,2002;99(13):8666-71.
10 Ciechanover A.Intracellular protein degradation:from a vague idea through the lysosome and the ubiquitin-proteasome system and onto human diseases and drug targeting〔J〕.Cell Death Differ,2005;12(9):1178-90.
11 Song S,Jung YK.Alzheimer's disease meets the ubiquitin-proteasome system〔J〕.Trends Mol Med,2004;10(11):565-70.
12 Cuervo AM.Autophagy:in sickness and in health〔J〕.Trends Cell Biol,2004;14:70-7.
13 Pasternak SH,Callahan JW,Mahuran DJ.The role of the endosomal/lysosomal system in amyloid-beta production and the pathophysiology of Alzheimer's disease:reexamining the spatial paradox from a lysosomal perspective〔J〕.J Alzheimers Dis,2004;6(1):53-65.
14 Koh YH,von Arnim CA,Hyman BT,et al.BACE is degraded via the lysosomal pathway〔J〕.J Biol Chem,2005;280(37):32499-504.
