血管紧张素Ⅱ-1型受体基因多态性与高血压及血管内皮功能的相关性
2012-09-21崔天祥杨丽红郑州大学第二附属医院河南郑州450014
张 强 崔天祥 李 莉 杨丽红 孔 静 (郑州大学第二附属医院,河南 郑州 450014)
肾素-血管紧张素系统(RAS)对血压和机体内环境的稳定发挥至关重要的作用。由于RAS的作用均由血管紧张素Ⅱ-1型受体(AT1R)介导,因此AT1R基因与原发性高血压(EH)相关性的研究成为近年来的热点。血管内皮细胞能合成及分泌多种生物活性物质,对维持管壁张力和血流有重要作用。近年来,一些研究证实高血压存在内皮损伤,而EH患者血管内皮功能的遗传机制研究国内鲜有报道。本研究拟探讨AT1R基因多态性与血管内皮功能在EH发病中的相关性。
1 资料与方法
1.1 临床资料
1.1.1 EH组 入选郑州大学第二附属医院高血压门诊EH患者82例,男53例,女29例,年龄(62±6)岁,收缩压(154±12)mmHg,舒张压(86±10)mmHg,均为汉族,EH 诊断符合1999年中国高血压防治指南规定的诊断标准。受试者均无血缘关系,且排除继发性高血压。
1.1.2 正常血压组 33例,来自健康体检人群,男23例,女10例,年龄(60±8)岁,收缩压(120±14)mmHg,舒张压(72±10)mmHg,未服用影响血压的药物对象间无血缘关系。
1.2 检测方法
1.2.1 血样采集 取静脉血5 ml,其中1 ml离心分离血浆,-15℃保存,待测血浆氧化氮(NO)和内皮素(ET);(2)余血加入2%EDTA抗凝管中,-70℃保存,待提取基因组DNA。
1.2.2 AT1R基因的检测 (1)DNA的提取:应用杭州VGENG生物技术有限公司生产的血细胞基因组DNA制备试剂盒提取组织DNA。(2)PCR扩增:AT1R引物序列:上游5'-CAC CAT GTT TTG AGG TT-3',下游5'-CGA GTT TCT GAC ATT GTT C-3',由上海生工生物工程技术服务有限公司合成。(3)限制性酶切:PCR扩增产物3 μl加入内含10 U dDeI的限制性内切酶反应缓冲液稀释成20 μl,37℃酶切3 h。(4)电泳分型:酶解产物点样于2%琼脂糖凝胶中电泳30 min后EB染色,紫外灯下观察结果并照相。
1.2.3 血浆NO、ET的检测 NO测定采用硝酸还原酶法,ET测定采用放射免疫法。
1.2.4 肱动脉超声检查 参照Cvelermajer等〔1〕首创的利用高分辨率超声检测肱动脉扩张判断血管内皮功能的方法。受检者停用血管扩张剂24 h以上,采用HDI-3000型彩色多普勒超声诊断仪和7.5 MHz线阵探头,探查深度4 cm,同步记录心电图,仰卧位,右上肢外展45°,掌心向上,以二维超声成像扫描肱动脉。再以肘上2~15 cm肱动脉为靶动脉,显示长轴切面,测量舒张末期内径。每次3个心动周期,取平均值。分别测量每位受试者静息时、反应性充血、再休息及含服硝酸甘油(NTG)后肱动脉内径。测定基础值(D0)后将血压计袖带放于肱动脉远端,充气加压至收缩压上50 mmHg,维持4~5 min放气,放气后60~90 s内迅速测量肱动脉内径(D1)。休息10 min,血管内径恢复至试验前状态后,舌下含服硝酸甘油0.5 mg,3~4 min后再次测量血管内径(D2)。整个过程保持超声探头始终处于固定位置。反应性充血及服用硝酸甘油后血管内径改变情况以第一次测量基础值的百分数表示,即(D1或D2-D0)/100%。
1.3 统计学分析 应用SPSS17.0软件进行统计分析:计量资料用±s表示,均数比较采用t检验;两组之间频数分布采用χ2检验。
2 结果
2.1 AT1R基因型检测结果 琼脂糖凝胶电泳检测AT1R基因型见图1。
2.2 两组间AT1R基因型频率及等位基因频率比较 82例EH患者的基因型AA型70例,AC型9例,CC型3例,基因型频率分别为85.4%,10.9%和3.7%;A和C的等位基因频率分别为90.9%和9.1%。33例正常血压者的基因型AA型31例,AC型2例,CC型0例;基因型频率分别为94%,6%和0.0%;A和C的等位基因频率分别为97%和3%。经χ2检验两组间C等位基因频率有显著性差异(χ2=0.046,P<0.05)。
2.3 三组间血浆NO、ET浓度和肱动脉内径变化 见表1。
表1 三组血浆NO、ET浓度和肱动脉内径变化比较(±s)
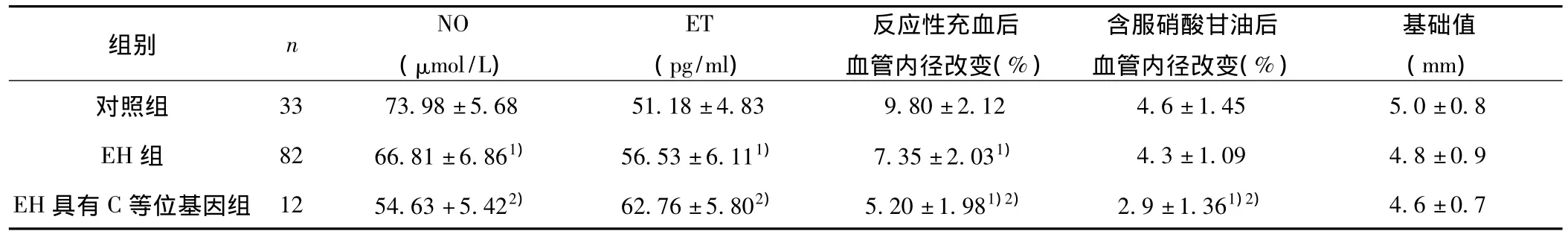
表1 三组血浆NO、ET浓度和肱动脉内径变化比较(±s)
与对照组比较:1)P<0.05;与EH组比较:2)P<0.05
组别 n NO(μmol/L)ET(pg/ml)反应性充血后血管内径改变(%)含服硝酸甘油后血管内径改变(%)基础值(mm)对照组 33 73.98±5.68 51.18±4.83 9.80±2.12 4.6±1.455.0±0.8 EH组 82 66.81±6.861) 56.53±6.111) 7.35±2.031) 4.3±1.09 4.8±0.9 EH具有C等位基因组 12 54.63+5.422) 62.76±5.802) 5.20±1.981)2) 2.9±1.361)2)4.6±0.7
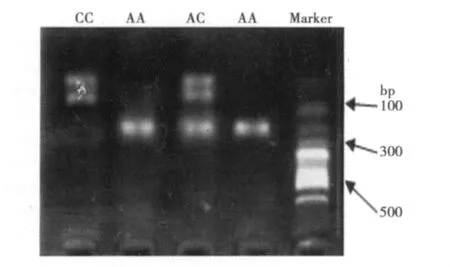
图1 琼脂糖凝胶电泳检测AT1R基因型
3 讨论
RAS通过AngⅡ调节血压、体液容量和电解质平衡,而AngⅡ主要通过与靶器官细胞膜上的特异性受体结合发挥生物学效应,人类AT1R基因位于3号染色体长臂21~25区〔2〕,基因组全长47 kb,包含5个外显子,为单拷贝基因。1994年Bonnardeaux等〔2〕在AT1R的编码区及3'非翻译区测到五种多态性,与临床关系较为密切的基因变异A1166C位于3'未翻译区(UTR)的5'端,并证实A1166C突变与血压升高有关。本研究提示AT1R基因A1166C多态性与EH相关,C等位基因是EH的独立危险因素。
血管内皮不仅是血管屏障,也是重要的内分泌和效应器官,可以产生NO、ET-1和多种血管活性物质以调节血管舒缩功能〔1〕。高血压可以导致内皮功能障碍,但也有研究显示内皮功能紊乱早于高血压的发生〔3〕。本研究结果说明高血压伴有内皮细胞损伤、血管舒缩功能障碍,主要原因是由于内皮细胞释放的缩血管物质增多而舒血管物质减少。
Taddei等〔4〕研究发现,即使无明显的影响血管内皮的危险因素,但内皮仍出现不同程度的功能障碍,由此认为血管内皮功能也与遗传因素有关。本研究结果说明EH存在血管内皮舒缩功能障碍,表现为血浆NO浓度下降和ET浓度升高,且有一定的遗传因素参与,AT1R基因1166CC型可能是EH内皮舒缩功能障碍的危险因素。
综上所述,遗传因素是EH发病机制中的重要因素,AT1R基因变异是参与EH发病的重要分子基础,EH可以导致血管内皮舒缩功能障碍。研究AT1R基因A1166C多态性与EH内皮功能障碍的关系可以作为早期判断高血压预后的间接指标。
1 Celermajer DS,Sorensen KE,Gooch VM,et al.Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis〔J〕.Lancet,1992;340:1111-5.
2 Bonnardeaux A,Davies E,Jeunemaitre X,et al.Angiotensin II type 1 receptor gene polymorphisms in human essential hypertension〔J〕.Hypertension,1994;24(1):63-9.
3 陈 明,胡申江.高血压病血管内皮功能障碍及治疗〔J〕.心血管病学进展,2005;26:222-6.
4 Taddei S,Virdis A,Mattei P,et al.Defective L-arginine-nitric oxide pathway in offspring of essential hypertensive patient〔J〕.Circulation,1996;94:1298-303.
