投喂高脂饲料后草鱼主要生化指标和乙酰辅酶A羧化酶1mRNA表达的变化
2012-09-20汪开毓苗常鸿黄锦炉吴春艳牟巧凤
汪开毓 苗常鸿 黄锦炉 王 均 连 海 吴春艳 牟巧凤 付 希
(四川农业大学鱼病研究中心,四川农业大学动物疫病与人类健康四川省重点实验室,雅安 625014)
根据水产行业标准SC/T 1024—2002《草鱼配合饲料》,草鱼饲料中粗脂肪含量不应小于4%。但是,草鱼是一种对脂肪需求量较低的植食性鱼类[1-2]。有研究表明,当给草鱼投喂脂肪含量为8%的饲料8周后,草鱼则出现采食量下降、生长发育受阻以及血脂升高的现象[3-4]。草鱼长期摄入高脂饲料后可导致肝脏脂肪代谢机能紊乱,其病理上可表现为肝脏脂肪异常沉积或肝组织不同程度的损伤[5-6]。然而,草鱼长期摄入高脂饲料后引发其肝脏脂肪代谢异常的作用机制仍不清楚。
作为体内脂肪合成的关键酶之一,乙酰辅酶A羧化酶1(ACC1)参与了长链脂肪酸从头合成的第1步反应,其活性高低可直接影响肝脏对脂肪的合成速度,对调控肝组织的脂肪代谢活动具有重要作用[7-8]。因此,研究和分析摄入高脂饲料后草鱼的血清生化指标、肝胰脏生化指标以及ACC1 mRNA相对表达量的变化,有助于阐明草鱼脂肪代谢的变化机制。本试验通过连续12周投喂草鱼高脂饲料,以研究高脂饲料对草鱼主要生化指标和ACC1 mRNA表达的影响,旨在探索草鱼对过量脂肪的代谢调控机理,为系统阐明草鱼营养代谢性肝病的发病机制提供科学依据。
1 材料与方法
1.1 试验材料
草鱼:购自成都市邛崃水产养殖场。鱼油:购自青岛永丰生物科技有限公司。大豆油:购自益海嘉里食品营销有限公司。
1.2 试验设计与饲料配制
试验设基础组和高脂组2组,每组设3个重复,每个重复20尾鱼。基础组投喂含4.6%脂肪的基础饲料,高脂组投喂含8.1%脂肪的高脂饲料。试验饲料组成及营养水平见表1,饲料中的脂肪比例设计参考 Du等[4]的报道以及 SC/T 1024—2002《草鱼配合饲料》,其他营养物质的配比参考NRC(1993)鲤鱼的营养需求。
1.3 饲养管理
健康草鱼共120尾,平均体重为(15.0±2.4)g,雌雄随机,购回后用氯化钠溶液浸泡消毒,分组后以重复为单位驯养在80 cm×75 cm×60 cm的水族箱中,养殖水质符合GB 11607—89《渔业水质标准》。驯养期间各组均按草鱼体重的1% ~2%投喂基础饲料,每天在09:00、12:00、18:00各投喂1次,每2天换水1次,水源为经曝气后的自来水,换水量为原来水量的1/4~1/3,换水的同时抽去残饵和粪便。经2周驯养后,随机抽取6条草鱼,剖解,观察无异常后开始正式试验,正式试验时试验鱼饲喂对应饲料,均按饱食量投喂,试验期为12周。
1.4 样本采集与生长相关指标的测定
试验开始前草鱼禁食1 d,从2组中各抽取6尾草鱼,称重后剥离肝胰脏,称量肝胰脏重量并记录。分别在正式试验开始后的第4、8、12周对2组草鱼随机采样,采样前草鱼禁食1 d,每组各取6尾,称重、尾静脉采血后剖解并剥离肝胰脏,将肝胰脏称重,记录,计算肝体指数。
肝体指数=100×肝胰脏重/鱼体重。
1.5 血清相关指标的测定
将采集的血液样本在室温下静置30 min,转入4℃冰箱放置3 h后4 000 r/min离心10 min,抽取上层血清,同组血清合并为1份,4℃存放,用于甘油三酯(TG)、总胆固醇(CHO)含量以及谷丙转氨酶(ALT)、谷草转氨酶(AST)活性的检测,上述指标检测所用试剂盒均购自南京建成生物工程研究所。
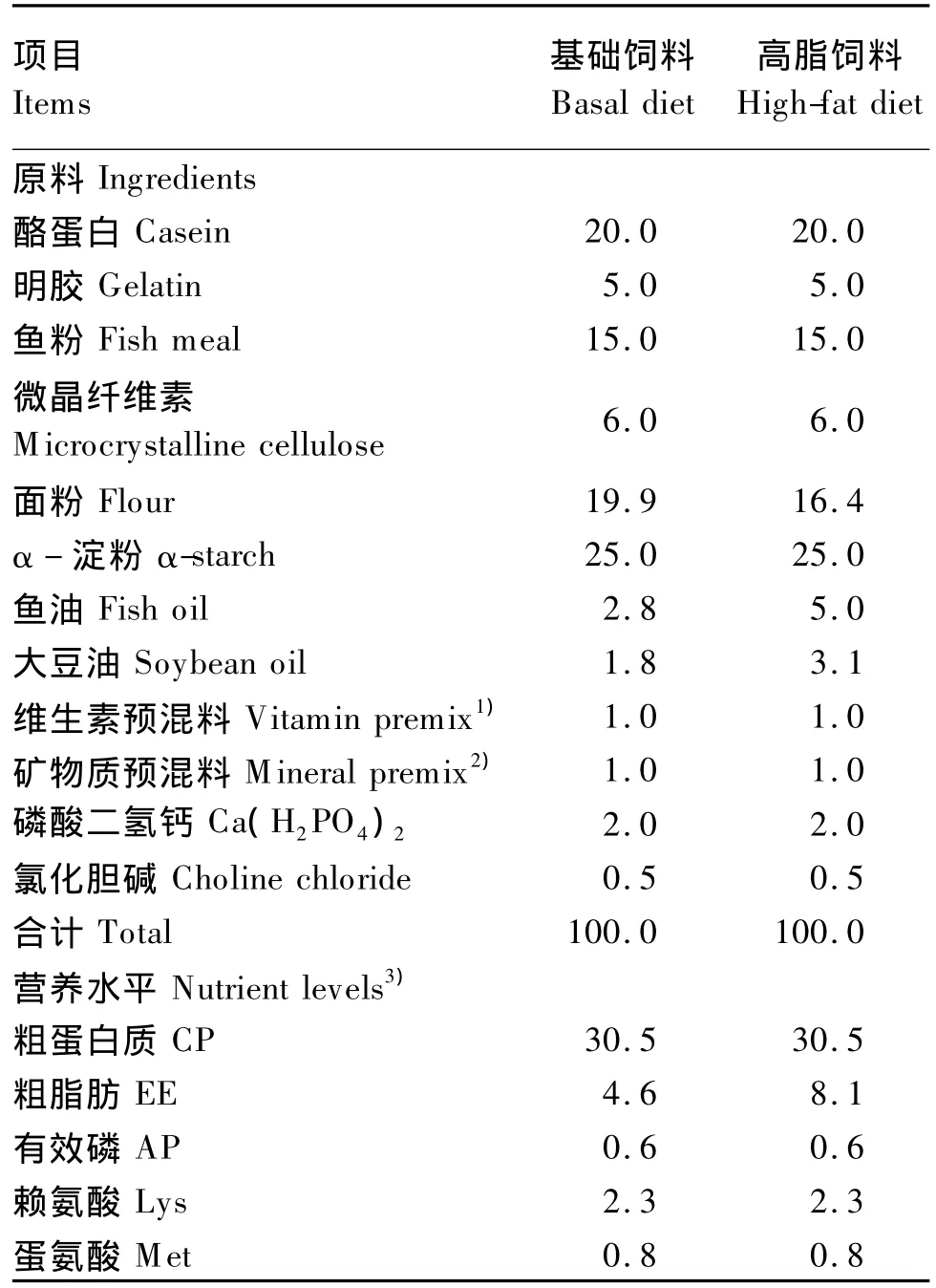
表1 试验饲料组成及营养水平(干物质基础)Table1 Composition and nutrient levels of experimental diets(DM basis) %
1.6 肝胰脏相关指标的测定
分别从基础组和高脂组中各取6尾鱼,将同组鱼的肝胰脏合并,取其中0.2 g,按试剂盒说明制备10%的组织匀浆,用于肝胰脏丙二醛(MDA)含量以及超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性的检测,上述指标检测所用试剂盒均购自南京建成生物工程研究所。试验第12周,各组取部分肝胰脏-80℃冻存,用于半定量反转录聚合酶链式反应(RT-PCR)检测ACC1 mRNA的相对表达量。剩余的肝胰脏用福尔马林溶液固定,制作病理切片后进行苏木精-伊红(HE)染色和苏丹Ⅲ+Ⅳ染色,显微镜下观察肝组织形态。
1.7 肝胰脏ACC1 mRNA表达的半定量检测
1.7.1 引物设计
使用Primer 5.0和Oligo 7.0软件设计RT-PCR引物(表2),引物序列参考GenBank公布的草鱼ACC1基因序列(登录号:HM142590)和β-肌动蛋白(β-actin)基因序列(登录号:DQ211096)进行设计,引物由上海生工公司合成。
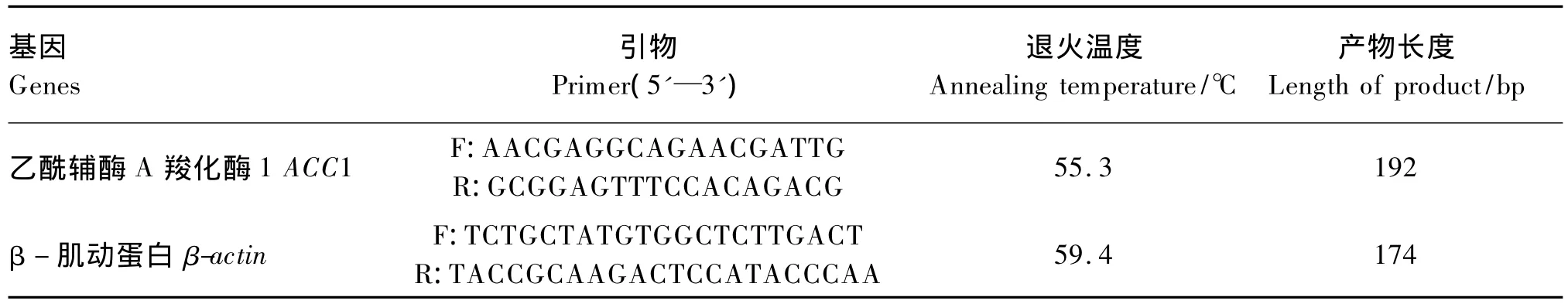
表2 RT-PCR引物序列Table2 Primer sequences for RT-PCR
1.7.2 总RNA的提取和cDNA第1链的合成
采用Trizol试剂(TakaRa公司),提取第12周基础组和高脂组的草鱼肝胰脏总RNA,1%琼脂糖凝胶电泳分析总RNA提取效果,紫外分光光度计测定吸光度(OD)值,计算RNA浓度以确定上样量。以提取的总RNA为模板,37℃ 15 min,85℃5 s反转录合成cDNA。上述2组的cDNA样品保存在-20℃冰箱,供RT-PCR使用。
1.7.3 RT-PCR和产物半定量分析
以1.7.2合成的cDNA为模板,RT-PCR扩增ACC1基因片段序列。反应体系共50 μL。ACC1和β-actin基因的反应条件为:94℃预变性5 min;94℃变性30 s,退火温度55.3℃(β-actin基因为59.4 ℃)30 s,72 ℃ 延伸1 min,共30 个循环;最后72℃延伸5 min。扩增产物经2%的琼脂糖凝胶电泳分析,核酸染料(golden view)染色,用Quantity One 462软件分析条带丰度,计算ACC1 mRNA的相对表达量。
ACC1 mRNA的相对表达量=ACC1表达丰度/β-actin表达丰度。
1.8 统计分析
所得数据采用SPSS 16.0软件进行统计学处理,高脂组和基础组数据进行组间差异t检验,同组3个取样时间的数据进行单因素方差分析和Duncan氏法多重比较,结果用平均值±标准差表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 草鱼肝胰脏组织形态学观察
试验期间,基础组草鱼肝细胞排列整齐,细胞界限清晰,细胞内有少量脂滴(图1-a、图1-b)。与基础组相比,高脂组草鱼第4周时肝细胞肿胀,部分肝细胞脂滴增多(图1-c、图1-d);第8周时肝细胞进一步肿胀,肝索排列紊乱,肝细胞内空泡体积增大,部分肝细胞核染色质浓缩、边移,肝细胞内脂滴进一步增多,并相互融合(图1-e、图1-f);第12周时脂肪变性进一步加重,肝细胞轮廓不清,部分肝细胞坏死(图1-g、图1-h)。
2.2 草鱼生长情况
由表3可知,试验初始阶段,高脂组和基础组草鱼体重差异不显著(P>0.05)。试验第4周时,高脂组草鱼体重达35.12 g,较基础组显著升高了9.2%(P<0.05);试验第8周时,高脂组和基础组草鱼体重差异不显著(P>0.05);试验第12周时,高脂组草鱼体重为98.62 g,较基础组显著降低了11.4%(P<0.05)。
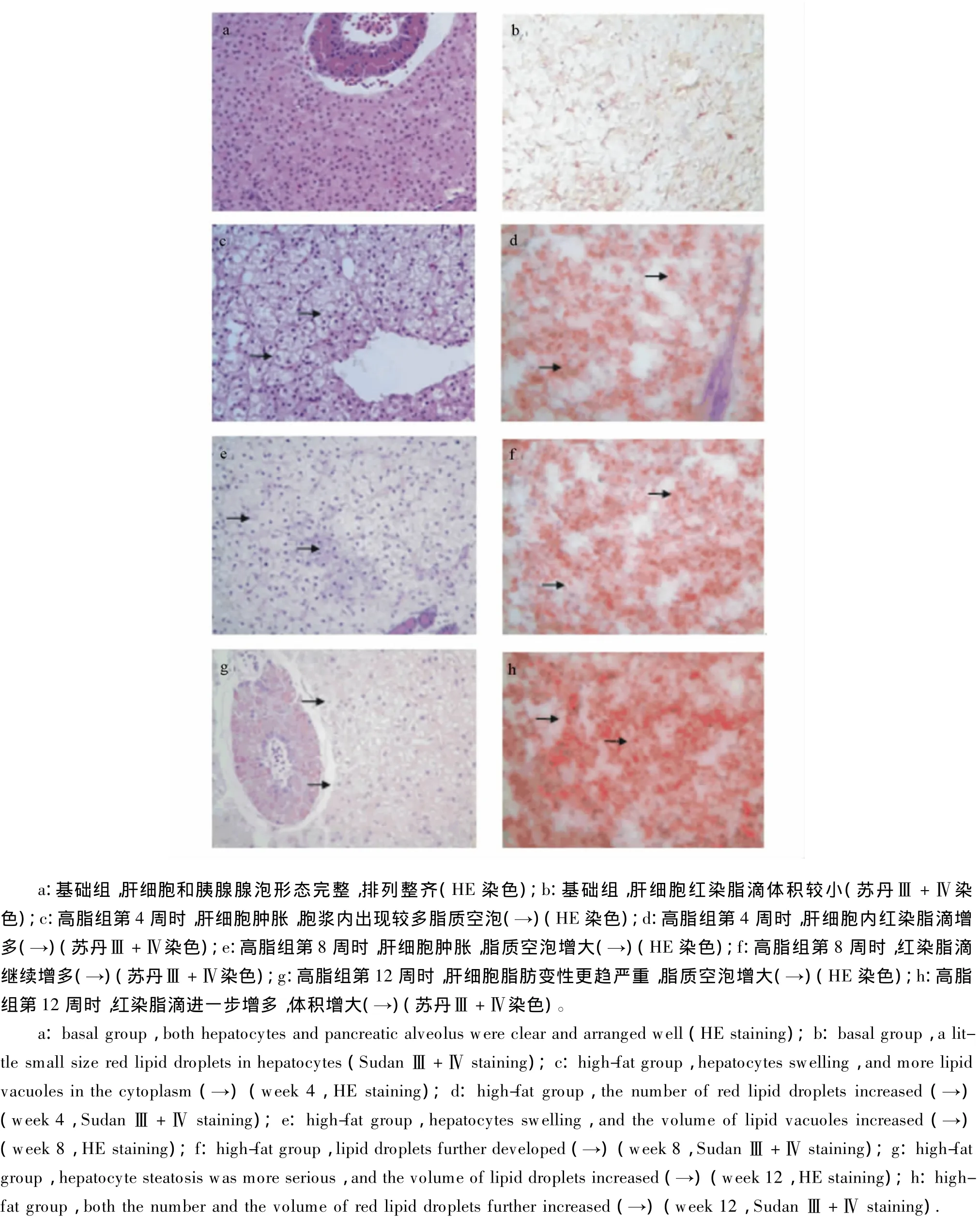
图1 12周内草鱼肝胰脏组织形态学观察Fig.1 Histomorphology observation on hepatopancreas of grass carp within 12 weeks(400×)
试验初始阶段,高脂组和基础组草鱼肝体指数差异不显著(P>0.05)。试验第4周时,高脂组草鱼肝体指数为2.51,较基础组显著升高了9.1%(P<0.05);试验第8周时,高脂组草鱼肝体指数达2.23,但与基础组差异不显著(P>0.05);试验第12周时,高脂组草鱼肝体指数为2.00,较基础组显著降低了13.5%(P<0.05)。
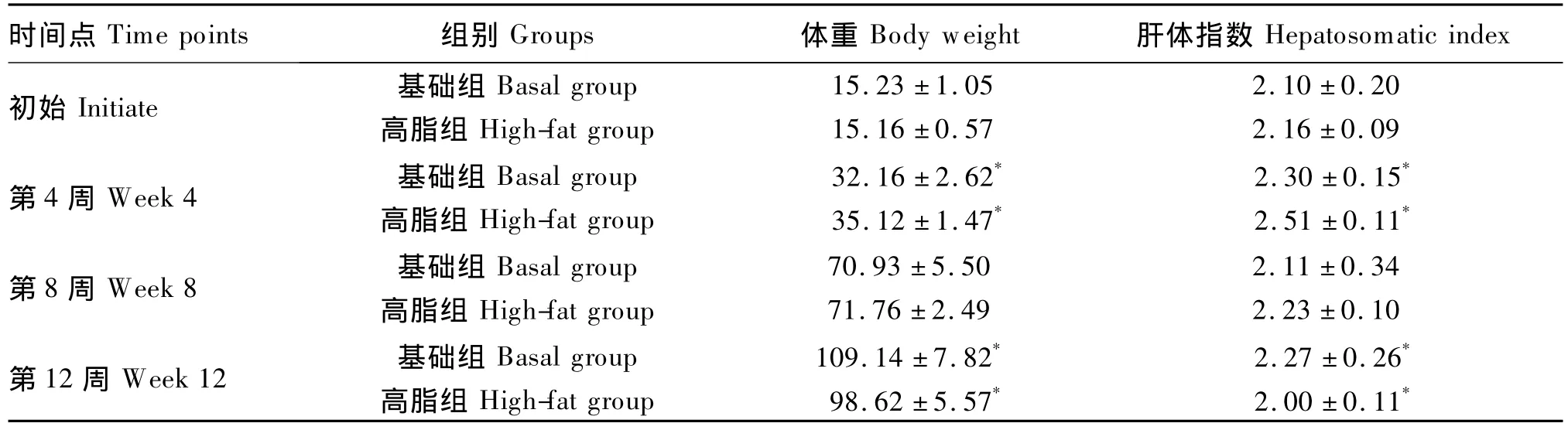
表3 12周内草鱼生长情况Table3 Growth condition of grass carp within 12 weeks
2.3 草鱼血清生化指标的变化
投喂高脂饲料后,草鱼血清TG、CHO含量均在试验第4周有不同程度地上升,并在试验期间保持着上升的趋势。由表4可知,试验第4周时,高脂组血清TG含量达2.12 mmol/L,较基础组显著升高了89.0%(P<0.05)。试验第8、12周的检测结果显示,高脂组血清TG含量分别达2.57和2.71 mmol/L,较基础组分别显著升高了70.2%和99.2%(P<0.05)。试验期间高脂组草鱼血清TG含量随投喂时间的延长逐渐上升,且第4周与第12周之间差异达到显著水平(P<0.05)。试验第4周时,高脂组血清CHO含量已达5.56 mmol/L,较基础组极显著升高了78.0%(P<0.01);试验第8周时,高脂组血清CHO含量达5.96 mmol/L,较基础组极显著升高了81.7%(P<0.01);试验第12周时,高脂组草鱼血清CHO含量高达6.66 mmol/L,较基础组极显著升高了100.6%(P<0.01)。试验期间高脂组草鱼血清CHO含量随投喂时间的延长逐渐上升,且3个时间点间差异达到显著或极显著水平(P<0.05或P<0.01),试验第8周时较前1次测定结果显著升高了7.2%(P<0.05),第12周时较前1次测定结果极显著升高了11.7%(P<0.01)。
与基础组相比,高脂组草鱼血清AST和ALT活性同样在试验第4周有不同程度地上升,并在试验期间保持上升趋势。试验第4周时,高脂组草鱼血清ALT和AST活性分别为8.57和12.23 U/L,较基础组分别极显著升高了85.5%和188.4%(P<0.01);试验第8周时,高脂组草鱼血清ALT和AST活性分别为14.69和24.07 U/L,均极显著高于基础组3倍以上(P<0.01);试验第12周时,高脂组草鱼血清ALT和AST活性达66.43和100.31 U/L,均极显著高于基础组14倍以上(P<0.01)。与血清CHO上升趋势类似,草鱼血清ALT和AST活性均随高脂饲料投喂时间的延长而上升,且3个时间点之间差异达到极显著水平(P<0.01)。
2.4 草鱼肝胰脏生化指标的变化
由表5可知,试验第4周时,高脂组草鱼肝胰脏MDA含量达3.14 nmol/mg,较基础组显著升高了102.5%(P<0.05);试验第8周时,高脂组草鱼肝胰脏MDA含量达7.61 nmol/mg,约为基础组的5倍(P<0.01);试验第12周时,高脂组草鱼肝胰脏MDA含量为8.22 nmol/mg,较基础组极显著升高了230.1%(P<0.01)。试验期间草鱼肝胰脏MDA含量随高脂饲料投喂时间的延长而持续上升,3个时间点之间差异达到极显著 (P<0.01)。
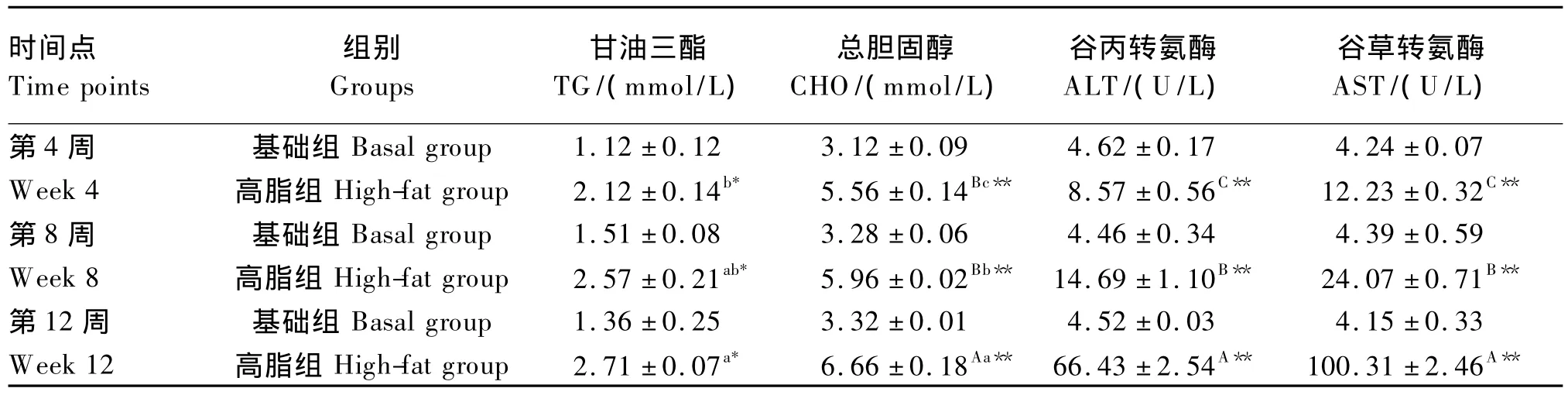
表4 12周内草鱼血清生化指标的变化Table4 Changes in serum biochemical indices of grass carp within 12 weeks
投喂高脂饲料后,草鱼肝胰脏SOD活性在试验第4周达到峰值,之后表现出下降的趋势。试验第4周时,高脂组草鱼肝胰脏SOD活性为208.00 U/mg,较基础组显著升高了16.3%(P<0.05);试验第8周时,高脂组草鱼肝胰脏SOD活性降至152.56 U/mg,与高脂组第4周的测定结果比较下降了36.3%(P<0.01),并显著低于同期基础组(P<0.05);试验第12周时,高脂组草鱼肝胰脏SOD活性为156.22 U/mg,与高脂组第8周的测定结果比较略有上升(上升了2.4%)(P>0.05),仍显著低于同期基础组(P<0.05)。
与SOD活性相似,高脂组草鱼肝胰脏CAT活性在试验第4周达到峰值,之后表现出下降的趋势。试验第4周时,高脂组肝胰脏CAT活性达625.47 U/g,约为基础组的30倍,差异极显著(P<0.01)。试验第8周和第12周的检测结果显示高脂组草鱼肝胰脏CAT活性分别为619.39和290.43 U/g,均极显著高于同期基础组14倍以上(P<0.01)。试验期间草鱼肝胰脏CAT活性随着高脂饲料投喂时间的延长而下降,试验第12周时的检测结果与第8周时相比极显著降低了113.2%(P <0.01)。
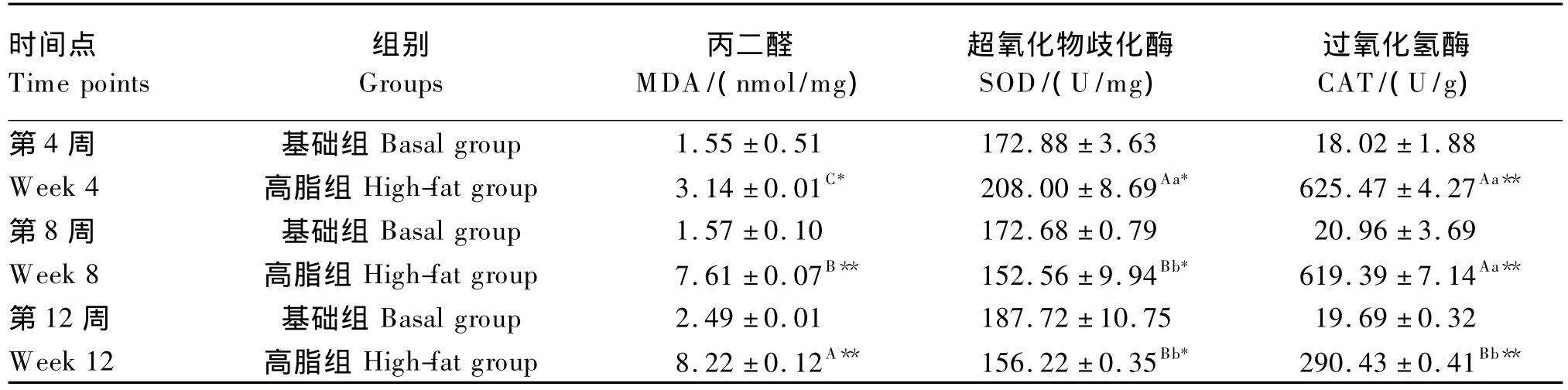
表5 12周内草鱼肝胰脏生化指标的变化Table5 Changes in hepatopancreas biochemical indices of grass carp within 12 weeks
2.5 草鱼肝胰脏ACC1 mRNA表达的变化
2%琼脂糖凝胶电泳结果显示,RT-PCR产物大小在150 bp以上,胶回收测序结果证实该产物是目的基因的扩增片段(图2)。经计算,高脂组草鱼肝胰脏ACC1 mRNA的相对表达量为1.11,较基础组极显著升高了33.7%(P<0.01,图3)。
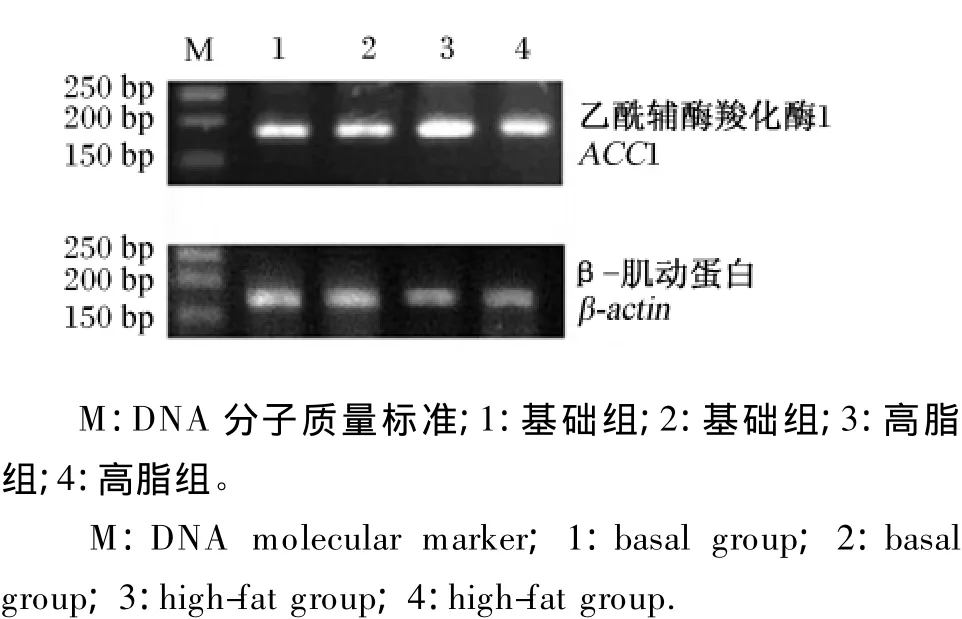
图2 RT-PCR产物电泳图谱Fig.2 Electrophoretogram of the RT-PCR products
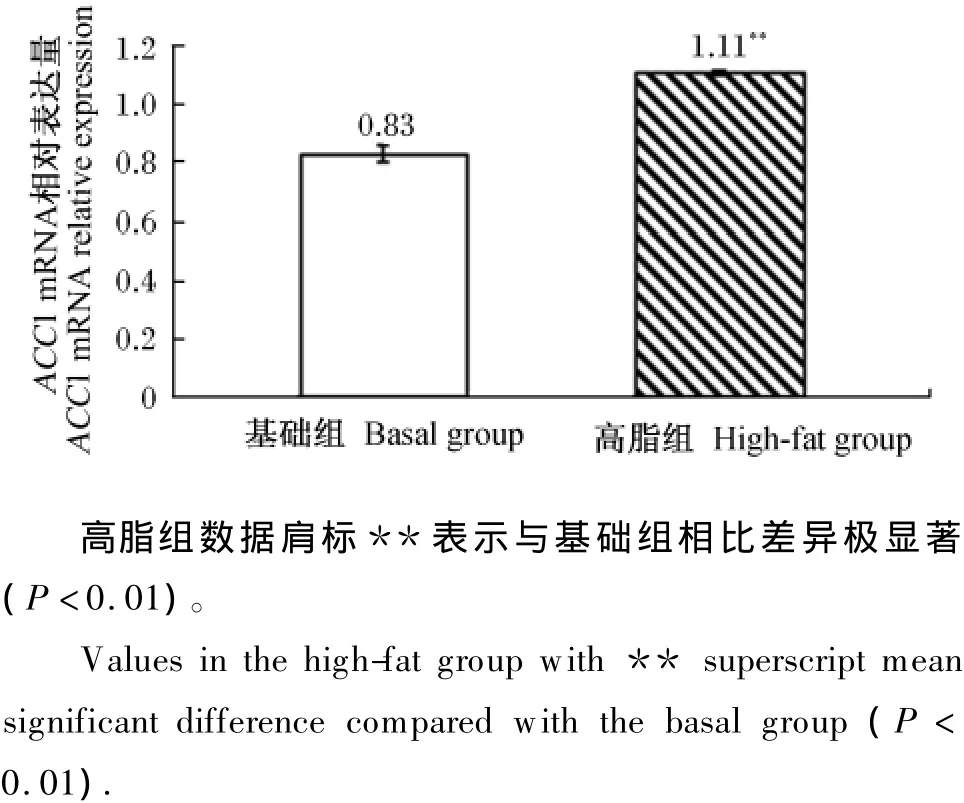
图3 第12周草鱼肝胰脏ACC1 mRNA的相对表达量Fig.3 Relative expression of ACC1 mRNA of grass carp on the week 12
3 讨论
3.1 草鱼高脂摄入与肝组织损伤
鱼类血清中TG和CHO主要源于肝脏的合成,血清中这2项指标的变化可在一定程度上反映肝脏对脂肪的代谢情况[9]。本试验中,基础组草鱼血清TG和CHO含量分别为1.33和3.24 mmol/L,而高脂组草鱼血清TG和CHO含量均随着投喂时间的延长而升高,试验第4周、第8周和第12周时这2项指标均显著或极显著高于基础组。有研究表明,饲料中的脂肪能被鱼类代谢为游离脂肪酸并被肝脏摄取[10]。Du等[5-6]研究发现,幼龄草鱼摄入高脂饲料6周后血浆TG和CHO含量升高,并出现了类似哺乳动物高脂血症的症状。本试验中草鱼摄入高脂饲料后,同样出现了血清TG和CHO含量持续升高的趋势,这说明投喂12周含8.1%脂肪的高脂饲料使草鱼摄入的游离脂肪酸过多,并进一步使肝脏合成的TG和CHO过量。这些过量的TG和CHO被转运出肝脏,使草鱼表现为血脂水平上升。
AST和ALT是存在于肝细胞胞浆内的2种重要转氨酶,当肝细胞发生损伤或坏死时这2种转氨酶释放入血液,因此血清中ALT和AST活性的异常升高常提示着肝脏已发生损伤或炎症[11-12]。在本试验中,从第4周开始,高脂组草鱼血清ALT和AST活性均极显著高于同期基础组。试验期间高脂组草鱼血清AST、ALT活性与饲料投喂时间呈正相关关系。肝胰脏组织学观察结果进一步证实,过量的脂肪摄入使草鱼肝细胞在试验第4周发生损伤,且在12周内使肝细胞损伤加重。
3.2 草鱼高脂摄入与肝胰脏脂质过氧化反应
MDA是脂质过氧化反应产生的最终产物,可在一定程度上反映机体的过氧化程度[11]。脂肪酸在氧化过程中可产生多种氧化应激诱导物,如活性氧(ROS)和自由基,它们既可以直接引起肝细胞损害,又可以通过攻击生物膜中的多不饱和脂肪酸,使肝脏发生氧化应激并最终产生MDA[13]。在本试验中,高脂组草鱼肝胰脏MDA含量在试验第4周已显著高于基础组,且MDA含量与饲料投喂时间呈正相关关系。这说明,连续投喂高脂饲料加速了草鱼肝脏对脂肪酸的氧化,此期间不断产生的氧化应激诱导物使MDA持续生成。
SOD和CAT都是动物机体重要的抗氧化酶,它们可以清除ROS和自由基,保护机体不受损伤,但过量的ROS和自由基可以抑制抗氧化酶的活性,使肝脏出现低抗氧化水平[14-15]。这在本试验高脂组草鱼上也有体现:试验第4周,草鱼肝胰脏中SOD和CAT活性分别达到了同期基础组的2和35倍;第8周时,高脂组这2种抗氧化酶的活性开始下降;到第12周时,这2种抗氧化酶活性均极显著低于第4周的检测结果。结合高脂组草鱼试验期间肝胰脏中MDA含量持续升高的结果,可以推断在高脂饲料投喂前4周,草鱼尚能通过不断提高肝胰脏中SOD、CAT的活性来清除机体产生的氧化应激诱导物,但过量的诱导物可能在第4周后超过了草鱼机体自身的清除能力,并开始抑制机体抗氧化酶的活性。
3.3 草鱼高脂摄入后ACC1 mRNA表达的变化
ACC1是肝脏内脂肪酸合成反应的限速酶,其活性的大小可以在一定程度上反映动物对脂肪的合成速率[8]。ACC1 mRNA的表达量受到食物、激素和其他一些生理因子的影响[16]。已有研究证实,哺乳动物进食高脂饲料后ACC1 mRNA的表达量增加,而处于饥饿状态时ACC1 mRNA的表达受到抑制[17]。而在鱼类上,对ACC1 mRNA表达量的研究较少。Matsumoto等[18]利用高脂饲料建立8周龄青鳉鱼的非酒精性脂肪肝模型,8周后发现试验鱼肝胰脏ACC1 mRNA表达量增加。而Kuwashiro等[19]在相同试验管理条件下从另一批8周龄青鳉鱼上却发现试验鱼进食同种高脂饲料8周后肝胰脏ACC1 mRNA表达量下降。本试验半定量RT-PCR分析结果显示,投喂高脂饲料12周后草鱼肝胰脏ACC1 mRNA相对表达量增加,极显著高于基础组,与Matsumoto等[18]的研究结果相符,由此推断投喂12周的含8.1%脂肪的高脂饲料使草鱼肝胰脏ACC1活性上升,加快了草鱼体内脂肪酸在肝脏中从头合成的速度。通过对比 Matsumoto 等[18]和 Kuwashiro 等[19]的试验可以发现,鱼类ACC1 mRNA表达量的变化除受高脂饲料影响外,还与试验动物的体质、体内脂肪酸合成和氧化的相互作用有关。本试验仅选取了草鱼体内脂肪酸长链合成中的1个限速基因作为研究对象,在后续的试验中还可以将更多参与脂肪酸代谢的相关基因纳入研究范围,结合病理形态学的观察和相关生化指标的检测,更全面地研究草鱼对过量脂肪酸的代谢模式。
4 结论
高脂饲料的连续投喂升高了草鱼的血脂水平,并使草鱼肝胰脏出现损伤,其作用机制可能与高脂饲料降低草鱼抗氧化能力以及促进肝脏脂肪合成有关。
[1]廖翔华,林鼎.养殖鱼类营养需求研究进展[J].水生生物学报,1989,13(2):170-186.
[2]刘珂珂,王华朗.草鱼饲料与营养需求研究进展[J].广东饲料,2008,17(3):36-38.
[3]雍文岳,黄忠志,廖朝兴,等.饲料中脂肪含量对草鱼生长的影响[J].淡水渔业,1985(6):11-14.
[4]DU Z Y,CLOUET P,DEGRACE P,et al.Hypolipidaemic effects of fenofibrate and fasting in the herbivorous grass carp(Ctenopharyngodon idella)fed a high-fat diet[J].British Journal of Nutrition,2008,100(6):1200-1212.
[5]DU Z Y,LIU Y J,TIAN L X,et al.Effect of dietary lipid level on growth,feed utilization and body composition by juvenile grass carp(Ctenopharyngodon idella)[J].Aquaculture Nutrition,2005,11(2):139-146.
[6]DU Z Y,CLOUET P,ZHENG W H,et al.Biochemical hepatic alterations and body lipid composition in the herbivorous grass carp(Ctenopharyngodon idella)fed high-fat diets[J].British Journal of Nutrition,2006,95(5):905-915.
[7]CHENG H,JI N,PENG Y,et al.Molecular characterization and tissue-specific expression of the acetyl-CoA carboxylase α gene from grass carp,Ctenopharyngodon idella[J].Gene,2011,487:46-51.
[8]BARBER M C,TRAVERS M T.Cloning and characterisation of multiple acetyl-CoA carboxylase transcripts in ovine adipose tissue[J].Gene,1995,154(2):271-275.
[9]程汉良,夏德全,吴婷婷.鱼类脂类代谢调控与脂肪肝[J].动物营养学报,2006,18(4):294-298.
[10]王兴强,段青源,麦康森,等.养殖鱼类脂肪肝研究概况[J].海洋科学,2002,26(7):36-39.
[11]金芬芬,徐团,秦圣娟,等.镉对长江华溪蟹肝胰腺线粒体抗氧化酶活力和脂质过氧化水平的影响[J].水生生物学报,2001,35(6):1019-1023.
[12]蒋永芳,旷晖峰.慢性乙型病毒性肝炎患者血清HBV DNA水平和谷丙转氨酶与肝组织病理的关系[J].重庆医科大学学报,2005,30(4):578-580.
[13]OLIVIRA C P M S,DA COSTA GAYOTTO L C,TATAI C,et al.Oxidative stress in the pathogenesis of nonalcoholic fatty liver disease,in rats fed with a choline-deficient diet[J].Journal of Cellular and Molecular Medicine,2002,6(3):399-406.
[14]WOLF J,WLOFE M.A brief overview of nonneoplastic hepatic toxicity in fish[J].Toxicologic Pathology,2005,33(1):75-85.
[15]GRATTAGLIANO I,VENDEMIALE G,CARACENI P,et al.Starvation impairs antioxidant defense in fatty livers of rats fed a choline-deficient diet[J].The Journal of Nutrition,2000,130(9):2131-2136.
[16]岳颖,刘国华,郑爱娟,等.生长动物脂肪代谢关键酶基因表达调控[J].动物营养学报,2012,24(2):232-238.
[17]O’CALLAGHAN B L,KOO S H,WU Y,et al.Glu-cose regulation of the acetyl-CoA carboxylase promoter PI in rat hepatocytes[J].Journal of Biological Chemistry,2001,276(19):16033-16039.
[18]MATSUMOTO T,TERAI S,OISHI T,et al.Medaka as a model for human nonalcoholic steatohepatitis[J].Disease Models & Mechanisms,2010,3(7/8):431-440.
[19]KUWASHIRO S,TERAI S,OISHI T,et al.Telmisartan improves nonalcoholic steatohepatitis in medaka(Oryzias latipes)by reducing macrophage infiltration and fat accumulation[J].Cell and Tissue Research,2011,344(1):125-134.
