急性内毒素损伤对奶山羊肝脏营养代谢的影响
2012-09-20王林枫赵志伟杨改青王月影朱河水韩立强杨国宇
王林枫 赵志伟 杨改青 王月影 朱河水 韩立强 张 震 杨国宇*
(1.河南农业大学农业部动物生化与营养重点实验室,郑州 450002;2.平顶山市畜牧局,平顶山 467000;3.河南农业大学生命研究中心,郑州 450002)
内毒素(lipopolysaccharide,LPS)是革兰氏阴性细菌(G-)细胞壁分解后释放出的含脂多糖类物质[1],可导致机体的热源性反应。正常情况下,机体内少量LPS随门静脉血进入肝脏,与肝脏枯否细胞上的Toll样受体4(TLR4)结合,启动肿瘤坏死因子 -α(TNF-α)、白细胞介素 -1β(IL-1β)等促炎症因子的转录,进一步引起炎症反应。少量的LPS刺激可以提高机体的免疫能力,当过量LPS进入肝脏则会引起强烈的炎症反应,影响肝脏营养代谢并降低动物的免疫能力,严重的还会发生内毒素血症[2]。研究报道,当动物发生内毒素血症时,肝脏[3]、肾脏[4]、肺脏[5]等内脏器官受到严重的损伤。由此可见,肝脏是最易受LPS伤害的主要靶器官之一,但过量的LPS进入肝脏后对肝脏营养代谢的影响还未见报道。本试验以奶山羊为研究对象,通过研究LPS所致急性肝脏损伤对肝脏营养物质代谢的影响,探索LPS对肝脏营养代谢的作用机制,为在生产中消除或减少LPS对动物健康和生产性能的影响提供科学依据。
1 材料与方法
1.1 试验动物与分组
选用健康、体况相近、年龄2.5~3.0岁、体重35~40 kg的关中奶山羊母羊18只,随机分为3组,每组6只,分别作为对照组(CTL组)、试验Ⅰ组(TⅠ组)和试验Ⅱ组(TⅡ组)。
1.2 饲养管理及饲粮组成
试验羊饲喂于代谢笼(专利号:2009203148043)内,单笼饲养,饲粮和饮水分别从料槽和水槽供给,定量饲喂,自由饮水。根据NRC(2007)[6]山羊饲养标准设计饲粮配方(表 1),饲粮精粗料比为30∶70(干物质基础),干物质中粗蛋白质含量为13.21%。饲喂量按山羊体重的3%供给,预试期14 d。
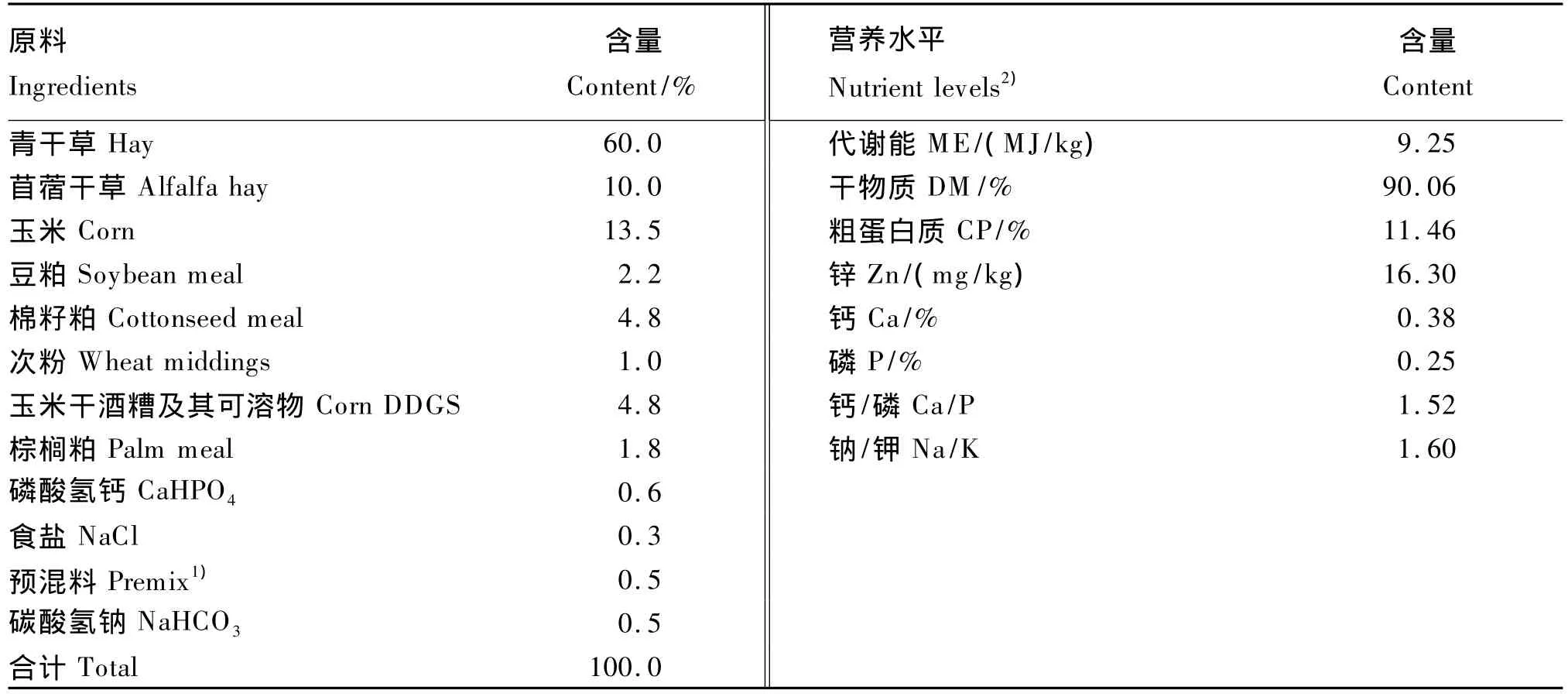
表1 饲粮组成及营养水平(风干基础)Table1 Composition and nutrient levels of the diet(air-dry basis)
1.3 试验处理
试验前对所有试验羊称重,并依据体重调整LPS注射液的浓度[试验前预先把LPS配制成0.5 mg/mL的溶液,LPS购自Sigma公司,其组成为大肠杆菌(E.coli)055∶B5]。试验开始时,TⅠ组、TⅡ组奶山羊分别按照100和200 μg/kg BW的剂量从颈静脉注射不同浓度的LPS注射液30 mL,CTL组奶山羊注射相同体积的生理盐水,详细方法及剂量参考Dow等[7]。
1.4 血样采集与处理
分别在注射 LPS 后 0、1、4、8、12、24 h 从奶山羊的颈静脉采血,每次采血时用真空抗凝采血管采血5 mL,立即以3 000 r/min离心15 min(离心机型号:TDZS-WS,湘仪离心机厂),分离血浆,置于EP管中,于-20℃保存待测。
1.5 指标测定及方法
肝脏代谢功能指标包括谷丙转氨酶(ALT)、谷草转氨酶(AST),营养代谢指标包括葡萄糖(GLU)、总蛋白(TP)、白蛋白(ALB)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HVDL)、总胆固醇(CHOL)、尿素氮(UN)。上述指标均采用全自动生化分析仪(Olympus AU640)检测,ALT、AST测定试剂盒购自上海长征复星生物科技有限公司,其他指标测定试剂盒购自山东奥期帮生物科技有限公司。
1.6 数据统计分析
试验数据用Excel 2007进行初步整理,应用SPSS 18.0软件进行统计学分析。用协方差分析校正初始值,用单因素方差分析(one-way ANOVA)进行组间比较,以Duncan氏法进行多重比较,结果均以“平均值±标准差”表示。方差分析中,以P<0.05为差异具有显著性意义。
2 结果与分析
2.1 LPS对奶山羊肝脏代谢功能的影响
从表2可以看出,血浆ALT活性平均值表现为TⅠ组>CTL组>TⅡ组,且 TⅠ组显著高于CTL组(P<0.05),CTL组显著高于TⅡ组(P<0.05)。从各时间点血浆ALT活性的变化趋势来看,在各时间点均表现为TⅠ组>CTL组>TⅡ组,在6 h前的各时间点3组之间差异不显著(P>0.05);12 h时,TⅠ组明显升高,TⅡ组和CTL组基本稳定,但各组之间仍差异不显著(P>0.05);24 h时,TⅠ组显著高于TⅡ组和CTL组(P<0.05),TⅡ组和CTL组之间差异不显著(P>0.05)。
与血浆ALT活性不同,血浆AST活性平均值表现为TⅠ组>TⅡ组>CTL组,TⅠ组显著高于TⅡ组和CTL组(P<0.05),但TⅡ组和 CTL组之间差异不显著(P>0.05)。从各时间点血浆ALT活性的变化趋势来看,1 h后TⅠ组就明显升高,并始终显著高于TⅡ组和CTL组(P<0.05),而TⅡ组和CTL组在各时间点均差异不显著(P>0.05)。
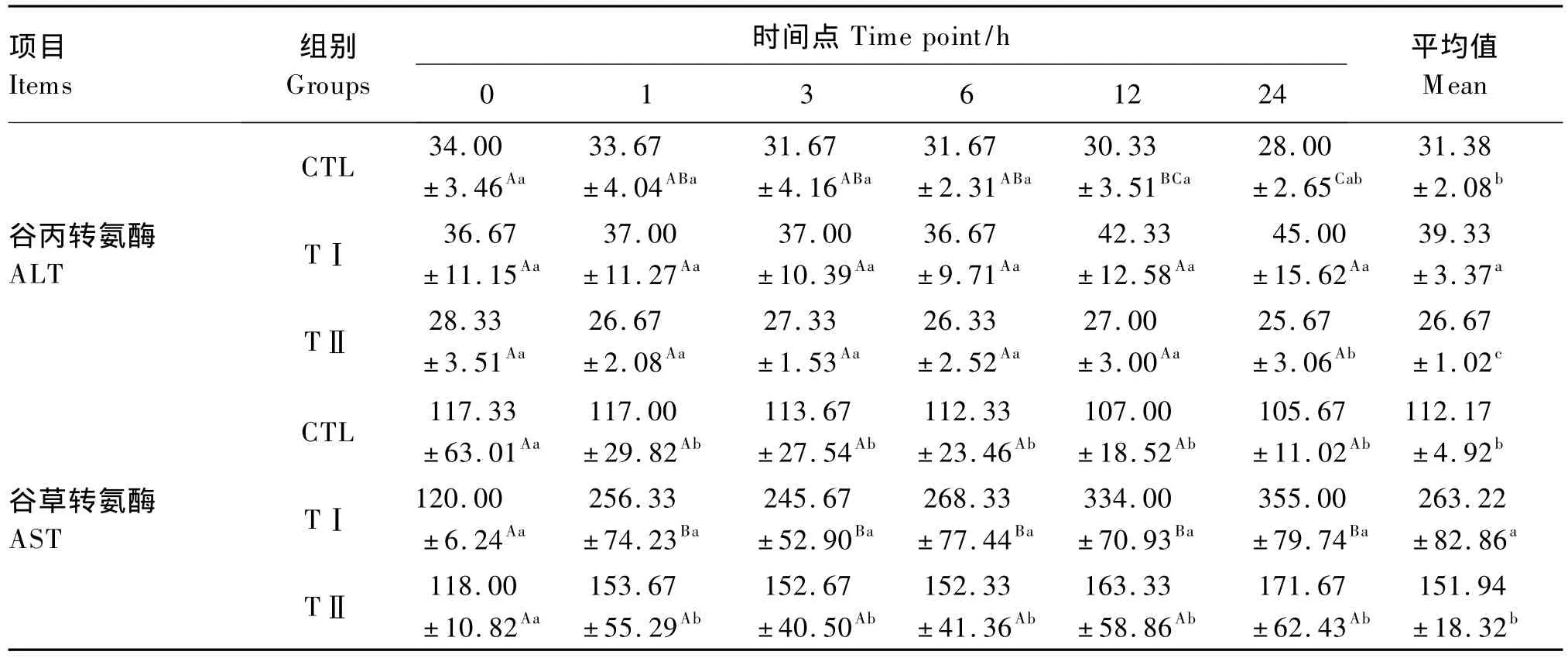
表2 各组奶山羊血浆ALT、AST活性Table2 Plasma ALT and AST activities of dairy goats in different groups U/L
2.2 LPS对奶山羊肝脏糖代谢的影响
从表3可以看出,血浆GLU含量平均值表现为CTL组>TⅡ组>TⅠ组,但各组之间均差异不显著(P>0.05)。随着时间的推移,CTL组血浆GLU含量基本稳定;TⅠ组和TⅡ组血浆GLU含量有较大的变化,表现为先升高,随后迅速降低,6 h时2组都降至最低,以后缓慢回升,TⅠ组回升的速度高于TⅡ组,但2组之间差异不显著(P>0.05)。
2.3 LPS对奶山羊肝脏蛋白质代谢的影响
由表4可以看出,血浆TP含量平均值表现为CTL组>TⅡ组>TⅠ组,TⅠ组和TⅡ组显著低于CTL组(P<0.05),而TⅠ组和TⅡ组之间差异不显著(P>0.05)。从各时间点血浆TP含量的变化趋势来看,CTL组基本稳定,各时间点变化不大;TⅠ组在6 h前持续降低,各时间点差异显著(P<0.05),6 h后稍有回升,各时间点差异不显著(P>0.05);TⅡ组表现为先降低,后稳定,6 h时最低,显著低于0和1 h时(P<0.05),6 h后基本稳定,各时间点差异不显著(P>0.05)。
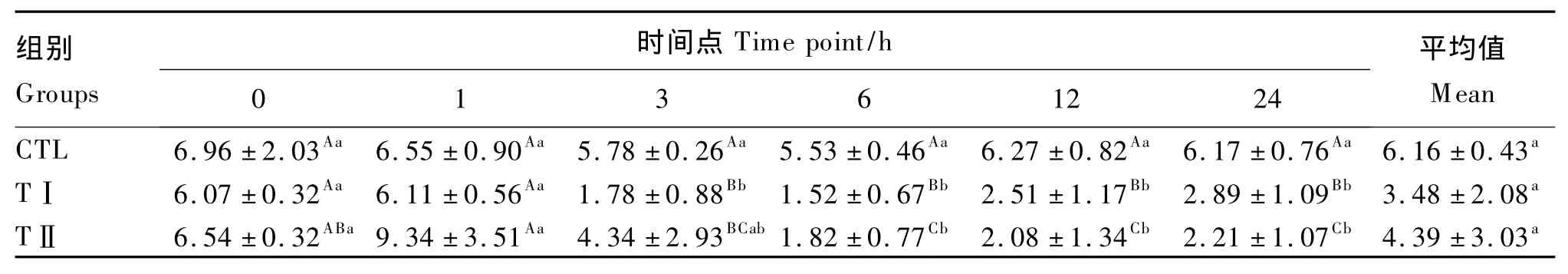
表3 各组奶山羊血浆葡萄糖含量Table3 Plasma glucose content of dairy goats in different groups mmol/L
血浆ALB含量平均值表现为CTL组>TⅠ组>TⅡ组,但各组之间均差异不显著(P>0.05)。随着时间的推移,CTL组血浆ALB含量基本稳定;TⅠ组和TⅡ组血浆ALB含量逐渐降低,TⅡ组降低的幅度大于TⅠ组,但2组之间差异不显著(P>0.05)。
血浆UN含量平均值表现为TⅡ组>TⅠ组>CTL组,CTL组显著低于 TⅠ组和 TⅡ组(P<0.05),但TⅠ组和TⅡ组之间差异不显著(P>0.05)。随着时间的推移,CTL组血浆UN含量基本稳定;TⅠ组和TⅡ组血浆LDL含量逐渐升高,1 h后显著高于CTL组(P<0.05),TⅡ组升高的幅度大于TⅠ组,但除在3和12 h时差异显著(P<0.05)外,其他时间点均差异不显著(P>0.05)。

表4 各组奶山羊血浆蛋白质类及尿素氮含量Table4 Plasma protein and urea nitrogen contents of dairy goats in different groups
2.4 LPS对奶山羊肝脏脂肪代谢的影响
由表5可以看出,血浆TG含量平均值表现为TⅠ组>TⅡ组>CTL组,TⅠ组和TⅡ组显著高于CTL组(P<0.05),而TⅠ组和TⅡ组之间差异不显著(P>0.05)。从各时间点血浆TG含量的变化趋势来看,从1 h开始的各时间点TⅠ组、TⅡ组均显著地高于CTL组(P<0.05),在各时间点TⅠ组均高于TⅡ组,且在3和6 h时达到显著水平(P<0.05)。
血浆LDL含量平均值表现为TⅠ组>TⅡ组>CTL组,TⅠ组显著高于TⅡ组和 CTL组(P<0.05),而TⅡ组和CTL组之间差异不显著(P>0.05)。随着时间的推移,TⅡ组血浆LDL含量基本呈下降趋势,在个别时间点间达到显著差异(P<0.05);TⅠ组和CTL组血浆LDL含量在各时间点变化不显著(P>0.05)。
血浆HDL含量平均值表现为TⅠ组>TⅡ组>CTL组,TⅠ组显著高于TⅡ组和 CTL组(P<0.05),TⅡ组显著高于 CTL组(P<0.05)。随着时间的推移,TⅠ组血浆HDL含量表现为缓慢升高的趋势,除个别时间点外,大多数时间点差异不显著(P>0.05);TⅡ组和CTL组血浆HDL含量在各时间点变化不显著(P>0.05)。
血浆CHOL含量平均值表现为TⅠ组>TⅡ组>CTL组,TⅠ组显著高于TⅡ组和 CTL组(P<0.05),TⅡ组显著高于CTL组(P<0.05)。随着时间的推移,CTL组血浆CHOL含量在各时间点变化不显著(P>0.05);TⅠ组血浆CHOL含量表现为先降低后升高的趋势,6 h后开始升高,24 h时显著高于其他各时间点时(P<0.05);TⅡ组血浆CHOL含量表现为先升高后降低再升高的趋势,6和12 h时较低,显著低于1 h时(P<0.05),其他各时间点之间差异不显著(P>0.05)。
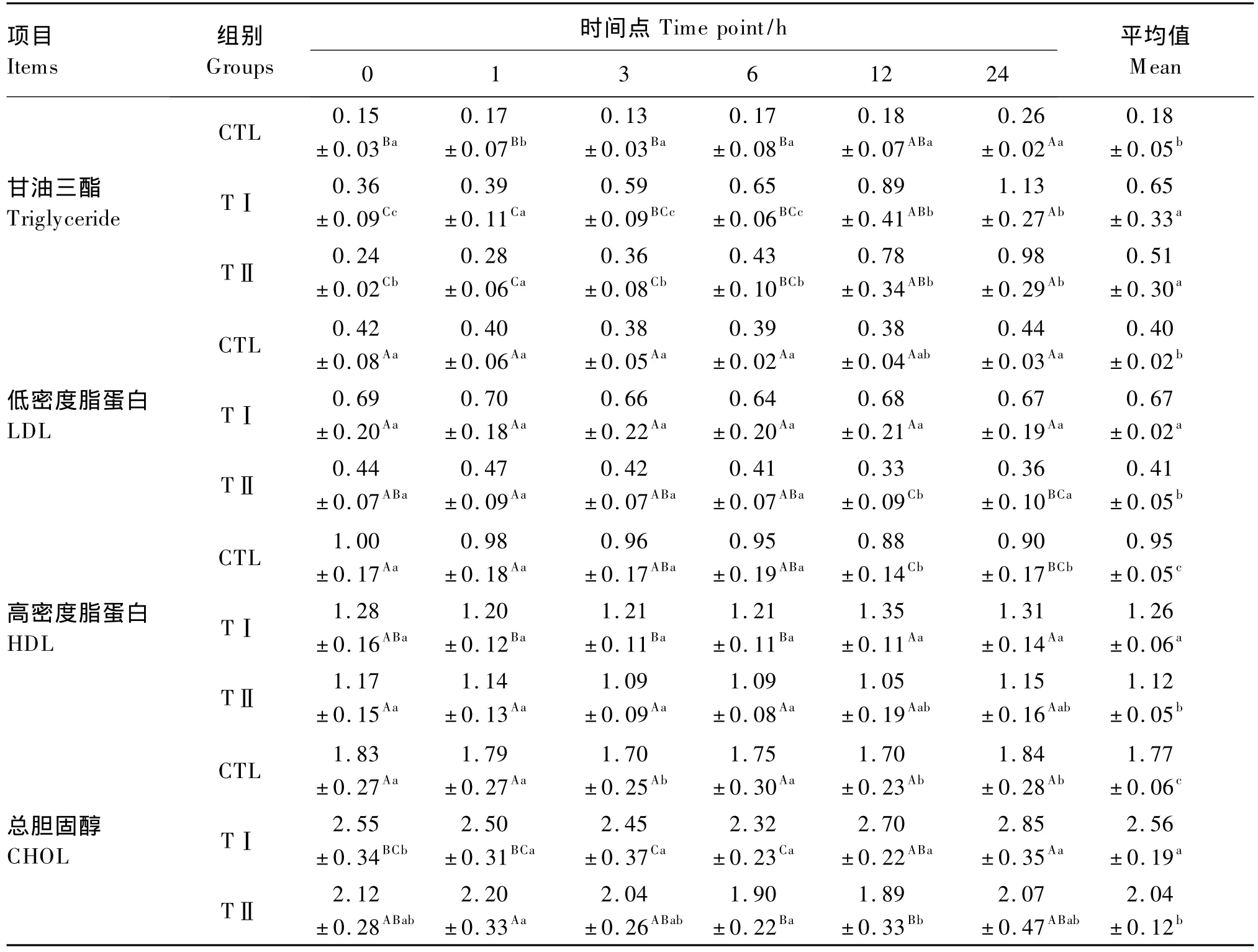
表5 各组奶山羊血浆中脂类的含量Table5 Plasma lipid contents of dairy goats in different groups mmol/L
3 讨论
3.1 LPS对奶山羊肝脏代谢功能的影响
ALT是肝细胞中主要的代谢酶,是可逆地催化丙酮酸和谷氨酸之间氨基酸转移的酶,以磷酸吡哆醛作为辅助因子。ALT主要存在于肝细胞浆,很少外泄,胞内浓度是血浆浓度的1 000~3 000倍,只有肝细胞受到损伤或坏死,才有大量ALT进入血液,引起血浆ALT活性升高,肝细胞坏死增加1%就可使血浆中ALT活性升高1倍。因此,ALT是反映肝功能损伤程度最敏感的指标之一。本试验中,TⅠ组血浆ALT活性显著高于CTL组,表明100 μg/kg BW 剂量的 LPS对肝细胞已造成明显损伤;TⅡ组ALT活性低于CTL组,表明200 μg/kg BW剂量的LPS对肝脏已不具有损伤,证明LPS对肝脏的损伤与剂量有关,高剂量的LPS可减轻对肝脏的伤害,至于多高剂量时开始减轻,目前还未见研究报道。关于高剂量LPS对肝脏损伤降低的原因,目前的解释是LPS对细胞的作用需通过LPS结合蛋白(LBP)介导与CD14(一种细胞因子,参与LPS的受体组成)形成复合物后才能够与TLR4结合,激活下游信号通路,产生炎症因子,损伤肝细胞。已研究表明,LBP的增敏效应与剂量有关,高剂量的LPS对LBP的增敏效应有抑制作用,抑制了LPS与CD14的结合,从而阻止了LPS所引起的炎症反应,减轻了其对肝细胞的伤害[8]。此外,杀菌通透性增加蛋白(BPI)和HDL均可抑制LPS与受体的结合,降低其对肝细胞的损伤[9-10]。
AST是一种具有磷酸吡哆醛依赖性、由细胞核基因编码的线粒体酶,催化天冬氨酸的氨基转移到α-酮戊二酸形成草酰乙酸和谷氨酸及其逆反应。肝脏内的谷草转氨酶有2种同工酶,分别存在于肝细胞的胞浆内(sAST)和线粒体内(mAST)。当肝细胞受损或任何原因引起肝细胞膜通透性增加时,位于肝细胞内的AST逸出细胞进入血液,使血浆AST活性增高[11]。在肝细胞轻度病变时,仅 sAST释放入血;当病变严重时,mAST也会相继释放入血,故AST活性的高低可反映肝细胞的损伤程度和坏死量[12]。另有研究表明,mAST易于被网状免疫系统清除,其清除率比sAST快5倍。若肝细胞急性损伤得以缓解,则血浆中mAST很快下降,甚至恢复到正常水平[13]。因此,mAST不仅作为判断细胞坏死的指标,也是对肝脏疾病动态监测的指标[14]。本试验中,TⅠ组、TⅡ组奶山羊血浆AST活性高于CTL组,表明TⅠ组、TⅡ组奶山羊的肝脏在LPS的作用下受到损伤;而TⅡ组AST活性低于TⅠ组,表明TⅡ组奶山羊的肝脏损伤有所缓和,证明LPS对肝脏的伤害与剂量有关。
3.2 LPS对肝脏糖代谢的影响
肝脏是反刍动物糖异生的重要器官,大量LPS进入机体以后,会造成急性肝功能衰竭内毒素血症,同时刺激机体产生多种内源性介质和细胞因子,肝脏糖异生受到抑制,导致血糖含量降低[15]。但由于应激,在注射LPS后的短时间内血糖含量表现为升高,之后,随着时间的延长,表现为低血糖症状。此外面,注射LPS后,由于LPS的毒性作用导致细胞缺血缺氧,细胞有氧代谢减弱,无氧酵解增强,对葡萄糖的需求增加,糖异生增强,使血糖含量在短时间内升高。随着时间的推移,由于糖异生受到抑制,最终导致血糖含量降低[16]。本试验中,注射LPS后血糖(血浆葡萄糖)含量表现出先升高后降低的趋势,证明了上述结论。LPS抑制肝脏糖异生的分子机制有待进一步研究。
3.3 LPS对肝脏蛋白质代谢的影响
肝脏在蛋白质代谢过程中起重要作用,血浆内蛋白质几乎全部由肝脏合成,TP主要包括ALB和球蛋白(GBL),其中ALB占到40% ~60%。血浆ALB是机体各组织合成自身蛋白质的原料,是许多脂溶性物质的非特异性运输载体,在维持血浆胶体渗透压方面也起着重要作用,因此,血浆TP、ALB含量是反映肝脏健康状况的重要指标。本试验中,TⅠ组和TⅡ组TP、ALB含量不同程度地降低,表明肝脏受到损伤后合成蛋白质的能力减弱。
本试验中,TⅠ组和TⅡ组的血浆UN含量升高,表明肝脏内蛋白质的分解增加,产生大量的尿素,在LPS中毒的情况下,奶山羊的采食量和消化活动受到很大影响,尿素循环和再利用减少,使血浆UN含量升高。肾脏是尿素的主要排泄器官。肝损伤后,肾脏的功能受到影响,氮的排泄受到影响。研究发现,LPS诱导后小鼠血清尿素的水平较诱导前显著升高[17]。LPS引起肾功能损伤后,导致尿素排泄障碍,是血浆UN含量升高的另外一个重要原因[18]。本试验中,奶山羊血浆UN含量随着剂量的加大而升高,表明LPS对奶山羊肾脏功能的损伤与剂量呈正相关。
3.4 LPS对脂肪代谢的影响
研究表明,LPS促进脂肪酸氧化,使脂肪分解增强、血脂增高,从而引起肝脏脂代谢紊乱[19-20]。LPS及其他的炎症因子,如TNF-α、白细胞介素-1(IL-1)、白细胞介素-2(IL-2)等,通过刺激肝脏中富含TG的VLDL的释放而使血浆TG含量升高[21];LPS通过降低脂蛋白酯酶(LPL)活性抑制其对TG的清除,炎症也能减少血浆富含TG的脂蛋白的清除[22]。由于肝脏损伤,一方面,VLDL的合成和分泌减少,使血液中游离脂肪酸(FFA)的含量增多,导致大量的TG在肝脏内沉积;另一方面,肝脏内发生大量的氧化,肝脏损伤后其抗氧化能力减弱,大量的自由基在肝脏中蓄积,进一步加重了肝脏的损伤[22]。本试验中,TⅠ组、TⅡ组血浆TG含量均高于CTL组,并随时间延长逐渐升高,与上述研究结果相同;且血浆TG含量TⅡ组较TⅠ组有所下降,表明LPS对TG的升高作用与剂量有关,高剂量的LPS对TG的升高作用反而降低。
HDL和CHOL是肝脏脂肪代谢过程中的重要组成物质。膜转运蛋白三磷酸腺苷结合盒转运体(ABCA1)可将游离胆固醇从胞内流向胞外,与载脂蛋白AⅠ(ApoAⅠ)等结合形成HDL,逆向运回肝脏,在清除外周血胆固醇的过程中发挥作用。研究表明,LPS能干扰CHOL的逆转运过程,通过抑制CHOL逆转运相关蛋白干扰CHOL的逆转运,造成细胞内 CHOL 积聚[22]。Ruan 等[23]研究证实,LPS可抑制ABCA1基因的表达,使细胞内CHOL含量升高;Castrillo等[24]证实,通过肝脏 X受体(LXR)和Toll样受体(TLR)通路交互作用,LPS激活TLR4通路后抑制LXR通路,使巨噬细胞膜转运蛋白ABCA1和载脂蛋白E(ApoE)的基因表达减少,减弱CHOL的逆转运。研究表明,高脂负荷显著下调卵磷脂胆固醇脂酰转移酶(LCAT)mRNA的表达水平,导致血浆LCAT的活性降低,进而使HDL表面游离CHOL的酯化减少,降低了HDL对外周组织CHOL的清除能力,增加动脉粥样硬化(AS)发生的可能性[25]。本试验中,TⅠ组、TⅡ组CHOL含量升高可能是LPS干扰CHOL的逆向转运,导致血液中CHOL无法正常运往肝脏而积聚,并导致HDL含量的上升。
HDL是将肝外组织的CHOL运送到肝脏的运载工具,可以防止游离CHOL在肝外组织细胞上的沉积。HDL主要在肝脏、小肠中合成,降解主要在肝脏中。HDL通过CHOL的逆向转运,把外周组织中衰老细胞膜上以及血浆中的CHOL运回肝脏代谢,是脂代谢中的重要物质。据报道,各种脂蛋白,如 LDL、VLDL、HDL 和 VHDL,对 LPS 均有一定解毒作用,其中以HDL与LPS的结合能力最高,可有效地清除血液中的 LPS[8,26]。但不同剂量的LPS对其与HDL的亲和力以及清除效率的影响,尚待进一步研究。
4 结论
①LPS可引起肝脏损伤,进而对奶山羊肝脏营养代谢造成影响。
②LPS对奶山羊肝脏营养代谢的影响与LPS的剂量有关。
[1]王磊,于丽萍,窦科峰.内毒素致枯否细胞中NF-κB的激活及其意义[J].宁夏医学院报,2003,25(4):239-241.
[2]MORRISON D S,RYAN J C.Endotoxin and disease mechanism[J].Annual Review of Medicine,1987,38:417-432.
[3]毕铭华,张淑文,王宝恩,等.内毒素血症对大鼠肝细胞线粒体的损伤及其机制[J].中国应用生理学杂志,2004,20(1):90-92.
[4]董宇杰,丁春华,张智,等.褪黑素对内毒素致大鼠急性肺损伤的保护作用[J].中国应用生理学杂志,2010,26(4):481-484.
[5]郭德玉,谯怡然.内毒素介导的肾脏病变及其发生机理的实验研究[J].临床与实验病理学杂志,1995,11(3):226-229.
[6]NRC.Nutrientrequirementsofsmallruminants:sheep,goats,cervids and New World camelids[S].Washington,D.C.:National Academy Press,2007.
[7]DOW T L,ROGERS-NIEMAN G,HOLÁSKOVÁ I,et al.Tumor necrosis factor-α and acute-phase proteins in early pregnant ewes after challenge with peptidoglycan-polysaccharide[J].Domestic Animal Endocrinology,2010,39:147-154.
[8]郑瑞丹,徐成润.脂多糖/脂多糖结合蛋白与杀菌通透性增进行蛋白研究进展[J].临床军医杂志,2007.35(6):933-936.
[9]SCHRODER N W,SCHUMANN R R.Non-LPS targets and actions of LPS binding protein(LBP)[J].Journal of Endotoxin Research,2005,11(4):237-242.
[10]AZUMA M,MATSUO A,FUJIMOTO Y,et al.Inhibition of lipid A2 mediated typeⅠinterferon induction by bactericidal/permeability-increasing protein(BFI)[J].Biochemical Biophysical Research Community,2007,354(2):574-578.
[11]査锡良,周春燕,周爱儒,等.生物化学[M].北京:人民卫生出版社,2008:409.
[12]郑晓丰.m-AST、RBP、PA、ADA和 FN在肝脏疾病诊断中的临床评价[J].检验医学,2009,24(12):886-888.
[13]康格非.临床生物化学与生物化学检验[M].2版.北京:人民卫生出版社,1999:166.
[14]HASANJANI-ROUSHAN M R,HAJIAHMADI M,SHAFAIE S.Histopathological features of liver and its relation to serum transaminase levels in 91 cases of anti-HBe-positive chronic hepatitis B[J].The International Journal of Clinical Practice,2005,59(7):79l-794.
[15]朱永芬,田德英.内毒素对SD大鼠急性肝功能衰竭模型血糖代谢影响的研究[J].内科急危重症杂志,2006,12:119-121.
[16]JANICE J,STEVE S C,ANNA M D.Mechanisms of disease progression in nonalcoholic fatty liver disease[J].Seminar in Liver Disease,2008,28(4):370-379.
[17]KENT D,ASADA L,PETER S T,et al.Animal models of sepsis and sepsis-induced kidney injury[J].The Journal of Clinical Investigation,2009,119(10):2868-2878.
[18]章蔚,方才,言虎.不同剂量6%羟乙基淀粉130/0.4预先给药对大鼠内毒素性急性肾损伤的影响[J].安徽医科大学学报,2007,42(6):672-675.
[19]李生,吴万春.内毒素与脂肪肝的关系研究进展[J].国际消化病杂志,2007,27(3):205-207.
[20]YOSHIMATSU M,TERASAKI Y,SAKASHITA N,et a1.Induction of macrophage scavenger receptor M ARCO in nonalcoholic steato-hepatitis indicates possible involvementofendotoxin in its path-ogenic process[J].International Journal of Experimental Pathology,2004,85:335-343.
[21]FABBRINI E,SULLIVAN S,KLEIN S.Obesity and nonalcoholic fatty liver disease:biochemical,metabolic,and clinical implications[J].Hepatology,2010,51:679-689.
[22]叶强,雷寒.内毒素、炎症与脂质代谢紊乱的研究进展[J].心血管病学进展,2008,29(5):782-784.
[23]RUAN X Z,MOORHEAD J F,FERNADO R.Regulation of lipoprotein trafficking in the kidney role of inflammatory mediators and transcription factors[J].Biochemical Society Transactions,2004,32:88-91.
[24]CASTRILLO A,JOSEPH SB,VAIDYA SA.Crosstalk between LXR and toll-like receptor signaling mediates bacterial and viral antagonism of cholesterol metabolism[J].Molecular Cell,2003,12:805-816.
[25]张娜,赵斐,张勇.有氧运动改善高脂血症分子机理的研究Ⅲ.运动上调饮食性高胆固醇血症大鼠肝脏LCAT和apoAI基因表达[J].中国运动医学杂志,2001,20(3):232-235.
[26]LEVELS J H,AHRAHAM P R,VANDEN E A,et al.Distribution and kinetics of lipoprotein-bound endotoxin[J].Infection and Immunity,2001,69(5):2821-2828.
