芬太尼对蛛网膜下腔出血后脑血管痉挛的影响
2012-09-05刘玉明马建荣
刘玉明,马建荣
(中南大学湘雅医院神经外科,湖南长沙410007)
芬太尼对蛛网膜下腔出血后脑血管痉挛的影响
刘玉明,马建荣
(中南大学湘雅医院神经外科,湖南长沙410007)
目的研究芬太尼(Fentanyl)对蛛网膜下腔出血后脑血管痉挛的影响及其作用机制。方法选用健康成年家兔72只,随机分成假手术对照组(A组)、SAH组(B组)、芬太尼静脉干预组(C组)、芬太尼肌注干预组(D组)。每天进行神经生物学评分,并在实验24 h、72 h、7 d后处死,取基底动脉进行H-E染色,观察管壁情况,同时取左侧海马分别行HE染色及免疫组化染色,观测神经元密度、Bcl-2及Bax的表达。结果SAH后Bcl-2、Bax表达均增加,芬太尼干预后Bcl-2表达升高,Bax表达下降。B组的神经生物学评分、神经元密度、Bcl-2及Bax的表达与C、D组差异有统计学意义(P<0.05)。结论芬太尼可抑制CVS后细胞凋亡,可能通过促进SAH家兔Bcl-2的表达而抑制Bax表达。
脑血管痉挛;芬太尼;家兔;脑保护;Bax;Bcl-2
脑血管痉挛(CVS)作为蛛网膜下腔出血(Subarachnoid hemorrhage,SAH)后的常见并发症以及致残、致死的重要原因,已经得到多家研究证实[1],其发生率达30%~90%,常导致十分严重的脑组织缺血缺氧或者迟发性的缺血性脑损害,甚至出现脑梗死。目前尽管对SAH后CVS的机理进行了广泛的研究,但其发病机制仍未完全阐明。既往研究表明,阿片受体激动剂能够减轻组织的缺血再灌注损伤[2],本实验的目的在于通过建立SAH模型,观察实验中家兔基底动脉管壁变化和脑组织切片中神经元存活数及Bax、Bcl-2表达强度的变化情况,从而研究芬太尼对于SAH后CVS的脑组织有无保护作用以及其可能机制。
1 材料与方法
1.1 动物及分组选取健康的成年家兔72只(湘雅医学院动物学部提供),性别不限,兔龄3~4个月,体重1.5~2.5 kg。随机分成4组,每组18只,每组都依次按照设计的三个时间点(24 h、72 h、7 d)随机再分为3个亚组,故共含12个亚组。A组为对照的假手术组,B组为SAH组,C组为芬太尼静脉干预组,D组为芬太尼肌注干预组。
1.2 药品及试剂芬太尼(湖北宜昌人福药业,每支0.1 mg),SA1022型SABC型免疫组化试剂盒,多聚体抗兔IgG-HRP(SV0002-12),DAB显色试剂盒(AR1022),Bcl-2多抗,Bax多抗(均为武汉博士德公司)。
1.3 制作实验动物模型、药物干预及标本处理采用枕大池二次注血法+一侧颈内动脉结扎法[3],手术中采用10%水合氯醛(200 mg/kg)经耳缘静脉注射行全身麻醉。先行结扎右侧颈内动脉:将家兔仰卧,束缚四肢及兔牙,固定于实验台四角,颈部中部及右侧备皮,75%酒精消毒,加用1%利多卡因行局部麻醉,选颈部正中偏右侧切口,长约5 cm,找到右侧颈总动脉,远、近端穿线,远心端先结扎。用22 G头皮针朝向近心端插入颈内动脉,抽取动脉血(约2 ml)备用,结扎近心端,关闭切口,消毒。快速将家兔改俯卧为,再次固定,行枕大池注血操作:项背部备皮、消毒、局麻同前,切口取枕外粗隆至第二颈椎的枕下正中部位,长约3 cm,显露至寰枕筋膜,采用自制穿刺针小心穿刺,进针深度为超过筋膜约1 mm,缓慢回抽,抽出脑脊液约1.5 ml,再缓慢注入上述采取的自体动脉血1 ml,双击电凝电凝穿刺部位防止脑脊液漏。止血,抗生素(无菌生理盐水稀释的庆大霉素)冲洗,缝合,消毒。让家兔保持头低脚高位30 min,以保证基底池有注入的血。48 h后行枕大池第二次注血,操作基本同前。假手术组仅做两次同样的手术切口来显露右侧颈总动脉和寰枕筋膜,并行两次结扎右侧颈总动脉的手术操作。
1.4 方法枸橼酸芬太尼注射液用法:C组按0.05 mg·kg-1·次-1用生理盐水稀释10倍后缓慢耳缘静脉注射;D组按0.05 mg·kg-1·次-1稀释一倍后行大腿肌肉注射,均为2次/d,中间间隔1 h。根据实验设计分别再饲养24 h、72 h、7 d后处死并采集标本。先行灌注再断头取脑,灌注前予10%水合氯醛(200 mg/kg)耳缘静脉注射麻醉。将家兔仰卧位固定于实验台上,开胸,于膈肌上用止血钳夹闭胸主动脉及下腔静脉,再经心尖行左心室插管。插管成功后剪开右心耳,先用300 ml生理盐水加压(灌注液体液平面与试验台的垂直距离>70 cm)冲洗至冲洗液变淡红色或澄清,再用4%多聚甲醛溶液灌注,直至流出液体变清或家兔双上肢抽搐后僵硬,迅速断头取脑。在视交叉后方1.4 cm及2.0 cm处垂直于基底动脉,切开脑干获取带基底动脉的脑组织冠状切片,同时沿着纵裂剖开标本大脑,分离获取左侧海马组织。两种组织标本进行常规操作,获取病理切片,再进行H-E染色及Bcl-2、Bax免疫组化。
1.5 数据、图片采集
1.5.1 家兔神经生物学评分方法于家兔处死前,每组实验动物每天进行一次神经生物学评分,内容包含摄食及神经功能障碍的有无及障碍程度,详细的评分标准如下:(1)摄食评分:食量100%,1分;50%~99%,2分;<50%,3分;0%,4分。(2)神经功能障碍分级(4级):正常,1级;轻度或可疑障碍(嗜睡、活动减少),2级;中度障碍不伴运动异常(肢体无力),3级;重度障碍伴运动异常(划圈运动或行走困难);4级。
1.5.2 基底动脉的HE切片观察采用双盲法,使用光学显微镜将图像放大100倍,观测基底动脉血管形态,并进行图像采集。
1.5.3 左侧海马的神经元切片观察采取双盲法,应用400倍的光学显微镜,在显微镜下选取500μm长度海马CA1区,计数此范围内正常的神经元细胞数量,从而获得神经元密度(个/mm)(该区的正常神经元数与该区长度的比值)。共求得8个数据,求出平均值,即为这个实验标本的观测指标,作为评价缺血程度的指标。
1.5.4 观察免疫组化结果采取标本及切片都严格根据免疫组化试剂使用说明书来操作。正常情况下Bcl-2、Bax表达和染色程度的关系呈正相关。具体检测方法:400倍镜下,在基底动脉的内皮细胞处或者海马部位CAI区随机取8个视野,采用Motic Images Advanced 3.0图像分析软件,得出Bcl-2和Bax阳性细胞光密度值,两个指标分别取其平均光密度值作为阳性细胞的表达强度值。
1.6 统计学处理应用SPSS17.0统计软件来进行数据的统计分析处理。计量资料:采用均数±标准差(),多组间比较采用单因素方差分析,并进行组间资料的多重比较。数据符合正态分布、方差齐者,用LSD检验方法;而数据不符合正态分布、方差不齐者,用Tamhane检验方法。计数资料:采纳完全随机设计的多样本比较的秩和检验,P<0.05为差异有统计学意义。相关的图表制作采用Office Word 2003办公软件。
2 结果
2.1 神经生物学评分结果及分析具体结果见表1、表2及图1、图2,可见SAH后出现饮食量减少及神经功能障碍的家兔数量均随时间的变化有一个渐进性增多,复又减少的过程。
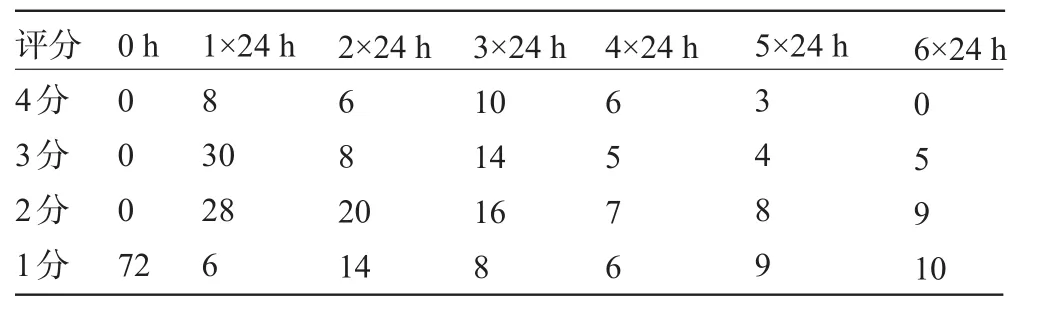
表1 家兔在各时间点摄食评分中的分布情况(只)
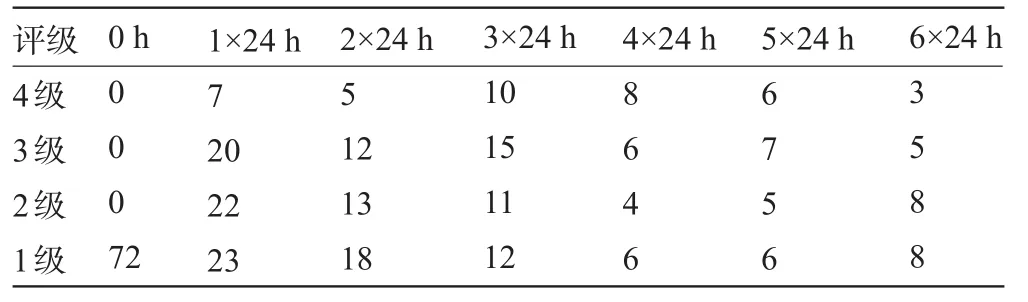
表2 家兔在各时间点神经功能评级中的分布情况(只)
图1 家兔在各时间点进食评分中的分布情况(只)

图2 家兔在各时间点神经功能评级中的分布情况(只)
2.2 HE染色结果
2.2.1 各实验组的基底动脉在镜下的表现A组:基底动脉管壁表现为平滑、无增厚,各内皮细胞的结构较完整,内层的弹力膜清晰可见,结构亦完整;中膜的平滑肌层较薄,环绕在血管腔周围;外膜主要包含成纤维细胞以及其周边的疏松结缔组织;在血管外膜和蛛网膜之间仅仅散在分布有少量细胞。B组:血管管径缩小,内皮细胞变性、肿胀,染色质不均,出现空泡,内层弹力板迂曲甚至断裂,厚薄不均;平滑肌层明显增厚,平滑肌细胞出现增生、结构紊乱;血管外膜与蛛网膜之间可见到多数炎性细胞(如淋巴细胞、单核细胞以及中性粒细胞等)浸润。C、D两组血管表现为不太规则的轻度收缩,管腔直径轻度减小,管壁无明显增厚,内层弹力板无明显皱褶,内皮细胞略有肿胀,在血管外膜与蛛网膜之间可在少部分见到浸润的炎性细胞。
2.2.2 脑组织CA1区镜下表现A组:神经元细胞呈圆形或者近似圆形,大小较均一,排列整齐有序,胞浆为淡淡红色,细胞核为蓝黑色,核大而圆,核仁清晰,染色质均匀分布,偶尔可见细胞凋亡。B组:有大量锥体细胞凋亡,体积缩小,细胞结构模糊不清,导致神经元数量明显减少,残存的神经元可见噬神经细胞现象。C组和D组亦见细胞凋亡表现,但在同时间点时要较B组为轻,细胞排列较B组整齐。说明芬太尼能对SAH后的血管痉挛和继发的缺血损伤起到保护作用,见图3。
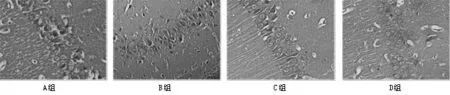
图3 兔海马CA1区神经元形态(HE染色×400)
2.2.3 神经元密度在统计学比较上,假手术A组与手术三组B、C、D组比较差异有统计学意义(P<0.05),给药组C组和D组与未给药组B组比较差异有统计学意义(P<0.05),给药干预组中,C组与D组两组比较差异无统计学意义(P>0.05),各个实验组结果的具体数据参见表3。
表3 神经元密度()
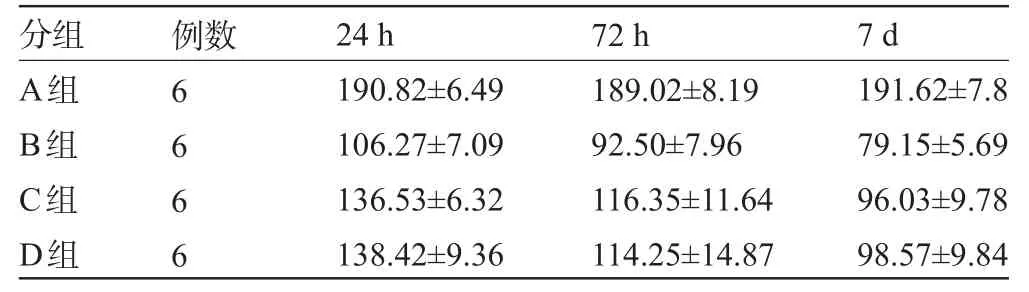
表3 神经元密度()
A组B组C组D组6 6 6 6 190.82±6.49 106.27±7.09 136.53±6.32 138.42±9.36 189.02±8.19 92.50±7.96 116.35±11.64 114.25±14.87 191.62±7.8 79.15±5.69 96.03±9.78 98.57±9.84
2.3 免疫组化染色观察结果
2.3.1 bcl-2染色结果的阳性表达Bcl-2阳性细胞在镜下主要表现为胞质弥漫性染色且较均匀,胞质呈棕黄色。海马区神经元细胞中bcl-2阳性细胞的表达:A组内表达得很少,组内比较差异无统计学意义(P>0.05);B、C、D组海马CA1区bcl-2表达均有升高,但升高程度不同,与B组相比,C、D组阳性细胞数多且较强;三组bcl-2阳性细胞数在72 h时均较24 h及7 d时低,但具体最低谷在何时难以反映;C、D组在各个时间点bcl-2阳性细胞均比B组多(P<0.05);而C、D组两组之间进行比较,差异无统计学意义(P>0.05),见图4、表4。

图4 兔海马CA1区Bcl-2免疫组化(DAB显色×400)
表4 家兔海马CA1区bcl-2阳性细胞表达强度均值()
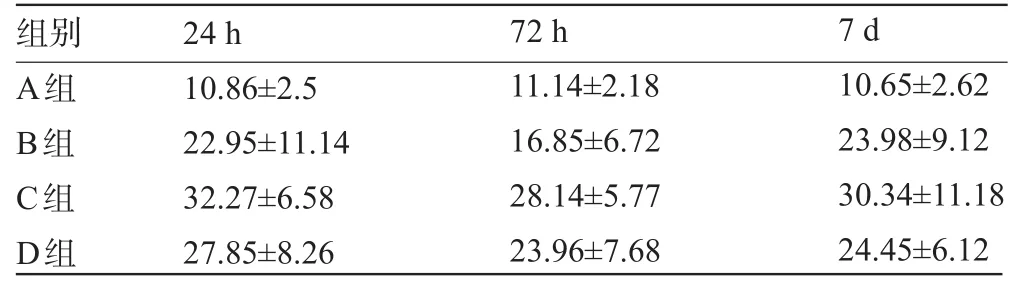
表4 家兔海马CA1区bcl-2阳性细胞表达强度均值()
A组B组C组D组10.86±2.5 22.95±11.14 32.27±6.58 27.85±8.26 11.14±2.18 16.85±6.72 28.14±5.77 23.96±7.68 10.65±2.62 23.98±9.12 30.34±11.18 24.45±6.12
以上结果显示:单纯的进行脑组织外操作而产生的切口损伤对于脑组织内bcl-2的表达没有明显的影响,而蛛网膜下腔出血可以增加脑组织中bcl-2的表达,而加用的药物芬太尼同样促使SAH后脑组织内bcl-2的表达升高
2.3.2 bax染色结果的阳性表达以及对结果的分析类似Bcl-2染色的阳性细胞,、Bax阳性细胞在镜下也主要表现为胞质弥漫性染色且较均匀,胞质颜色为棕黄色。计数方法同Bcl-2阳性细胞计数。从结果上看,对照组A组,在海马神经元中,bax阳性细胞表达有限,组内比较差异无统计学意义(P>0.05);手术组B、C、D组bax在24 h时海马CA1区的表达即很明显,72 h最高,明显高于对照组假手术A组,A组与B、C、D组比较,差异有统计学意义(P<0.05);B组同C、D组相比较,差异有统计学意义(P<0.05),说明C、D组各时间点海马bax阳性细胞数与B组有差别,见图5、表5。
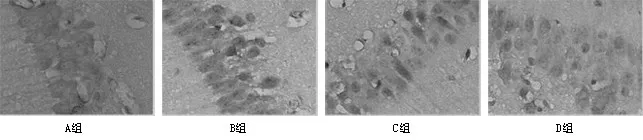
图5 兔海马CA1区Bax免疫组化(DAB显色×400):
表5 家兔海马CA1区bax阳性细胞表达强度均值()
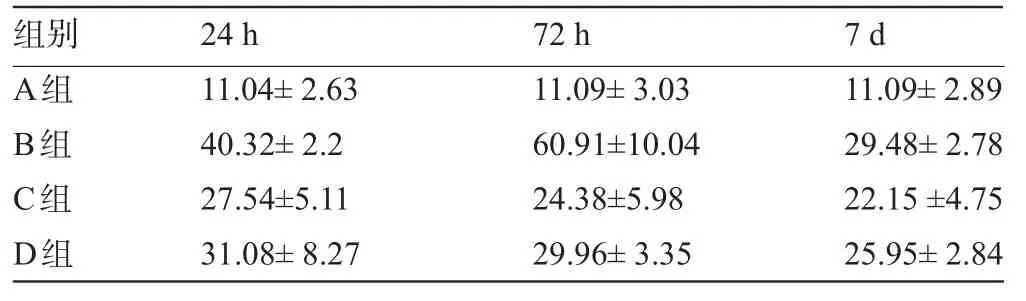
表5 家兔海马CA1区bax阳性细胞表达强度均值()
A组B组C组D组11.04±2.63 40.32±2.2 27.54±5.11 31.08±8.27 11.09±3.03 60.91±10.04 24.38±5.98 29.96±3.35 11.09±2.89 29.48±2.78 22.15±4.75 25.95±2.84
以上结果表明:(1)单纯的脑外切口损伤对脑神经细胞中的Bax的表达影响不大;(2)脑组织中Bax可在SAH后表达增加;(3)Fen干预可使SAH后神经细胞中Bax的表达下降。
3 讨论
蛛网膜下腔出血后的CVS是多种因素作用的结果,目前具体的机制尚不完全明确。最初人们认为芬太尼只有镇痛作用,后来研究表明,芬太尼能够在组织的缺血再灌注损伤中抑制细胞的凋亡反应,机制可能如下:(1)通过激动阿片受体。Zhang等[4]在心肌缺血再灌注损伤实验中,通过给大鼠输注芬太尼类似物雷米芬太尼作为预处理,减轻了心肌缺血再灌注损伤,他们认为其是通过共同的信号传导通路,来抑制Ca2+通道的开放,减轻细胞内钙离子超载,从而使μ、δ、κ 3种阿片受体来实现细胞保护作用。Yamanouchi等[5]研究认为,在δ受体被激动后,可以减少枯否细胞释放活性氧或者使细胞对活性氧产生耐受,从而使细胞获得膜稳定能力,减轻损伤。Zhang等[6]在心肌实验中证明,雷米芬太尼能够激活PKC(蛋白激酶)和mitoKATP通道,从而保护心肌;在缺血再灌注损伤中,mitoKATP通道的开放能够降低细胞凋亡。(2)通过非阿片受体依赖性途径:芬太尼能够抑制电压敏感性钙离子通道,从而产生非内皮细胞依赖性血管舒张作用;又可通过刺激血管内皮细胞,引起一氧化氮和前列环素释放从而舒张血管。而且这些作用均与阿片受体无关[7]。(3)芬太尼能够抑制脂多糖诱导的人外周血TNF-α的表达,作用机制可能为吗啡和芬太尼抑制了核转录因子NF-κB所致[7]。本实验通过检测脑组织神经元密度,发现芬太尼干预组的神经元存活数要明显高于SAH组,说明芬太尼在蛛网膜下腔出血时可以减轻神经细胞的死亡,通过观察基底动脉管壁的变化可以发现芬太尼干预组较SAH组有所改善,说明芬太尼对缓解SAH后出现的CVS有一定的作用。
细胞凋亡是指生物体内细胞在特定的内源或外源信号诱导下,其死亡途径被激活,并在有关基因的调控下发生的程序性死亡过程。凋亡的发生发展过程由多种调节基因参与完成,这些基因的相互作用决定着细胞凋亡的进程。其中尤以一些肿瘤前体基因和原癌基因表现显著,如p53、Myc、Bcl-2家族中Bcl-2和Bax等。在这个进程当中,作为凋亡细胞内在的并且是重要的一个始动因素为半胱氨酸蛋白酶类Caspases[8],而且Bcl-2以及Bax等多个基因可以通过参与到此Caspases途径,起到间接地影响疾患发生时细胞出现的凋亡[9]。在进行Bcl-2克隆时,逐渐发现了Bcl-2家族的其他成员。根据其作用的不同,Bcl-2家族被分类为促生存家族(Pro-survial family)与促凋亡家族(Pro-apoptotic family)。除Bcl-2外,促生存的成员尚包括Bcl-xL、Bcl-w等,而Bax和Bak则是促凋亡的成员。研究发现,当脑组织受损时,Bcl-2可抑制神经细胞凋亡。其表达的增加,使即使在外界因素刺激后,细胞亦不启动凋亡程序,但对非凋亡性死亡无保护作用[10]。而当Bax缺乏时,海马区受损的细胞少[10],Bax的高表达导致线粒体内的细胞色素C大量释放,从而激活Caspases-3和Caspases-9,进而诱导出现凋亡[10];Bcl-2可与Bax结合产生二聚体,从而使Bax失去活性,形成保护,Bax与Bcl-2呈对抗关系。所以凋亡的出现不但由凋亡抑制基因的表达程度决定,而且也因为促凋亡成员的表达程度而受到影响,最后取决于它们的相对数量,也就是相对比值(BCL-2/Bax)可能是决定细胞生死的关键。本实验表明,Fen促进了家兔SAH后CVS时Bcl-2蛋白的表达,抑制了Bax的表达,从而使Bcl-2/Bax比率升高,细胞凋亡受到抑制从而产生脑保护作用。
因此,Fen其抗凋亡作用的部分机制可能是通过影响Bcl-2、Bax蛋白表达,从而产生脑保护作用。另外可能还有其他途径,尚需进一步研究。
[1]薛慎伍.老年性脑血管病治疗与预防[M].北京:人民军医出版社, 2003,6:199.
[2]Matz PG,Fujimura M,Lewen A,et al.Increased cytochrome c-mediated DNA fragmentation and cell death in manganese-superoxide dismutase-deficient mice after exposure to subarachnoid hemolysate [J].Stroke,2001,32(2):506-515.
[3]Choi BJ,Whang KT.Change of hyperexcitability of hippocampus by cyelosporin A and its modulatory action by fentanyl[J].J Korean Med Sci,2002,17(1):96-l02.
[4]Zhang Y,Irwin MG,Wong TM.Remifentanil preconditioning protects against ischemic injury in the intact rat heart[J].Anesthesiology,2004,101(4):918-923.
[5]Yamanouchi K,Yanaga K,Okudaira S,et al.[D-Ala2,D-Leu5]enkephalin(DADLE)protects liver against ischemia-reperfusion injury in the rat[J].J Surg Res,2003,114(1):72-77.
[6]Zhang Y,Chen ZW,Girwin M,et al.Remifentanil mimics cardioprotective effect of ischemic preconditioning via protein kinase C activation in open chest of rats[J].Acta Pharmacologica Sinica, 2005,26(5):546-550.
[7]Rao Y,Wang YL,Li JG,et al.Effects of morphine and fentanyl on tumor necrosis factor-alpha and interleukin-6 concentrations in human whole blood in vitro[J].Chin Med J(Engl),2004,117(2):303-304.
[8]Zhang H,Li Q,Li Z,et al.The protection of Bcl-2 overexpression on rat cortica neuronal injury caused by analogous ischemia/reperfusion in vitro[J].Neurosci Res,2008,6(2):140-146.
[9]Zhang R,Xue YY,Lu SD,et al.Bcl-2 enhances neurogenesis and inhibits apoptosis of newborn neurons in adult rat brain following a transient middle cerebral artery occlusion[J].Neurobio Dis,2006, 24(2):345-356.
[10]Wei MC,Zong WX,Cheng EH,et a1.Proapoptotic BAX and BAK;a requisite gateway to mitochondrial dysfunction and death[J].Science,2001,292(5517):727-730.
Effect of Fentanyl on cerebral vasospasm after subarachnoid hemorrhage.
LIU Yu-ming,MA Jian-rong. Department of Neurosurgery,Xiangya Hospital of Central South University,Changsha 410007,Hunan,CHINA
ObjectiveTo study the effect of Fentanyl on cerebral vasospasm after subarachnoid hemorrhage and its mechanism.MethodsSeventy-two healthy adult rabbits were randomly divided into four groups:the control group(group A),SAH group(group B),SAH with fentanyl intravenous(group C)and SAH with fentanyl intramuscular(group D).The rabbits underwent neurobiology score every day.The basar artery was stained by HE,and hippocampus undrewent HE staining and Bcl-2Bax immunohistochemical staining,then the neuron density as well as the expression of Bax and Bcl-2 were detected.ResultsAfter SAH,the expression of Bcl-2 and Bax increased.After intervention with fentanyl,the expression Bcl-2 was increased,while the expression of Bax decreased.,The neurological function score,neuron density and Bax and Bcl-2 expression in group B showed statistically significant differences with those in group C and group D(P<0.05).ConclusionFentanyl can inhibit neuron apoptosis possibly through enhancing Bcl-2 expression and inhibiting Bax expression.
Cerebral vasospasm;Fentanyl;Rabbit;Brain protection;Bax;Bcl-2
R743
A
1003—6350(2012)09—027—05
10.3969/j.issn.1003-6350.2012.09.010
2012-01-05)
刘玉明(1977—),男,湖南省长沙市人,主治医师,在读研究生。
