长期胆汁反流对大鼠胃黏膜的影响
2012-09-01王学伟曹勤唐剑敏
王学伟 曹勤 唐剑敏
(上海中医药大学附属普陀医院消化内科,*病理科,上海 200062)
长期胆汁反流对胃和食管黏膜的影响尚不明确。研究[1]发现胆汁反流至胃,甚至食管,十分常见。Dixon等[2]通过病理研究发现,胆汁反流可能与胃窦黏膜肠化生有关。近年来研究[3]发现,胆汁反流不但与反流性食管炎有关,而且可能是Barrett食管的重要病因,还可能与食管腺癌的发生有关[4]。因此,明确长期胆汁反流对胃和食管黏膜的病理影响,具有重要的临床意义。本研究建立模拟人体生理性胆汁反流途径的大鼠模型,观察长期胆汁反流对大鼠胃黏膜的病理影响,通过免疫组化方法研究长期胆汁反流对胃泌素表达的影响,并探讨其在胆汁反流中的作用。
1 资料与方法
1.1 动物和抗体 Sprague-Dawley大鼠,清洁级,雄性,8周龄,体质量250~300 g,购自中国科学院上海实验动物中心。羊抗大鼠胃泌素多克隆IgG抗体购自美国Santa Cruz公司,兔抗羊IgG抗体购自北京中山公司。
1.2 动物模型 大鼠预适应1周,术前禁食24 h,只给予5%葡萄糖液,术前6 h禁葡萄糖液。麻醉采用10%水合氯醛0.3 mL/100 g腹腔注射。上腹正中切口4 cm,于十二指肠胆总管开口下0.5 cm处横断十二指肠、缝合断端,于前胃与腺胃交界2 mm处前胃大弯侧作1 cm切口,距Treitz韧带4 cm远侧空肠系膜对侧作1 cm切口,行胃-空肠吻口。术后24 h禁食,给予5%葡萄糖液,24 h后少量进食饲料,3 d后恢复正常饮食。
1.3 组织病理 模型建立1年后,13只大鼠经10%水合氯醛0.3 mL/100 g腹腔注射麻醉,断头法处死,大鼠胃经10%甲醛固定72 h,石蜡包埋,切片厚度4μm,HE染色。
1.4 免疫组化 切片65℃烘烤1 h,脱蜡、水化,自来水洗10 min,蒸馏水洗2次,蒸馏水浸泡5 min;再将切片放入3%H2O2,室温孵育10 min,以消除内源性过氧化物酶活性,自来水洗10 min,蒸馏水洗2次,蒸馏水浸泡5 min;于柠檬酸缓冲液中微波抗原修复15 min,磷酸缓冲液(PBS)洗,5 min×3次;将切片放入正常血清中,室温孵育30 min,以封闭内源性抗原结合位点;加入经PBS 1:100稀释的一抗,4℃孵育过夜;PBS洗,5 min×3次;加入二抗,室温孵育1 h,PBS洗5 min×3次;加入酶标物,室温孵育1 h,PBS洗5 min×3次;加入DAB显色液,显色6 s,自来水洗10 min,苏木素复染20 s,自来水洗5 min,盐酸浸泡1 s,自来水洗5 min,室温晾干,中性树胶封片。
2 结 果
2.1 组织病理 正常1年龄大鼠中,仅少数胃部有轻度慢性炎性反应。胆汁反流1年后,13只大鼠腺胃部腺体增生非常显著,大多数同时伴有腺体显著扩张;长期胆汁反流导致3只大鼠腺体发生异型增生,其中1只出现癌变;胆汁反流大鼠中糜烂和溃疡少见,仅见于3只和1只大鼠。与此类似,肠化生极少见,仅见于1只大鼠(图1)。胆汁反流1年后,13只大鼠前胃部鳞状上皮显著增生,并伴有明显角化,其中7只大鼠在黏膜下层形成巨大的角化珠,更有3只大鼠形成角化囊肿;与腺胃部类似,前胃部肠化生极少见,仅见于1只大鼠;所有胆汁反流大鼠前胃均未见到糜烂或溃疡(图2)。
2.2 免疫组化 正常大鼠胃泌素阳性染色细胞主要分布于腺胃胃窦部上皮内,并且数量较少。胆汁反流1年后,腺胃胃窦部上皮内胃泌素阳性染色细胞显著增生,呈聚集性存在,腺胃胃体部上皮内亦可见胃泌素阳性染色细胞增生(图3)。
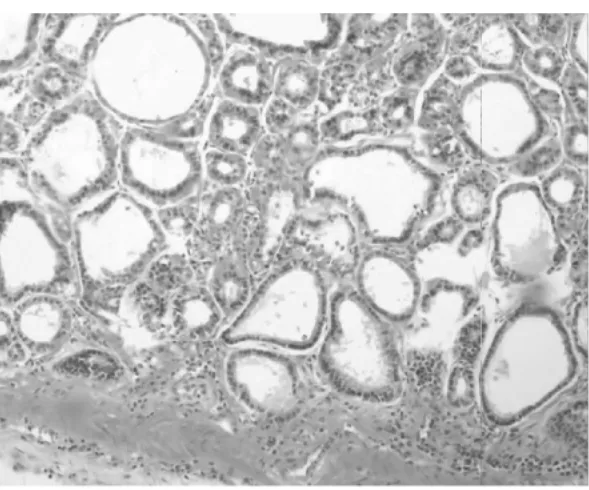
图1-1 腺胃腺体增生、扩张

图1-2 腺胃腺体异型增生
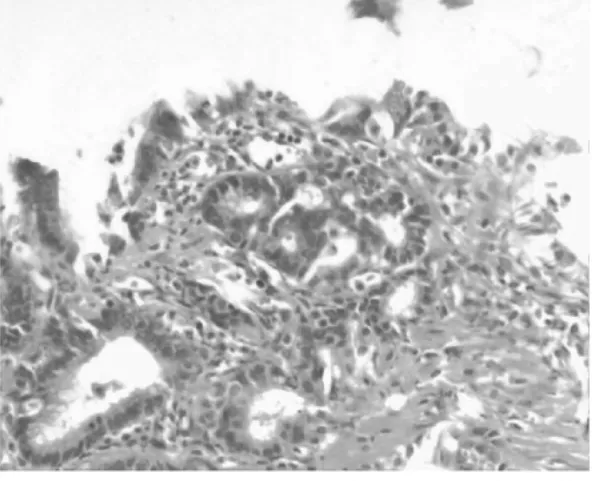
图1-3 腺胃腺体癌变
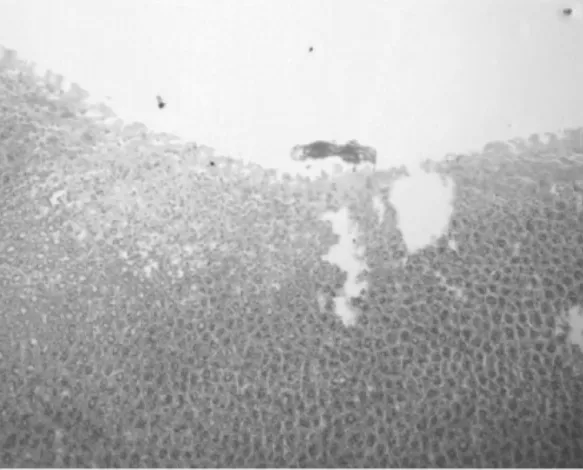
图1-4 腺胃黏膜糜烂

图1-5 腺胃溃疡
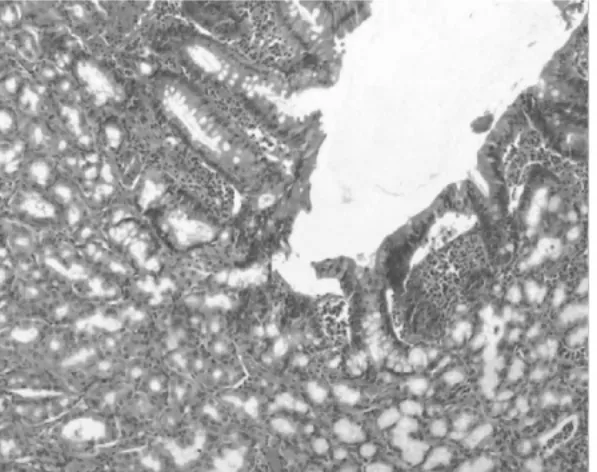
图1-6 腺胃腺体肠化生
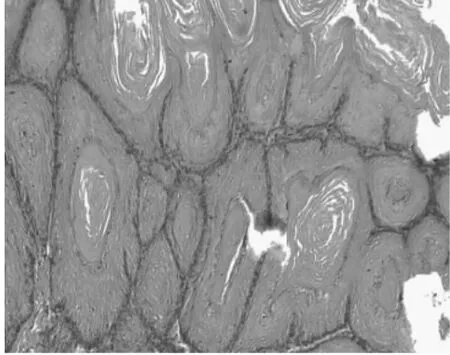
图2-1 前胃鳞状上皮
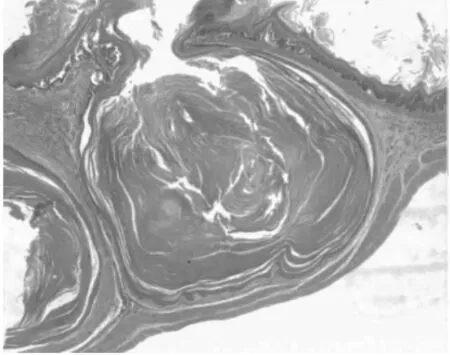
图2-2 前胃鳞状上皮角化珠
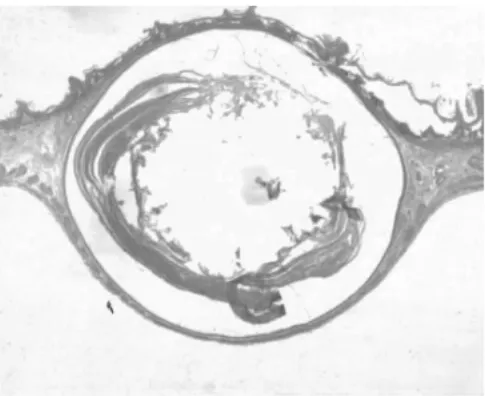
图2-3 前胃角化囊肿增生、角化

图2-4 前胃鳞状上皮肠化生

图3-1 正常大鼠胃窦胃泌素阳性染色细胞呈单个存在

图3-2 正常大鼠胃体亦有少量胃泌素阳性染色细胞

图3-3 长期胆汁反流大鼠胃窦胃泌素阳性染色细胞增生伴腺体增生
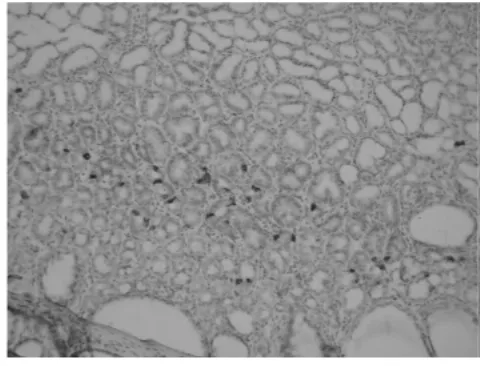
图3-4 胆汁反流大鼠胃体胃泌素阳性染色细胞增生伴腺体增生、扩张
3 讨 论
大鼠的胃由近端的前胃和远端的腺胃组成,前胃黏膜被覆鳞状上皮,与食管相似,腺胃类似于人胃,分为胃体和胃窦。本模型根据Kaminishi等[5]建立的模型而改进,使胆汁通过幽门反流入腺胃,经位于前胃的胃-空肠吻合口流入空肠,整个腺胃保持完整,故类似于人体生理性胆汁反流途径,不仅便于观察胆汁反流对腺胃黏膜的影响,还可观察其对前胃鳞状上皮的影响。
本研究发现,长期胆汁反流导致大鼠腺胃胃体和胃窦小凹上皮增生,与1994年休斯顿会议对反应性胃炎(reactive gastritis,RG)的描述一致[6]。所有大鼠腺胃腺体增生,并呈囊状扩张,与Taylor等[7]和 Mukaisho等[8]的发现一致,提示胃腺体增生、扩张是胆汁反流性胃炎的特征。本模型仅发现1例腺胃癌变,这可能是由于本模型中腺胃是完整的,类似于生理性胆汁反流;而其他模型均将腺胃与空肠吻合,类似于Billroth II手术,胆汁反流强度可能高于生理性反流,因此胃癌发生率高。临床中发现,两种不同类型上皮的交界处易发生肿瘤。在其他模型中,胃癌多发生于腺胃-空肠吻合口周围。有研究者认为,肠化生是胃黏膜的一种适应性改变,当胃黏膜的局部微环境变为类似于肠内环境时,胃黏膜便出现肠化生,以此来减碱性肠液对黏膜的损伤。将带血管蒂的大鼠胃壁瓣分别移植到肠壁上,移植黏膜发生典型的肠化生,pH测定发现移植黏膜的pH>6,显著高于胃内(一般pH<4.5)。在腺胃-空肠吻合口周围,胆汁反流强度可能要高于本模型,造成局部黏膜微环境的pH显著升高,因此肠化生发生率较高。本模型中鳞状上皮显著增生,呈乳头状凸起,上皮增生形成角化珠和角化囊肿。本模型尽管胆汁反流长达1年,却仅有1例肠化生,更无腺癌发生。此差异可能与手术方式不同有关。
胆汁反流可导致高胃泌素血症,并通过抑制生长抑素的释放、降低血清生长抑素的水平进一步加重高胃泌素血症;高胃泌素血症又会加重胆汁反流。患者行胆囊切除后6个月,其胃窦黏膜G细胞的数量即有增加,并存在显著的胆汁反流性胃炎和小凹上皮增生,这提示胆汁反流可导致G细胞增生,并引起高胃泌素血症。通过免疫组化方法,我们发现本模型中腺胃胃窦和胃体G细胞显著增生。胆囊收缩素-2(cholecystokinin,CCK-2)受体是胃泌素的特异性受体,主要表达于壁细胞和ECL细胞。我们推测胆汁反流导致G细胞增生,引起高胃泌素血症,在循环胃泌素的作用下,壁细胞上的CCK-2受体被激活并分泌HB-EGF和双调蛋白等生长因子,促进胃上皮增殖,进一步导致异型增生和癌变。
综上所述,我们通过建立模拟人体生理性胆汁反流的大鼠模型发现,长期胆汁反流能导致腺胃腺体增生并发生异型增生和癌变,前胃鳞状上皮亦显著增生,这可能与长期胆汁反流所致的腺胃G细胞增生和高胃泌素血症有关。
[1] Fein M,Freys SM,Sailer M,et al.Gastric bilirubin monitoring to assess duodenogastric reflux[J].Dig Dis Sci,2002,47(12):2769-2774.
[2] Dixon MF,Mapstone NP,Neville PM,et al.Bile reflux gastritis and intestinal metaplasia at the cardia[J].Gut,2002,51(3):351-355.
[3] Oberg S,Peters JH,DeMeester TR,et al.Determinants of intestinal metaplasia within the columnar-lined esophagus[J].Arch Surg,2000,135(6):651-655.
[4] O′riordan JM,Tucker ON,Byrne PJ,et al.Factors influencing the development of Barrett's epithelium in the esophageal remnant postesophagectomy[J].Am J Gastroenterol,2004,99(2):205-211.
[5] Kaminishi M,Sadatsuki H,Johjima Y,et al.A new model for production of chronic gastric ulcer by duodenogastric reflux in rats[J].Gastroenterology,1987,92(6):1913-1918.
[6] Dixon MF,Genta RM,Yardley JH,et al.Classification and grading of gastritis.The updated Sydney system[J].The A-merican Journal of Surgical Pathology,1996,20(10):1161-1181.
[7] Taylor PR,Mason RC,Filipe MI,et al.Gastric carcinogenesis in the rat induced by duodenogastric reflux without carcinogens:morphology,mucin histochemistry,polyamine metabolism,and labelling index[J].Gut,1991,32(12):1447-1454.
[8] Mukaisho K,Miwa K,Kumagai H,et al.Gastric carcinogenesis by duodenal reflux through gut regenerative cell lineage[J].Dig Dis Sci,2003,48(11):2153-2158.
