IFN-γ诱导胰腺癌细胞IDO表达及活性的变化
2012-07-21龚勇
龚 勇
(长治市卫生学校,山西 长治 046000)
在机体免疫系统与肿瘤细胞相互对抗的过程中,被激活的T细胞与NK细胞分泌的IFN-γ具有直接抑制肿瘤细胞增殖、抑制肿瘤血管生成、调控表面肿瘤细胞的Fas/FasL表达等多种抗肿瘤作用。作为一种重要的双向免疫调节因子,IFN-γ与免疫的激活和抑制都着密切的联系。IFN-γ不仅能上调机体内树突状细胞的吲哚胺2,3-双加氧酶(IDO)表达[1],而且能够诱导许多肿瘤细胞的IDO表达,如骨肉瘤、上皮恶性肿瘤细胞和肺纤维细胞等[2]。而IDO在肿瘤免疫逃逸中起着极其重要的作用[3]。本研究旨在观察IFN-γ对胰腺癌细胞株Panc02中IDO表达及活性的影响,为深入了解胰腺癌免疫逃逸机制提供实验基础。
1 材料与方法
1.1 材料
RPMll640培养基、胎牛血清购自美国Hyclone公司,重组鼠γ干扰素(IFN-γ)购自美国Pepro Tech公司,BCA试剂盒、PVDF Transfer Membranes购自美国Pierce公司,Bradford蛋白定量试剂盒购自南京建成生物工程研究所,辣根酶标记山羊抗兔IgG购自北京中杉金桥公司,Super ECL Plus超敏发光液购自普利莱基因技术有限公司,预染低分子量蛋白质Marker购自Solarbio公司,Actin(1-19)购自 SANTA CRUE,氨基酸色柱购自天津四友公司,犬尿氨酸标准品、内标3-硝基酪氨酸标准品购自中国药品生物制品检定所,胰腺癌细胞株Panc02购自美国ATCC公司。
1.2 实验分组及方法
按每个培养瓶为一个处理对象,随机分为4个处理组:空白对照组(IFN-γ 0U/mL)和 IFN-γ 10 U/mL、20 U/mL、50 U/mL组。待细胞生长至60%汇合时,IFN-γ处理组分别加入终浓度为10 U/mL、20 U/mL、50 U/mL的IFN-γ,空白对照组加入等量PBS,继续培养18 h,收集半贴壁细胞,并抽提细胞胞浆蛋白进行Western Blot分析以观察各组IDO的蛋白表达。每组样本例数均为6例。
1.3 Western blot检测 IFN-γ作用胰腺癌细胞株Panc02后IDO蛋白的表达
采用胞质胞核蛋白抽提试剂盒,操作步骤严格按照试剂盒说明书进行。提取的蛋白样品经变性、电泳、转膜及封闭后,分别与小鼠抗大鼠单克隆抗体和辣根过氧化物酶标记的二抗孵育。暗室中采用ECL方法对反应产物进行检测,当条带达所需亮度时立即显影定影。采用Quantity one图像分析系统进行各条带平均灰度值(A)分析,以目的条带的A值与内参照β-actin A值的比值表示IDO的相对表达量。
1.4 高压液相测定培养液上清中犬尿氨酸(Kyn)的浓度以评价IDO的分子活性
取4个处理组的培养液上清,利用高压液相测定其中Kyn的浓度来评价IDO的分子活性。色谱条件:色谱柱为waters RP-C18柱,流动相为15 mmol/L乙酸-乙 酸 钠 溶 液 (0.2 mmol/L, pH3.6),流 速 为1.0 mL/min,紫外检测波长为225 nm,内标为 3-硝基酪氨酸(3-n)。
1.5 统计学方法
数据均以均数±标准差表示,应用SPSS11.5统计软件进行单因素方差分析,组间差异用SNK-q检验,两两比较采用LSD的方法,以P<0.05具有统计学意义。
2 结果
2.1 IFN-γ诱导胰腺癌细胞株Panc02中IDO的表达增强
IDO、β-actin特异性免疫印迹条带的相对分子质量分别为42 KD和43 KD。不同浓度IFN-γ诱导Panc02的IDO蛋白表达量见表1及图1。经过分析可知,4组的IDO/β-actin值之间差异具有统计学意义(F=21.416,P <0.05),可以认为 4 组 IDO 蛋白的表达量存在差别,进一步采用LSD的方法进行两两比较,比较结果显示,除10 U/mL组与20 U/mL组差别无统计学意义(P=0.238)之外,其余各组间均存在差异(P均小于0.05)。与空白对照组比较,IFN-γ作用后胰腺癌细胞株Panc02的IDO蛋白表达量明显增加,且随着IFN-γ作用浓度的增大其IDO的表达量逐渐增加,以50 U/mL组为著。
表1 4 组 IDO/β-actin 值比较(±s)Table 1 Comparison of IDO/β-actin Value in Four Groups(¯x ± s)
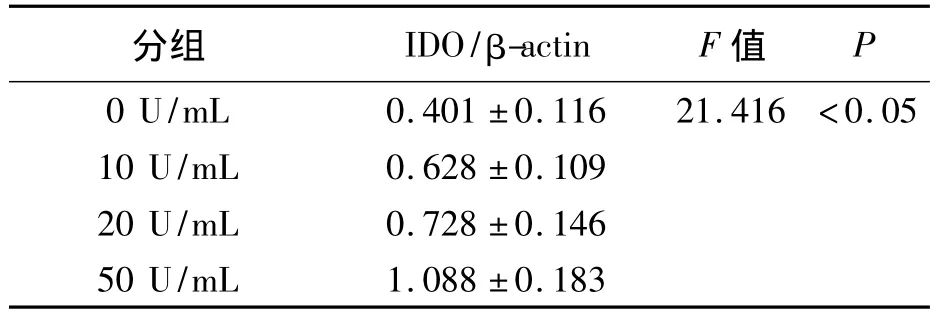
表1 4 组 IDO/β-actin 值比较(±s)Table 1 Comparison of IDO/β-actin Value in Four Groups(¯x ± s)
分组 IDO/β-actin F 值P 0 U/mL 0.401 ±0.116 21.416 <0.05 10 U/mL 0.628 ±0.109 20 U/mL 0.728 ±0.146 50 U/mL 1.088 ±0.183
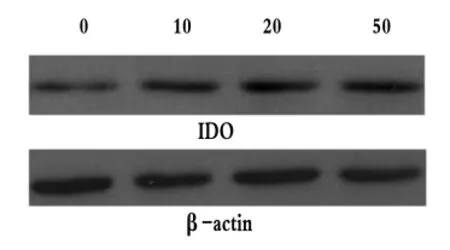
图1 不同浓度IFN-γ(U/mL)诱导β-actin和IDO蛋白表达量Fig 1 IDO Protein Expression Levels of β-actin Induced by Different Concentrations of IFN-γ(U/mL)
2.2 IFN-γ诱导胰腺癌细胞株Panc02中IDO的活性增强
不同浓度IFN-γ刺激Panc02后细胞培养液上清中Kyn的浓度见表2所示。经过分析可知,4组之间差别具有统计学意义(F=15.404,P <0.05),可以认为4组Kyn浓度存在差别,进一步采用LSD的方法进行两两比较,比较结果显示,除0 U/mL组与10 U/mL组差别无统计学意义(P=0.525)之外,其余各组间都存在差别(均P<0.05)。结果显示:与空白对照组比较,IFN-γ作用后胰腺癌细胞株Panc02的细胞培养液上清中Kyn的浓度明显增加,且随着IFN-γ作用浓度的增大其Kyn的浓度逐渐增加,以50 U/mL组为著。

表2 不同浓度IFN-γ刺激Panc02后细胞培养液上清中Kyn的浓度Table 1 Kyn Concentrations in the Supernatant of Panc02 Cell Culture Media with Different IFN-γ Concentrations
3 讨论
IDO是细胞内含亚铁血红素的酶,是肝脏外唯一可以沿犬尿酸途径催化色氨酸分子中吲哚环氧化裂解并进行分解代谢的第一限速酶。作为一种免疫调节酶,IDO有可能为对母婴耐受的理解、自身免疫疾病的调控以及器官移植排斥反应的抑制等多个领域起重要作用。
近年来大量文献报道表明,IDO在肿瘤发生发展过程中以及肿瘤免疫逃逸中起着重要作用[4]。研究结果显示,人类多种肿瘤细胞均高表达IDO[4]。在动物模型中,转染IDO的肿瘤细胞株可以有效地对抗机体T细胞的保护,在宿主内浸润性生长[3]。临床资料也显示,在卵巢癌和结肠癌的患者中,IDO的表达可以作为一个不良预后的显著标志[4]。
“色氨酸饥饿”、“代谢产物的毒性作用”以及两者之间的联合作用作为解释IDO在肿瘤免疫逃逸中的作用机制已经被人们广泛接受。
有研究结果表明,由于对“色氨酸饥饿”的敏感性,处于G1期中期的T细胞缺乏色氨酸的培养环境中,增殖被抑制。而且,这种被抑制的T细胞被再次激活是非常困难的[5]。同时有类似报道,如果培养条件缺乏色氨酸下,小鼠初始 T细胞活化后可以表达CD69和CD25,能够经历细胞周期 G0/G1期的前12 h,但不表达细胞周期素依赖性蛋白激酶4、周期素D3以及CD71,而且无cDNA合成,因此不能成功分化为效应T细胞。IDO有可能通过色氨酸饥饿诱导抗原特异性的T细胞耐受,其作用机制与细胞周期被阻断以诱导T细胞凋亡有关[6]。
有研究结果提示,犬尿氨酸在抗原特异性CD4+T细胞分化中有着重要作用,而哇琳酸、吡啶羟酸、L-犬尿氨酸等也可抑制NK细胞的增殖[7]。色氨酸饥饿和代谢产物毒性作用的联合作用可以在T细胞水平上下调CD8细胞的TCRζ-链并诱导调节性CD4细胞的产生[8,9]。IDO基因的转录起始位点的上游包含许多调控元件。其启动子长1245 bp,含有3个IFN-γ激活序列以及2个干扰素调节因子。它们是IFN-γ诱导IDO表达信号通路中必需的环节。IFN等细胞因子可以通过5'端的调节区域对IDO基因表达进行调控。其中IFN-γ的刺激潜能最强,体外研究表明其激活潜能具有时间、剂量依赖性和种属特异性。IFN-γ不仅能上调机体内树突状细胞的IDO表达,而且能够诱导许多肿瘤细胞的IDO表达,如骨肉瘤、上皮恶性肿瘤细胞和肺纤维细胞细胞等。IFN-γ可诱导鼻咽癌细胞株中IDO的表达,并抑制患者细胞免疫反应[10]。
本研究结果表明,IFN-γ作用后胰腺癌细胞株Panc02的IDO蛋白表达量明显增加,且随着IFN-γ作用浓度的增大其IDO的表达量逐渐增加,以50 U/mL组为著。并且Panc02细胞株中IDO的活性在IFN-γ的刺激下显著增强。因此以下假设是合理的:胰腺癌细胞表达的IDO可以通过色氨酸饥饿及代谢产物的毒性作用等途径,改变肿瘤局部微环境,使T细胞分化或/和转化具有抑制表型的Treg。这些细胞分泌诸如:TGF-β,Ⅰ、Ⅱ型干扰素等可溶性细胞因子,募集更多具有抑制或者调节表型的细胞,同时通过反向信号转导通路刺激IDO表达进一步提高,并诱导CD+8DC向免疫耐受型转化,提高IDO+DC的数量,从而形成TGF-β-IDO-Treg正反馈环,使得免疫抑制从肿瘤周围播散开来。因此认为,IFN-γ诱导胰腺癌细胞IDO表达上调且活性增强,这可能是引起胰腺癌免疫逃逸的重要机制之一。
[1]徐 钧,孔祥顺,李元栋.不同浓度γ干扰素诱导大鼠脾脏来源树突状细胞表达吲哚胺2,3-双加氧酶的变化及对T淋巴细胞增殖的影响[J].中华实验外科杂志,2011,28(10):1686-1689.
[2]Munn,D.H,A.L.Mellor.Indoleamine 2,3-dioxygenase and Tumorinduced Tolerance[J].J Clin Invest,2007,117(5):1147-1154.
[3]Uyttenhove,C,Pilott L,Theate I,et al.Evidence for a Tumoral Immune Resistance Mechanism Based on Typtophan Dgradation by Idoleamine 2,3-dioxygenase[J].Nat Med,2003,9(10):1269-1274.
[4]Brandacher G,Perathoner A,Ladurner R,et al.Prognostic Value of Indoleamine 2,3-dioxygenase Expression in Clorectal Cancer:Effect on Tumor-infiltrating T Cells[J].Clin Cancer Res,2006,12(4):1144-1151.
[5]Bauer T.M,Jiga LP,Chuang JJ,et al.Studying the Immunosuppressive Role of Indoleamine 2,3-dioxygenase:Tryptophan Metabolites Suppress Rat Allogeneic T-cell Responses in Vitro and in Vivo[J].Transpl Int,2005,18(1):95-100.
[6]Lee G.K,Park HJ,Macleod M,et al.Tryptophan Deprivation Sensi-tizes Activated T Cells to Apoptosis Prior to Cell Division[J].Immunology,2002,107(4):452-460.
[7]Frumento G,Rotondo R,Tonetti M,et al.Tryptophan-derived Catabolites are Responsible for Inhibition of T and Natural Killer Cell Proliferation Induced by Indoleamine 2,3-Dioxygenase[J].J Exp Med,2002,196(4):459-468.
[8]Fallarino F,Grohmann U,Vacca C,et al.T cell Apoptosis by Tryptophan Catabolism[J].Cell Death & Differ,2002,9(10):1069-1077.
[9]Fallarino F.The Combined Effects of Tryptophan Starvation and Tryptophan Catabolites Down-regulate T Cell Receptor Zeta-chain and Induce a Regulatory Phenotype in Naive T Cells[J].J Immunol,2006,176(11):6752-6761.
[10]Liu P,Xie Bailu,Cai Shaohui,et al.Expression of Indoleamine 2,3-dioxygenase in Nasopharyngeal Carcinoma Impairs the Cytolytic Function of Peripheral Blood Lymphocytes[J].BMC Cancer,2009,9:416.
