北方三省(区)牛副流感病毒3型的血清学调查
2012-06-29霍志云胡嘉欣
霍志云,童 钦,胡嘉欣,王 炜*
(1.华威特(北京)生物科技有限公司,北京 100085;2.中国农业科学院特产研究所,吉林 长春 130122)
牛副流感病毒3型(Bovine parainfluenza virus type 3,BPIV3)属于单分子负链 RNA 病毒目(Mononegavirles)副黏病毒科(Paramyxoviridae)副黏病毒亚科(Paramyxovirinae)呼吸道病毒属(Respirovirus)的成员[1],又称为运输热病毒,是引起牛羊呼吸系统疾病的病毒之一[2]。牛副流感病毒在世界各国普遍存在,呈现不同的流行程度,人及其他动物体内均发现BPIV3的抗体。检测方法主要有病毒中和试验、酶联免疫吸附试验、间接免疫荧光及血凝抑制试验等,其中病毒中和试验是经典的鉴定BPIV3的血清学检测方法,该方法敏感性强、特异性高,具有很高的应用价值,许多新建立的方法必需以该方法作为标准进行比较。鉴于3型牛副流感给肉牛和奶牛产业造成的巨大经济损失,因此对该病应引起足够重视。本试验采用病毒中和试验方法对中国北方部分地区牛场的血清样品进行BPIV3的血清学调查,以掌握牛群中的BPIV3的分布情况,为其防治和净化提供一定的科学依据。
1 材料与方法
1.1 材料
1.1.1 血液样本的采集 自内蒙古、吉林、山西采集血液样本482份,均未免疫接种BPIV3疫苗。
1.1.2 试剂和器材 BPIV3标准株,阴性血清,阳性血清,MDBK细胞,由中国农业科学院特产研究所人兽共患病实验室保存;聚苯乙烯管,单道自动移液器,漩涡振荡器,CO2培养箱,生物安全柜,离心机,水浴锅,灭菌枪头。
1.2 方法
1.2.1 血清收集 采集10mL血液样本离心(1500r/min,15min),收集血清,于-20℃保存。
1.2.2 血清灭活 试验时,将血清至于水浴锅中,56℃灭活30min。
1.2.3 血清稀释 用PBS将血清两倍倍比稀释,从1∶2稀释至1∶4096,每份血清样品做一个重复。
1.2.4 中和用病毒的稀释 用DMEM将已知毒价的PI3标准毒进行稀释,稀释完成后取100μL加到稀释好的100μL的血清中,此时标准毒的终浓度应为50TCID50/100μL~300TCID50/100μL。在37℃、体积分数为5%CO2培养箱中孵育1h。
1.2.5 细胞接种 将96孔细胞培养板培养24h的细胞,弃去生长培养基,每孔加100μL培养基洗板。从培养箱中取出中和1h的培养板,用12道移液器吸取100μL病毒血清中和混合物每列对应加到细胞培养板中。
1.2.6 回滴 利用最终确定的中和用病毒进行回滴试验,取一新的细胞培养板用稀释液将中和用病毒1∶1稀释,与血清病毒中和板一同置于37℃、体积分数为5%CO2培养箱中孵育,1h后将上述稀释好的病毒做10倍倍比稀释,从10-1稀释到10-3,将长满单层的细胞培养板弃去培养基,每孔加100μL DMEM洗板,将待回滴的病毒悬液100μL/孔加到细胞培养板,每个稀释度8孔。从较低浓度到较高浓度添加,并做好空白对照,回归滴度在同一板在上作1个重复。3d~5d后观察结果。
1.2.7 记录与计算 记录试验结果,通过Spearman-Karber方法计算血清效价和回归滴度。
1.2.8 数据的统计学分析 所得数据用SAS进行分析。
2 结果
2.1 结果判定条件
阴性细胞对照无CPE;阳性对照血清效价在2倍于其确定的平均值之内;阴性血清对照效价<2,被检血清效价≥2判定为阳性。
2.2 BPIV3的血清学调查结果
采用病毒中和试验的方法对采自吉林、内蒙、山西的482份血清,进行BPIV3抗体检测,检出阳性血清439份,阳性率为91.08%,不同地区BPIV3清学调查结果见表1。

表1 北方三省(区)部分地区牛血清BPIV3抗体检测结果Table1 A serological survey of antibodies against bovine parainfluenza virus type 3in three regions of north China
吉林、内蒙、山西BPIV3流行率、标准误及95%的可信区间分别为97.35%、2.25、79.31% ~89.31%,84.31%、1.67、91.88% ~98.42% 及95.15%、1.51、94.40%~100%(表2)。
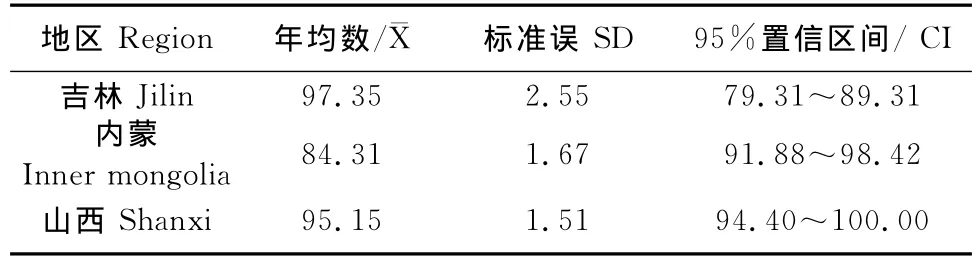
表2 BPIV3血清阳性率的标准误和95%置信区间Table2 Standard error and 95%confidence interval for BPIV3seropositive rate
3 讨论
牛呼吸系统疾病使肉牛业和奶牛业蒙受巨大经济损失[3]。病毒感染是引起疾病的主要因素,而BPIV3是引起牛呼吸系统疾病最重要的病毒之一。本病很少引起动物的死亡,细菌激发感染后,引起伴随肺炎的二重感染。副黏病毒具有潜在的种间传播的能力。尽管BPIV3有感染人的潜能,但通常认为BPIV3并不是严重的人畜共患病[4]。
欧美国家对BPIV3进行了大量的流行病学调查,Intisar K S等[5]采用 BPIV3ELISA 试剂盒,对采自不丹各地的495份骆驼的血清进行抗体检测,结果发现血清阳性率平均值为82.2%,血清阳性率最高可达92.6%。Hägglund S等[6]对病毒引起的呼吸道系统疾病进行了6年的研究发现,BPIV3在牛群中每年都会造成感染,并且具有很高的感染水平,Solís-Calderón JJ等[7]调查发现墨西哥肉牛BPIV3血清阳性率为85.6%。芬兰进行的牛血清学调查发现80%的血清样本呈BPIV3阳性[8]。采用间接ELISA试剂盒对伊朗的马什哈德地区奶牛进行BPIV3的血清阳性进行调查,结果90%的血清呈阳性[9]。但我国尚未对BPIV3流行病学进行大量的调查,因此,对BPIV3流行情况了解甚微。
本研究采用病毒中和的试验方法,对我国吉林、内蒙和山西的部分牛群进行了BPIV3抗体检测,血清阳性率分别为97.35%、84.31%、95.15%;与国外近几年进行的BPIV3血清学调查结果相符和,试验结果进一步证实BPIV3在牛群中广泛存在。造成BPIV3血清阳性率高的原因可能有以下几个方面,首先本病毒是一种高度接触性传染病,可以通过呼吸道传播;其次,动物饲养密度大,一旦引进一头患病动物,病毒将会在畜群中快速传播。最后,本病通常引起轻微的临床症状,易被忽视,因此没有及时采取防控措施,使疾病得有效的控制。
本研究对北方三省(区)的牛群进行抽样调查,计算各地流行率的平均值、率的标准误及可信区间,率的标准误小,说明抽样误差小,表示样本率对总体率的代表性好,反之,率的标准误大,样本对总体率的代表性差。
另外,从BPIV3阳性血清中随机抽取169份,进行了抗体滴度的测定,山西的BPIV3阳性血清的抗体滴度主要分布在1∶32~1∶64之间,占山西阳性血清样品数的91.3%;吉林阳性血清抗体滴度主要集中于1∶16~1∶32,占吉林阳性血清样品数的70.1%;内蒙阳性血清抗体滴度主要集中于1∶128,占内蒙阳性血清样品数的67.9%(数据未显示),抗体的存在表明牛群目前或近期接触过病毒,但并不能代表其具有了抵抗力。从北方三省(区)调查数据可见,BPIV3在我国吉林、内蒙、山西牛群中普遍存在,为更详细的了解本病在我国的流行情况,在全国范围内进行全面的BPIV3流行病学调查是十分必要的。另外,应增加对本病的关注,采取有效的防控措施,降低病毒在牛群中的传播水平,保护畜群健康安全。
[1]Karron R A,Collins P L.Parainfluenza viruses[J].J Fields Virology,2007,1497-526.
[2]Svensson C,Liberg P.The effete of group size on health and growth rate of Swedish dairy calves housed in pens with automatie milk feeders[J].J Prev Vet Med,2006,73(1):43-53.
[3]Lekeaux P.Bovine respiratory disease complex:A European perspective[J].J Bov Pract,1995,29:71-75.
[4]Karron R A,Collins P L.Parainfluenza viruses[J].J Fields Virol,2007,1:1497-1526.
[5]Intisar K S,Ali Y H,Khalafalla A I,et al.Respiratory infection of camels associated with parainfluenza virus 3in Sudan[J].J Virol Meth,2010 ,163(1):82-86.
[6]Hägglund S,Hjort M,Graham D A,et al.Six-year study on respiratory viral infections in a bull testing facility[J].J Vet,2007,173(3):585-593.
[7]Solís-Calderón J J,Segura-Correa J C,Aguilar-Romero F,et al.Detection of antibodies and risk factors for infection with bovine respiratory syncytial virus and parainfluenza virus-3in beef cattle of Yucatan,Mexic[J].J Prev Vet Med,2007,82(1-2):102-110.
[8]Härtel H,Nikunen S,Neuvonen E,et al.Viral and bacterial pathogens in bovine respiratory disease in finland[J].J Acta Vet Scand,2004,45(4):193-200.
[9]Roshtkhari F,Mohammadi G,Mayameei A.Serological evaluation of relationship between viral pathogens(BHV-1,BVDV,BRSV,PI-3V,and Adeno3)and dairy calf pneumonia by indirect ELISA[J].J Trop Anim Health Prod,2011,25:191-199.
