猪与小鼠海马成体神经发生以及海马结构特征的对比分析
2012-06-29张学乾杨慈清陈树林赵慧英赵善廷
张学乾,杜 蕊,杨慈清,2,陈树林,赵慧英,赵善廷*
(1.西北农林科技大学动物医学院,陕西 杨凌 712100;2.新乡医学院生命科学技术系,河南 新乡 453003)
在哺乳类动物中,成体神经发生主要局限于海马结构中的齿状回和侧脑室壁的亚室带[1-3],其中海马作为脑中的一个重要结构,不仅在学习、记忆和认知等过程中发挥着重要作用,而且还控制着动物的食欲及觅食行为[4],海马损伤会导致一些神经系统疾病的发生。海马通过成体神经发生源源不断地产生新的神经元[5-6],这些新生神经元会融入到原有的神经网络中[7-8],参与这些功能的行使,因此海马功能的正常运转与成体神经发生密不可分[9-10]。猪作为一种重要的家畜,如果能够控制其食欲和饮食,可降低其饲养难度,而想要达到这一点,需要对猪的海马结构进行充分了解,而且对其功能行使的深入研究有助于一些神经系统疾病的防治。但到目前为止,成体神经发生的研究主要以小鼠、大鼠及鸟类为动物模型,而对大型家畜的研究却很少,猪的成体神经发生的研究尚未见报道。以前,对于成体神经发生的研究主要靠一些标记增殖细胞的技术来完成,其中以 BrdU(5-bromodeoxyuridine,5-溴脱氧尿嘧啶核苷)标记技术应用最为广泛[11-13]。近年来双皮质素(doublecortin,DCX)作为一种新的未成熟神经元的特异标记物被广泛应用于成体神经发生的研究,DCX是一种微管相关蛋白,与神经元的迁移密切相关[14-15],在成体神经发生期间,它随着神经母细胞的增殖开始表达,在第二周达到顶峰,并随着神经元的成熟逐渐消失[16]。大量研究证明DCX可以作为一种可靠的标记物来研究动物的成体神经发生[17-18]。本课题对成年猪和小鼠海马的结构以及神经发生的特点进行对比分析,在对猪海马结构进行分区、分层和细胞构筑方面研究的基础上,进而对其成体神经发生进行初步观察和研究,为大型哺乳动物海马结构的形态学研究,以及齿状回中成体神经发生的研究提供形态学方面的依据,并为畜牧兽医的临床应用提供参考。
1 材料与方法
1.1 材料
1.1.1 试验用动物 成年雄性昆白小鼠8只,体重38g左右,年龄3个月,购自西安交通大学医学院动物中心;成年雄性猪3头,种系为光明猪配套系,6月龄左右,购自陕西杨凌本香集团。
1.1.2 试剂与主要仪器 BrdU(Sigma),大鼠抗BrdU IgG(Serotec,Düsseldorf,Germany),羊 抗DCX IgG(Santa Cruz,heidelberg,Germany),小鼠抗NeuN IgG(Chemicon,Hofheim,Germany),兔抗GFAP IgG(Boehringer,Mannheim,Germany),免疫组化试剂盒、DAB试剂盒(福州迈新生物技术有限公司),驴抗羊568、羊抗大鼠488(Chemicon,Hofheim、),羊抗兔488(Jackson,Immunoresearch,Dianova),DAPI(Sigma);VT 1000S震荡切片机(Leica)。
1.2 方法
1.2.1 BrdU注射与动物取材 取试验小鼠3只按50mg/kg进行腹腔内注射BrdU,每隔12h注射1次,连续注射3d,最后1次注射BrdU 24h后取材。猪不做BrdU注射处理,所得切片进行DCX、NeuN和GFAP染色观察。
3只经BrdU注射处理和5只不做任何处理的小鼠,用40g/L多聚甲醛全身灌注的方法取全脑。3头健康成年猪,经放血处死后,断颈取头,通过颈动脉进行头部40g/L多聚甲醛固定然后立即开颅取脑,切取脑两侧海马。取两种动物海马中部部分,垂直于海马纵轴进行震荡切片,切片厚度50μm。所得小鼠BrdU标记的海马切片用于BrdU/DCX荧光双标记,对于没有经过处理的小鼠与猪的海马切片,通过染色后对其成体神经发生和结构进行对比分析。
1.2.2 免疫组化与免疫荧光染色(漂浮染色)
1.2.2.1 小鼠海马的BrdU/DCX荧光双标记 ①取BrdU标记的小鼠海马切片,放入2mol/L浓度的HCl中,37℃孵育30min,打开DNA双链,暴露抗原BrdU;②用0.1mol/L硼酸缓冲液冲洗,中和酸性,然后用0.1mol/L磷酸盐缓冲液(PBS)洗去残留硼酸,加入一抗羊抗DCX(1∶800),4℃下摇床孵育12h;③PBS充分洗后加入一抗大鼠抗BrdU(1∶800),继续4℃下孵育12h;④PBS洗,加入二抗驴抗羊568(1∶300)室温孵育4h;⑤PBS洗,然后再加入二抗羊抗大鼠488(1∶300),室温孵育4 h;⑥PBS洗后裱片,荧光保护剂封片。
1.2.2.2 猪海马DCX/DAPI、GFAP/DAPI荧光双标记 ①取猪海马切片,加入一抗羊抗DCX(1∶800)(或兔抗GFAP,1∶800),4℃摇床孵育12h;②用PBS洗,加入荧光二抗驴抗羊568(1∶300)(羊抗兔488,1∶300),4℃摇床孵育12h;③PBS洗后用DAPI(1∶500)复染核15min,PBS洗去残留 DAPI;④裱片,荧光保护剂封片。
1.2.2.3 猪和小鼠DCX-DAB、NeuN-DAB的免疫组织化学染色 ①取不做处理小鼠和猪的切片,放入30mL/L H2O2中孵育10min,封闭切片内源性过氧化物酶活性;②PBS洗后加入一抗羊抗DCX(1∶800)(或小鼠抗 NeuN,1∶800),4℃下摇床孵育12h;③然后PBS洗去残留一抗,加入生物素偶联的二抗兔抗羊(或羊抗小鼠),4℃摇床孵育12h;④PB洗后,加入链霉菌抗生物素蛋白结合的过氧化物酶室温摇床孵育1h;⑤PB洗后,以DAB试剂盒显色;⑥洗去残留显色液后,硫堇复染10min,然后用750mL/L酒精洗去浮色;⑦脱水透明后中性树胶封片。
1.2.3 数据统计与分析 对5只不做任何处理小鼠与3头猪海马进行切片后,每只动物各取10张切片,从单位齿状回长度新生神经元个数、新生神经元胞体面积及其相对树突长度(颗粒细胞层下层至海马裂的距离)三个方面进行统计分析。用Photoshop CS3软件处理图片,借助Images J,GraphPad Prism 5软件进行数据统计分析。
2 结果
2.1 以DCX标记技术来研究动物的成体神经发生的可行性
BrdU作为一种核苷酸类似物可以整合到新生细胞的DNA链中,BrdU在体内代谢时间大约只有2h,因此每一次BrdU注射均只标记在BrdU注射后2h内新生的细胞,然后通过抗BrdU抗体免疫组化技术就可显示被标记的这些新生细胞。
以BrdU标记的小鼠切片进行染色,所得结果如图1所示,图1A中箭头所指的绿色细胞为BrdU标记的新生的细胞,图1B中箭头所指的红色细胞为DCX标记的未成熟的神经元,图1C中上方箭头所指的黄色细胞为2种标记物同时标记的细胞,表示这个新生的细胞向神经元转化,而下方箭头所指的绿色细胞表示没有向神经元转化的新生细胞,这证明DCX标记方法可以把向神经元转化的新生细胞标记上,而新生神经元的增殖情况可以直接反映成体神经发生的情况,因此,DCX标记技术可以作为一种研究成体神经发生的手段。
2.2 成年小鼠海马神经发生特点及其新生神经元突触联系的建立
DCX标记显示成年小鼠海马颗粒细胞层下层存在着神经发生,源源不断的产生新的神经元,这些新生神经元分布相对比较松散,轴突、树突及其分支清晰可见,延伸方向明确,新生的神经元通过树突及轴突的延伸到固定位置建立起新的突触连接,借此整合到已存在的神经网络体系中并行使一定的功能,具体是新生神经元的树突穿过颗粒细胞层延伸到分子层终止于海马裂,而轴突通过门区与CA3区内侧的锥体细胞建立起突触联系(图2)。
2.3 成年猪海马神经发生特点及其与小鼠的差异
对比分析两种动物所染切片,小鼠海马齿状回呈圆滑的C型,而猪的呈现有2个突起的不规则C型,在形状上有一定的差异,和小鼠一样,猪海马的神经发生同样位于齿状回颗粒细胞层下层,如图2和图3。从单位齿状回长度新生神经元个数、新生神经元胞体面积及其相对树突长度(小鼠与猪新生神经元胞体起始于颗粒细胞层下层,树突伸入齿状回分子层,最长终止于海马裂,因此以颗粒细胞层下层至海马裂的距离间接反映新生神经元树突长度)三个方面,对两种哺乳动物的神经发生的情况进行对比分析,三方面差异均显著,如图4。图4A显示猪海马齿状回100μm长度内平均有新生神经元18.3个,而小鼠的为10.3个;图4B显示猪新生神经元胞体平均面积为48.9μm2,小鼠的为86.9 μm2;图4C显示猪新生神经元相对树突长度为451.4μm,小鼠的为275.6μm。

图1 成年小鼠海马齿状回BrdU/DCX免疫荧光双标Fig.1 BrdU/DCX immunofluorescence double labeling of the adult mouse dentate gyrus

图2 成年小鼠海马DCX-DAB免疫组织化学染色Fig.2 DCX-DAB immunohistochemical staining of adult mouse hippocampus
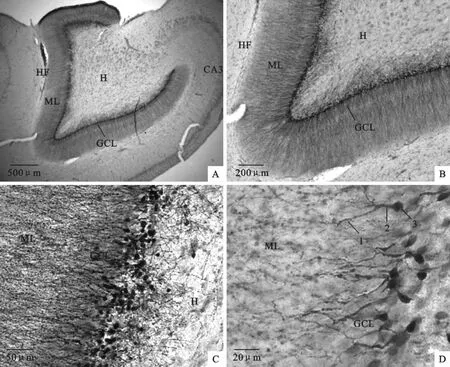
图3 成年猪海马DCX-DAB免疫组织化学染色Fig.3 DCX-DAB immunohistochemical staining of adult pig hippocampus

图4 小鼠与猪齿状回部位新生神经元三种参数对比示意图Fig.4 Three parameter comparison diagrams of dentate gyrus region's newborn neurons between mouse and pig
2.4 猪海马结构分层与细胞构筑
同小鼠一样,猪海马大体上亦由齿状回和海马本部两部分组成,二者均含有一个明显的细胞层,小“c”型的齿状回位于海马最内侧,大“C”型的海马本部包在齿状回外侧。海马本部从脑室面至海马裂依次为室床(alveus)、始层(stratum oriens)、锥体细胞层 (stratum pyramidale)、辐 射 层 (stratum radiatum)和腔隙分子层(stratum lacunosum-molecu-lare),如图5F。海马本部主要细胞为锥体细胞,构成锥体细胞层,大致分为CA1区和CA3区,CA1、CA3区的锥体细胞特点鲜明,细胞胞体比较密集地排成一条带,胞体呈锥形或梭形,突起极性一致,顶部朝向分子层发出一个粗大的顶树突,如图5A,5B,5C;海马齿状回为三层结构,由海马裂向内依次为分子层(molecular layer)、颗粒细胞层(granule cell layer)和多形层(polymorphic cell layer)。分子层中主要含有来自颗粒细胞的树突及分支,分子层细胞很少,主要是一些散在的中间神经元和胶质细胞;颗粒层主要由大量密集排列的颗粒细胞胞体构成,胞体大多呈卵形,颗粒层靠近门区一侧的细胞排列较紧密而整齐,如图5G,为成体神经干细胞的存在位置,是成体神经发生的起始位点,如图5H;多行层为海马门区靠近齿状回的区域,其内分布着大量的胶质细胞,大小不等,这些胶质细胞突起较短且无极性,发出许多微小分支,整体上呈绒球状,如图5F。

图5 猪海马结构的免疫组织化学染色图片Fig.5 Immunohistochemical pictures of pig’s hippocampal formation
3 讨论
BrdU标记技术被广泛用于成体神经发生的研究,但这个技术存在着一些缺陷[19]:BrdU浓度会随着细胞的连续分裂被稀释,标记效果就会下降,而且高剂量的BrdU会对组织产生毒性,过低的剂量又会导致不完全标记,最重要的是BrdU标记技术只能通过注射的方法对活体内的增殖细胞进行标记,而不能进行体外标记,而且BrdU价格昂贵,因此以此种技术来研究大型动物的成体神经发生就显得不太现实。
因此,本研究采用DCX标记技术来对比分析小鼠与猪成体神经发生的特点,突显猪成体神经发生的与小鼠相比有哪些不同。DCX标记技术具有很多优点:DCX作为一种新生神经元的标记物它既不在神经干细胞、胶质细胞中表达也不在成熟的神经元中表达,可以从新生神经元产生到成熟之前,整个时期都能瞬间地标记这些新生神经元;在幼体中,DCX表达只限于发育中枢神经系统中所有迁移中的神经元前体细胞,在成体,DCX表达只限于连续进行神经发生的区域,在其他区域很少表达,具有区域特异性;DCX表达细胞的数量可以表示齿状回中细胞增殖水平,而且,在外界因子的刺激下,仍可以通过DCX表达细胞的增加或减少来体现细胞增殖水平,因此DCX可被用于分析特定区域,以及在正常和病理条件下的神经发生的水平;并且它不需要预先对活体内的增殖细胞进行标记,可以直接在体外对DCX抗原进行定位、定量标记[20]。此外,DCX存在于细胞质中,通过免疫组化染色可以把细胞胞体显现出来,进而可以对胞体形态和面积等进行分析。因此,DCX标记技术可以作为一种研究大型动物成体神经发生的有效手段。
本试验通过免疫组化染色和多种双重免疫荧光标记所得结果表明,在成体猪齿状回颗粒细胞层下层也存在着DCX阳性细胞,即进行着成体神经发生。相对小鼠来说,猪海马齿状回颗粒细胞层下层单位长度内的新生神经元的数量以及其相对树突长度都要大于小鼠,但产生的新生神经元的胞体体积要明显小于小鼠,这意味着猪海马可以在相同的物质能量条件下可以产生更多的神经元,而更长的树突意味着这些新生的神经元可以与其他成熟的神经元建立起更多的突触联系,以上都说明猪海马部位的成体神经发生的活跃程度要明显高于小鼠,这都反映了猪脑的发达程度要高于小鼠,脑生理活动要比小鼠复杂。另外,通过 NeuN-DAB和 GFAP/DAPI的染色表明,猪海马的结构、分层以及细胞构筑与小鼠的大致相同,只是在各个分层的形状上有所差别,这说明海马结构在进化过程中的保守性,以及哺乳动物在进化过程的同源性。
本文主要通过免疫组织化学的方法,对比分析小鼠与猪海马成体神经发生的异同,并对成年猪海马结构的分区、分层以及细胞构筑进行了组织学水平的描述和定义,揭示大型动物猪海马结构及其成体神经发生的特点,而关于猪海马的主要纤维成分、齿状回的内部纤维联系、以及齿状回与外部的纤维联系等,还需进一步探索。
[1]Gould E.How widespread is adult neurogenesis in mammals[J].Nat Rev Neurosci,2007,8(6):481-488.
[2]Doetsch F,CailléI,Lim D A,et al.Subventricular zone astrocytes are neural stem cells in the adult mammalian brain[J].Cell,1999,97(6):703-716.
[3]Cameron H A,Mckay R D G.Adult neurogenesis produces a large pool of new granule cells in the dentate gyrus[J].J Comp Neurol,2001,435(4):406-417.
[4]Tracy A L,Jarrard L E,Davidson T L.The hippocampus and motivation revisited:appetite and activity[J].Behavioural Brain Res,2001,127(1-2):13-23.
[5]Ming G,Song H.Adult neurogenesis in the mammalian central nervous system[J].Annu Rev Neurosci,2005,28:233-250.
[6]Kempermann G,Jessberger S,Steiner B,et al.Milestones of neuronal development in the adult hippocampus[J].Trends Neurosci,2004,27(8):447-452.
[7]Kempermann G,Gast D,Kronenberg G ,et al.Early determination and long-term persistence of adult-generated new neurons in the hippocampus of mice[J].Development,2003,130(2):391-399.
[8]Cameron H A,Mckay R D G.Adult neurogenesis produces a large pool of new granule cells in the dentate gyrus[J].J Compar Neurol,2001,435(4):406-417.
[9]van Praag H,Schinder A F,Christie B R,et al.Functional neurogenesis in the adult hippocampus[J].Nature,2002,415(6875):1030-1034.
[10]Zhao C,Deng W,Gage F H.Mechanisms and functional implications of adult neurogenesis[J].Cell,2008,132(4):645-660.
[11]Kee N,Sivalingam S,Boonstra R,et al.The utility of Ki-67 and BrdU as proliferative markers of adult neurogenesis[J].J Neuro Sci Meth,2002,115(1):97-105.
[12]Thoolen B.BrdUrd labeling of S-phase cells in testes and small intestine of mice,using microwave irradiation for immunogold-silver staining:an immunocytochemical study[J].J Histochem & Cytochem,1990,38(2):267.
[13]Miller M W,Nowakowski R S.Use of bromodeoxyuridineimmunohistochemistry to examine the proliferation,migration and time of origin of cells in the central nervous system[J].Brain Res,1998,457(1):44-52.
[14]Deuel T A S,Liu J S,Corbo J C,et al.Genetic interactions between doublecortin and doublecortin-like kinase in neuronal migration and axon outgrowth[J].Neuron,2006,49(1):41-53.
[15]Koizumi H,Tanaka T,Gleeson J G,et al.Doublecortin-like kinase functions with doublecortin to mediate fiber tract decussation and neuronal migration[J].Neuron,2006,49(1):56-66.
[16]Nacher J,Crespo C,McEwen B S,et al.Doublecortin expression in the adult rat telencephalon[J].Eur J Neurosci,2001,14(4):629-644.
[17]Brown J P,Couillard-Després S,Cooper-Kuhn C M,et al.Transient expression of doublecortin during adult neurogenesis[J].J Comp Neurol,2003,467(1):1-10.
[18]Couillard-Despres S,Winner B,Schaubeck S,et al.Doublecortin expression levels in adult brain reflect neurogenesis[J].Eur J Neurosci,2005,21(1),1-14.
[19]Taupin P.BrdU immunohistochemistry for studying adult neurogenesis:Paradigms,pitfalls,limitations,and validatio[J].Brain Res Rev,2007,53(1),198-214.
[20]Rao M S,Shetty A K.Efficacy of doublecortin as a marker to analyse the absolute number anddendritic growth of newly generated neurons in the adult dentate gyrus[J].Eur J Neurosci,2004,19(2),234-246.
