双孢菇对壳聚糖保鲜剂的响应及其保鲜技术优化
2012-02-20李冠喜华国栋朱朋波魏良志王傲雪
李冠喜,华国栋,朱朋波,魏良志,王傲雪
(1.连云港市农业科学院,江苏 连云港 222006;2.南京林业大学森林资源与环境学院,南京 210037;3.连云港市海州区新坝镇农技中心,江苏 连云港 222001;4.东北农业大学生命科学学院,哈尔滨 150030)
双孢菇(Agaricus bisporus)又名白蘑菇、洋蘑菇,是世界上栽培最广、产量最多、消费最普遍的一种食用菌。近年来我国双孢菇栽培发展迅速,产量和出口量现已超过美国跃居世界第一。
双孢菇的贮藏保鲜问题一直是生产难题,制约其产业化的发展[1]。双孢菇菌盖表面没有保护结构,不能阻止外界的物理伤害、微生物侵染及水分流失,比市场中的其他新鲜果蔬货架期短,仅能保存3~4 d。另外,双孢菇呼吸速率高及含水量多,使得双孢菇极易产生微生物引起的腐烂和褐变现象。采后双孢菇品质降低主要表现为褐变、开伞、失水和质地变化。因此,双孢菇的保鲜技术已引起业内关注,而目前采用的保鲜剂大都为化学合成[2],保鲜效果不佳,且有毒性残留,不符合绿色食品的发展要求,而用壳聚糖制成的纯天然食用菌保鲜剂,保鲜效果显著,可满足食用菌贮藏、运输和销售等环节的保鲜要求。
壳聚糖可以抑制多种病原菌的生长,能够诱导防御性酶如壳聚糖酶及在寄主组织中诱发植保因素[3],形成的半透膜能够改变果实组织内部气体组成和降低蒸发损耗[4],抑制食用菌腐烂变质,是食用菌理想的保鲜材料。目前,壳聚糖作为保鲜剂应用在果蔬贮藏中的研究较多,而将其应用在食用菌保鲜中的研究相对较少,且大多集中在参照果蔬贮藏法利用高分子量壳聚糖的成膜性制成涂抹剂进行涂膜保鲜。
在双孢菇的保鲜应用中,高分子量的壳聚糖保鲜层成膜性较好但易使双孢菇的外观色泽发生改变而使其商品性降低,低分子量的壳聚糖成膜性稍差但抑菌效果好且可有效保持双孢菇的原有色泽。为了阐明壳聚糖在双孢菇贮藏保鲜中的作用,本实验在优化保鲜方案的基础上,研究双孢菇在壳聚糖保鲜剂的作用下各种理化指标的变化,以期为深入探讨食用菌贮藏保鲜机理的研究与生产实践应用提供参考依据。
1 材料与方法
1.1 供体材料与保鲜剂母液的配制
双孢菇由海州新坝丰泰食用菌公司提供。取3个1 000 mL烧杯,加入500 mL水,用柠檬酸溶解成1%溶液,加入0.5%氯化钠,分别加入低、中、高分子壳聚糖7.5 g,配成1.5%溶液,如不溶解,则加入2.5 mL冰醋酸,溶解成透明溶液后加入以下物质:维生素C 0.2%,半胱氨酸20 mg·kg-1。
1.2 保鲜方案优化
采用正交设计L9(34)。

表1 L9 (34)因素水平Table 1 Factors and levels
1.3 考察指标及方法
1.3.1 生理指标的测定
失水:失水率(%)=(贮后菇体重量-贮前菇体重量)/贮前菇体重量×100%;褐变:按菇体褐变面积大小分为4级0级:无褐变1级:褐变面积小于1/4 2级:褐变面积大于1/4小于1/2 3级大于1/2;开伞:按菇体开伞面积大小分为4级1级:无开伞2级:开伞面积小于1/4 3级:开伞面积大于1/4小于1/2 4级开伞大于1/2;硬度:采用硬度计测量;腐烂程度:按菇体腐烂面积大小分为4级0级:无腐烂1级:腐烂面积小于1/4 2级:腐烂面积大于1/4小于1/2 3级大于1/2。
1.3.2 生化指标的测定
选用优化的壳聚糖复合保鲜液处理双孢菇,置于PE袋4℃贮藏,测定各生化指标。
1.3.2.1 可溶性蛋白含量的测定
参照Bradford[5]法,使用牛血清白蛋白作标准曲线。
1.3.2.2 子实体总糖、还原糖含量的测定
在-20℃下冷冻完全后在真空干燥泵中干燥完全,然后用粉碎机粉碎干样,其粉粒大小能过80目筛即可制成样品。还原糖采用DNS法[6],用1 mg·mL-1的葡萄糖标准溶液作标准曲线;总糖采用苯酚硫酸法[7],用0.1 mg·mL-1的葡萄糖标准溶液作标准曲线。采用失重法。失重率(%)=(初始鲜重-贮后鲜重)/初始鲜重×100%。
1.3.2.3 子实体MDA含量的测定:
参照Heath和Pacontroler[8]的方法:将1.0 mL粗酶提取液加入3.0 mL 0.5%的硫代巴比妥酸(TBA,用15%的三氯乙酸配成)溶液中,混匀后在沸水域中煮沸I8 min,迅速用自来水冷却并在15 000 r·min-1离心机中离心10 min。取上清液在532和600 nm波长下分别测定光密度值。MDA含量(nmol·g-1·FW)。式中:A为反应液总量(4 mL);V为提取液总量(10.0 mL);a为测定提取液量(1.0 mL);FW材料鲜重(g);1.55×10-1为MDA的微摩尔消光系数。
1.3.2.4 子实体相对电导率的测定:
准确称取5.0 g菇体,大小均一;每个菇体作四等分处剪切,置于去离子水清洗的烧杯(100 mL)中,加去离子水至40 mL,立即测定其电导率,记为P0;10min后再次测定其电导率,记为P1;然后煮沸10 min,冷却至室温,再次加去离子水至刻度,测定其电导率,记为 P2。电导率(%)=(P1-P0)/(P2-P0)×100%。
1.3.2.5 子实体多酚氧化酶(PPO)活性的的测定
参照Galeazzi等的方法[9],并加以改进:将0.2 mL粗酶提取液加入2.0 mL邻苯二酚(用PBS 0.05 mol·L-1,pH 7.0配制成)中。反应温度30 ℃水浴中30 min,在410 nm处测定其吸光度,酶活以△OD410 nm·min-1·g-1·FW表示,重复3次。PPO活性(U·g-1·FW)=A×Vt/0.01×Vs×t×FW。式中A:样品管吸光度;Vt:样品提取液总体积(mL);Vs:测定时取粗酶液量(mL);t:显色反应时间(min);FW:样品重鲜(g)。
1.3.2.6 子实体超氧化物岐化酶(SOD)活性的测定
参照Constantine和Stanley[10]的方法,反应液(总体积3.0 mL)含有 13 mmol·L-1蛋氨酸、0.075 mmol·L-1NBT、0.1 mmol·L-1EDTA、0.002 mmol·L-1核黄素以及0.1 mmol·L-1粗酶液(包含于50 mmol·L-1PBS,pH=7.8)。1个SOD的酶活单位定义为NBT被抑制率50%,其单位表示为unit/h/g·FW。SOD活性(U·g-1·FW)=(A0-AS)×Vt×60/A0×0.5×FW×Vs×t。式中A0:光下对照管吸光度;AS:样品管吸光度;Vt:样品提取液总体积(mL);Vs:测定时取粗酶液量(mL);t:显色反应时间(min);FW:样品重鲜(g)。
1.3.2.7 子实体过氧化氢酶(CAT)活性的测定
测定参照Kato and Shimizu[11]的方法。在含有0.1M PBS(pH=7.0)以及2 mmol·L-1H2O2的2.9 mL 反应液中加入0.1 mL粗酶液,在240 nm处测定其初始吸光度的变化值(ε240=40 mmol·L-1cm-1)。CAT活性(IU)=1 000×A×V/ε×d×v。式中A:240 nm处吸光度每分钟变化量;V:反应液总体积(mL);ε:消光系数(M-1·cm-1);d:光程(cm);v:样品测定时粗酶液量(mL)。
1.4 数据处理
试验结果采用SPSS软件进行统计分析。
2 结果与分析
2.1 正交试验结果分析
正交试验结果见表2、3。可知,各因子对失水率影响为:保存方式(D)>糖种类(A)>处理方式(C)>糖浓度(B),最佳方案是D3A3C2B1,即,低分子壳聚糖,1%浓度喷洒,4℃PE袋保存效果最佳;各因子对硬度变化的影响为:保存方式(D)>壳聚糖种类(A)>喷洒方式(C)>壳聚糖浓度(B),最优方案为A3B1C2D3,即高分子壳聚糖0.5%浓度,浸泡300 s 4℃PE袋保存;各因子对腐烂程度的影响为:保存方式(D)>壳聚糖种类(A)>壳聚糖浓度(B)>喷洒方式(C),最优方案为A1B1C2D3,即低分子壳聚糖0.5%浓度浸泡300 s,置于PE袋4℃保存;各因子对开伞率的影响为:保存方式(D)>壳聚糖种类(A)>壳聚糖浓度(B)>喷洒方式(C),最优方案为A3B3C2D3,即高分子壳聚糖1.5%浓度浸泡300 s 4℃PE袋保存;各因子对褐变的影响为:保存方式(D)>壳聚糖浓度(B)>喷洒方式(C)>壳聚糖种类(A),最优方案为A3B3C2D3,即高分子壳聚糖1.5%浓度浸泡300 s置于PE袋4℃保存。考虑到农艺操作的便利、商品性、成本等因素,宜选用低分子壳聚糖在双孢菇采收前喷洒,采收后置于PE袋4℃保存,如果短期内上市,也可考虑喷施保鲜剂后常温保存。

表2 正交试验计算结果Table 2 Orthogonal experiment results of calculation

表3 正交试验测定结果平均值Table 3 Average of orthogonal test results
2.2 壳聚糖保鲜剂对双孢菇子实体可溶性蛋白含量的影响
可溶性蛋白质含量的下降是作为组织衰老的一个重要指标,在蘑菇的采后贮藏中,大部分被分解用以满足代谢需要。从图1中可以看出,贮藏的1~16 d,处理组和对照组的可溶性蛋白都呈下降趋势,对照组下降的幅度更大,经显著性分析,处理组和对照组样品的可溶性蛋白含量差异极显著(P<0.01),说明处理组可溶性蛋白分解较慢,即代谢速度较慢。其后处理组下降速度明显加快,随着贮藏期延长,到19~25 d时处理组和对照组的下降趋势基本一致,说明处理组的代谢速度加快,衰老加快,经显著性分析,处理组和对照组样品的可溶性蛋白含量差异达显著(P<0.01)。以上说明保鲜剂能显著降低双孢菇子实体蛋白的分解速度,从而减缓子实体的衰老,达到保鲜的目的。

图1 保鲜剂对双孢菇子实体可溶性蛋白含量的影响Fig.1 Effect of antistaling agent on the soluble protein content of the fruit bodies
2.3 壳聚糖保鲜剂对双孢菇子实体总糖、还原糖含量的影响
双孢菇采收后总糖不断被分解代谢,产生大量的还原糖,还原糖同时也被不断做为呼吸底物被分解成H2O和CO2并产生能量或转化成其他物质。图2表明,总糖的水平总体呈下降趋势,处理组在10~16 d保持较小的下降趋势,且其含量明显比对照高,其后下降趋势加快,到25 d时和对照趋于一致,经显著性分析,无论是贮藏初期还是贮藏末期,处理组和对照组样品的总糖含量均差异显著(P<0.05),说明壳聚糖能在一定程度上抑制总糖的分解。图3表明,还原糖在整个贮藏的25 d里都在上升,但在4~16 d里其含量明显低于对照,经显著性分析,其差异达显著水平(P<0.05),其后和对照趋于一致。
2.4 壳聚糖保鲜剂对双孢菇子实体丙二醛(MDA)含量的影响
植物器官衰老开在逆境下遭受伤害,往往发生膜脂过氧化作用,丙二醛(MDA)是膜脂过氧化的最终产物,其含量可以反映植物遭受伤害的程度,其积累可能对膜和细胞造成一定的伤害。MDA能降低SOD、CAT和POD活性,加剧脂质过氧化作用,与蛋白质结合后,使蛋白质(酶)变性,降低膜脂的不饱和度和膜的流动性,使细胞膜的透性增大。由图4可知,经25 d的贮藏,处理组和对照组样品的MDA含量由最初的6.102和7.171 nmol·g-1·FW 分 别 增 加 到 17.102 和 26.044 nmol·g-1·FW。这表明保鲜剂处理可降低脂肪的氧化程度。经显著性分析,无论是贮藏初期还是贮藏末期,处理组和对照组样品的MDA含量均差异极显著(P<0.01),表明,保鲜剂处理可在一定程度上抑制双孢菇的氧化损伤。

图2 保鲜剂对双孢菇子实体总糖的影响Fig.2 Effect of antistaling agent on the total sugar content of the fruit bodies

图3 保鲜剂对双孢菇子实体还原糖的影响Fig.3 Effect of antistaling agent on the reducing sugar content of the fruit bodies
2.5 壳聚糖保鲜剂对双孢菇子实体相对电导率的影响
相对电导率是衡量组织细胞膜完整性的一个主要指标,在贮藏过程中,细胞膜的透性加大,细胞中电解质(主要是钾离子)向外渗透速度加快,就会加速菇体的衰老和变质。

图4 保鲜剂对双孢菇子实体丙二醛(MDA)含量的影响Fig.4 Effect of antistaling agent on the MDA content of the fruit bodies
图5表明,在贮藏过程中,处理组和对照组的相对电导率都呈上升趋势,但处理组始终低于对照组,且有显著的差异(P<0.05)。表明保鲜剂处理能有效地抑制细胞膜的损伤。

图5 保鲜剂对双孢菇子实体相对电导率的影响Fig.5 Effect of antistaling agent on the relative conductivity in the fruit bodies
2.6 壳聚糖保鲜剂对双孢菇子实体多酚氧化酶(PPO)活性的影响
植物组织酶褐变是由于PPO与酚类物质的区域化分布打破后,PPO催化酚类物质氧化形成的。PPO分布于细胞的质体中,酚类物质存在于液泡中,正常的细胞不会发生褐变。逆境或衰老等因素会刺激活性氧增加,损伤细胞的膜结构,打破PPO与酚类物质的区域化分布,引起组织褐变。图6表明,在前13~16 d里处理组和对照组的PPO活性在逐渐增加,对照组急速地达到峰值的时间是在第16 D,而处理组在第19 D时才出现峰值,但二者的差异并不显著,此后,处理组和对照组的PPO活性随着贮藏时间的延长而逐渐衰减趋于一致。说明,保鲜剂对双孢菇的PPO活性并没产生较大的影响,其减缓褐变发生的原因是保鲜剂可抑制膜脂氧化,维持细胞膜的完整性,从而避免了PPO与酚类物质的接触。

图6 保鲜剂对双孢菇子实体PPO活性的影响Fig.6 Effect of antistaling agent on the PPO activity in the fruit bodies
2.7 壳聚糖保鲜剂对双孢菇子实体超氧化物岐化酶(SOD)活性的影响
SOD的活性变化如图7所示。SOD作为氧自由基的酶性清除剂,经壳聚糖保鲜剂处理后,其活性与对照组相比增加幅度较大,这说明壳聚糖处理增强了双孢菇对氧自由基的清除能力。在贮藏过程中,处理组和对照组的SOD活性在第16d达到最大值,随后逐渐降低。经显著性分析,在贮藏过程中,处理组和对照组的SOD活性始终差异显著(P<0.05)。结果表明,保鲜剂处理可以使SOD活性保持在较高的水平,SOD通过清除氧自由基,从而减少活性氧物质对双孢菇的损伤来延长其贮藏期。
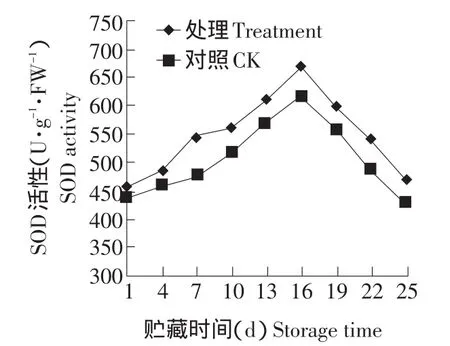
图7 保鲜剂对双孢菇子实体SOD活性的影响Fig.7 Effect of antistaling agent on the SOD activity in the fruit bodies
2.8 壳聚糖保鲜剂对双孢菇子实体过氧化氢酶(CAT)活性的影响
植物在衰老时,由于体内活性氧代谢加强而使H2O2发生累积,可以直接或间接氧化细胞内核酸、蛋白质等大分子,并使细胞膜受损害,从而加速细胞的衰老。过氧化氢酶可以清除H2O2,是植物体内清除活性氧的重要保护酶之一。
由图8可以看出,无论是处理组还是对照组中的过氧化氢酶活性都是先增加后减少,到第4天时达最大,经显著性分析,在贮藏过程中,处理组和对照组之间过氧化氢酶活性差异达显著水平(P<0.05)。
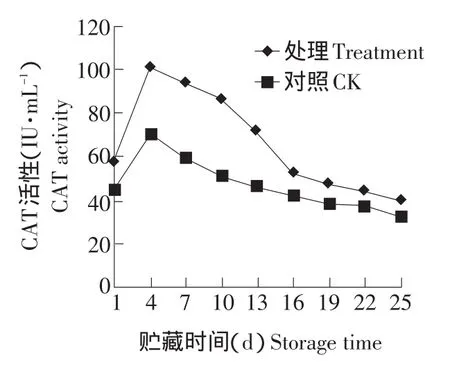
图8 鲜剂对双孢菇子实体CAT活性的影响Fig.8 Effect of antistaling agent on the CAT activity in the fruit bodies
3 讨论与结论
低分子质量的壳聚糖具有较强的渗透性,渗入的氨基和羟基既能与果蔬细胞膜结合,又能除去果蔬催熟化合物(如醛类)和它们的中间体,从而调节果蔬贮藏过程中的生理生化变化,延长贮藏保鲜时间[12]。不同浓度的壳聚糖溶液,其粘度不同,形成的保鲜膜的疏密程度也不同,当浓度太小时,成膜薄,对果蔬体内与空气的交换的阻力小,就会导致果蔬内的O2浓度升高,呼吸作用增强,营养成分及有机酸消耗过快;当浓度过高时,成膜过厚,使得果蔬内的O2浓度太低,不能满足正常呼吸,造成无氧呼吸,保鲜时间也短[13]。对双孢菇来说,成膜过厚会影响其外观色泽,进而影响其商品性,宜选用低分子质量的壳聚糖,浓度宜偏低但不宜过低,依靠其诱导防御性酶如壳聚糖酶及在寄主组织中诱发植保因素,从而达到保鲜效果[14]。
食用菌具有特殊的生长规律和采后生理活动,采收后仍有旺盛的生命力,当其无法从培养基质中获得养分来满足菌丝的生长需要时,就会降解自身在初级代谢阶段合成和积累的生物大分子来保持生长的能量需要,从而导致品质的下降[15]。食用菌采后采用不同的贮藏方式,效果不尽相同。本研究用不同分子质量不同浓度的壳聚糖复合保鲜液处理双孢菇子实体,并探讨了处理后双孢菇的生理生化变化和保鲜效果,结果表明:在贮藏过程中,双孢菇子实体可溶性蛋白、总糖、还原糖的含量明显高于对照;还原糖、MDA的含量、相对电导率均低于对照;SOD和CAT的活性明显高于对照;壳聚糖能维持细胞膜的完整性,避免了PPO与酚类物质的接触,从而抑制了双孢菇的褐变发生;壳聚糖能使起不同作用酶的活性保持在对贮藏保鲜有利的水平上,能够延缓机体衰老。
果蔬细胞内对过氧化有2类防御系统:一类是SOD、POD和CAT等酶促防御系统,另一类是抗坏血酸、还原性谷胱甘肽等非酶促防御系统。SOD、POD和CAT等是植物中重要的抗氧化系统。其中,SOD是植物体内抗氧化防御系统的关键本科,它的作用是将O2-分解成H2O和O2。SOD和CAT或POD共同作用要清除体内具有潜在危险的O2-和H2O2,从而最大限度减少活性氧的形成[16]。从本试验可见,在贮藏过程中,处理组的SOD、POD和CAT的活性都比对照组有了显著的提高,它们较高的活性可以使双孢菇体内的活性氧保持在较低的水平,减轻了自由基的毒害作用,延缓双孢菇的衰老。
MDA是植物细胞膜酯过氧化的产物,是植物细胞受伤害的重要指标;相对电导率则是能够反映果蔬中细胞膜透性的生理指标;超氧阴离子(O2-)生成量也是检测植物衰老的重要指标之一。这三者能在一定程度上反映植物细胞膜的完整程度[17]。从本试验可见,在贮藏过程中,对照组的MDA含量、相对电导率都与对照相比有较大的降低。这说明在贮藏过程中,壳聚糖保鲜剂能有效地保持双孢菇细胞膜的完整性,从而达到延长贮藏期和延缓腐烂的目的。
[1]班立桐,吴疆,杨红澎.双孢菇中活性成分与保鲜技术的研究进展[J].食品研究与开发,2010(4):185-186.
[2]翟万京.复合液保鲜剂对双孢蘑菇保鲜效果的研究[J].食用菌,2010(2):59-60.
[3]叶磊,何立千,高天洲,等.壳聚糖的抑菌作用及其稳定性研究[J].北京联合大学学报:自然科学版,2004,18(1):79-82.
[4]刘艳如,余萍,郑怡.水溶性壳聚糖的抑菌作用研究[J].中国海洋药物,2001,80(2):42-44.
[5]Bradford M M.A rapid and sensitive method for detecting microgram amounts of protein utilizing the principle of proteindye binding[J].Anal Biochem,1976,72:248-254.
[6]Miller G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Anal Chem,1959,31:426-428.
[7]Dubois M,Gilles K A,Hamilton K.Colorimetric method for determination of sugar and related substances[J].J Anal Chem,1956,28:350-356.
[8]Heath R T,Pacontroler L.Photoperoxidation in isolated Chloroplasts.I.Kinetics and stoichiometry of fatty acid peroxidation.Arch[J].Biochem Biophys,1968,125:189-198.
[9]Galeazzi M A M,Sgarbieri V,Costantinides S M.Isolation,purification and physiocochemical characterization of polyphenoloxidase from dwarf variety of banana(Musacavendishii)[J].J Food Sci,1981,46:150-155.
[10]Constantine N G,Stanley K R.Superoxide dismutases[J].Plant Physio,1977,59:309-314.
[11]Kato M,Shimizu S.Chlorophyll metabolism in higher plants.Ⅶ.Chlorophyll degradation in senescing tobacco leaves:Phenolicdependent peroxidative degradation[J].Can J Bot,1987,65:729-735.
[12]冯守爱,林宝凤,梁兴泉.壳聚糖保鲜膜的研究进展[J].高分子通报,2004(6):68-72.
[13]杨威,吴素蕊,高观世,等.壳聚糖和刺托竹荪菌丝体提取液对双孢蘑菇保鲜效果的研究[J].食品工业科技,2010(9):314-320.
[14]Hajslova J,Hajkova L,Schulzova V,et al.Stability of agaritine a natural toxicant of Agaricus mushrooms[J].Food Additives and Contaminants,2002,19(11):1028-1033
[15]Braaksma A,Schaop D G,Schipper G M A.Time of havest determins the postharvest quality of the common mushroom Agaricus bisporus[J].Postharvest Biology and Technology,1999,16(2):195-198.
[16]陈安和.几丁质对贮存草莓中的SOD活力和VC含量的影响[J].食品科学,1994(8):58-61.
[17]陈向明.采后菠菜在特定条件下几种生理指标的变化[J].安徽大学学报:自然科学版,2001:592-596.
