鼠疫F1蛋白原核分泌性表达及鉴定
2012-02-05魏东王国治
魏东,王国治
鼠疫F1蛋白原核分泌性表达及鉴定
魏东,王国治
目的构建重组质粒,在大肠杆菌中表达鼠疫菌 F1 抗原。方法用 PCR 方法扩增出带有信号肽的 F1 基因,将其克隆到表达载体 pET30a(+) 上,转化大肠杆菌 BL21(DE3);用 IPTG 诱导目的基因表达,层析方法纯化 F1 蛋白,测定其分子量、等电点、N 末端氨基酸序列,用 Western blot法检测其抗原性。
结果根据双酶切和 DNA 测序结果显示,F1 基因成功连接到表达载体 pET30a(+) 中,F1 蛋白主要为分泌性可溶表达。测定纯化后 F1 蛋白的相对分子量约为 15.6 kD,等电点为 4.15,N 末端氨基酸序列与理论序列一致。经 Western blot 鉴定,能被兔抗鼠疫菌 EV 株血清识别。
结论成功克隆并构建了 F1 蛋白分泌性原核表达系统,所表达的重组 F1 蛋白具有较好的抗原性,为新型鼠疫疫苗研制提供基础。
耶尔森菌,鼠疫; 克隆,分子; 基因表达
鼠疫是由鼠疫耶尔森菌(Yersinia pestis)引起的烈性传染病。鼠疫菌被列为重要的生物战剂和生物恐怖剂,一直受到高度重视。人类历史上曾有3 次暴发流行,夺走数亿人的生命。目前国内外鼠疫疫情有逐渐活跃的趋势[1],2010年秋在我国西藏暴发了人间鼠疫,说明鼠疫流行有可能死灰复燃。
传统鼠疫疫苗有两种,一种是灭活疫苗,对腺鼠疫有一定的保护效果,但因其用强毒株生产,存在着安全性差、保护期短、接种反应率高、不能有效预防肺鼠疫等问题[2-3];另一种是减毒活疫苗,采用皮上划痕接种,该方法无法定量接种,阳转率低[4]。因此,迫切需要安全有效的新型鼠疫疫苗。
现有研究证明,鼠疫耶尔森菌免疫保护性抗原主要是荚膜蛋白抗原分子(fraction F1)和表面抗原(V)分子[5-6]。F1 抗原是一种荚膜蛋白,由 100 kb的 pFra 质粒编码,是鼠疫菌的特异性抗原之一。F1 抗原位于菌体表面,有抗吞噬作用,可诱导机体产生抗体,与抗鼠疫感染有密切关系,是制备新型疫苗不可缺少的成分。本研究构建 pET-30a/F1重组表达质粒菌株,并诱导目的基因表达,通过层析纯化,获得了鼠疫 F1 重组蛋白抗原,为新型鼠疫疫苗的研制奠定了基础。
1 材料与方法
1.1 主要材料
1.1.1 菌种及质粒 大肠杆菌 DH5a 和 BL21(DE3)、质粒 pET-30a(+) 均由本室保存。
1.1.2 分子生物学试剂 内切酶NdeI、EcoR I、T4 DNA 连接酶、PyrobestDNA 聚合酶、DNA 凝胶回收试剂盒和质粒 DNA 小量纯化试剂盒均为日本 TaKaRa 公司产品。
1.1.3 其他鼠疫专用试剂 鼠疫菌 DNA 模板及鼠疫诊断血清(批号 20020501)均由兰州生物制品研究所提供。
1.2 方法
1.2.1 引物设计与合成 根据文献报道的序列(Gene-Bank:X61996)用 Oligo6.0 软件设计引物。F1 上游引物:5′ GGCGAGTCCATATGAAAAAAA TCAGTTCC 3′;F1 下游引物:5′ CCGGAATTCTT ATTGGTTAGATACGGT 3′;下划线分别为NdeI、EcoR I 酶切位点。引物由宝生物工程(大连)有限公司合成。
1.2.2 PCR 扩增 F1 抗原结构基因 以鼠疫菌DNA 为模板,以 F1 上下游引物进行扩增。PCR条件:94 ℃ 5 min;94 ℃ 1 min,60 ℃ 1 min,72 ℃l min,30 个循环;72 ℃ 7 min。
1.2.3 重组质粒的构建及鉴定 将上述 PCR 产物通过 1% 琼脂糖凝胶电泳,以 DNA 凝胶回收试剂盒回收纯化。将 PCR 回收产物与 pET-30a(+)以NdeI 和EcoR I 双酶切,回收后用 T4 DNA 连接酶连接,以 CaCl2法转化大肠杆菌 DH5a,在卡那霉素抗性平皿挑选阳性克隆。用质粒提取试剂盒提取阳性克隆质粒,对质粒 DNA 进行 PCR 扩增和双酶切鉴定,将初步鉴定为阳性克隆的菌株测序。
1.2.4 Fl 蛋白的表达与纯化 将构建好的重组质粒 pET-30a/F1 阳性克隆转化大肠杆菌 BL21(DE3),挑选高表达克隆。将诱导后菌液离心,取上清样品 ⑴,将菌体沉淀重悬于 PBS,超声碎菌,取样品 ⑵,将破碎菌离心,取上清样品 ⑶,将沉淀重悬于 8 mol/L 尿素溶液,溶解取样 ⑷,进行SDS-PAGE 分析重组蛋白的表达形式。将构建菌株接种于 LB 培养基 37 ℃ 培养,用 IPTG 诱导目的蛋白表达,收获物经离子交换和疏水层析方法纯化 F1 蛋白。
1.2.5 F1 蛋白的检测与鉴定[7]SDS-PAGE 法测定其分子量。等电聚焦电泳法测定 F1 蛋白的等电点。用氨基酸测序仪测定 N 末端氨基酸序列。样品经 SDS-PAGE 并转至硝酸纤维膜上,封闭,用鼠疫诊断血清和辣根过氧化物酶逐级标记羊抗兔 IgG 抗体,邻苯二胺(OPD)显色,进行 Western blot 分析。
2 结果
2.1 F1 基因 PCR 扩增产物及重组质粒 pET-30a/F1 的鉴定
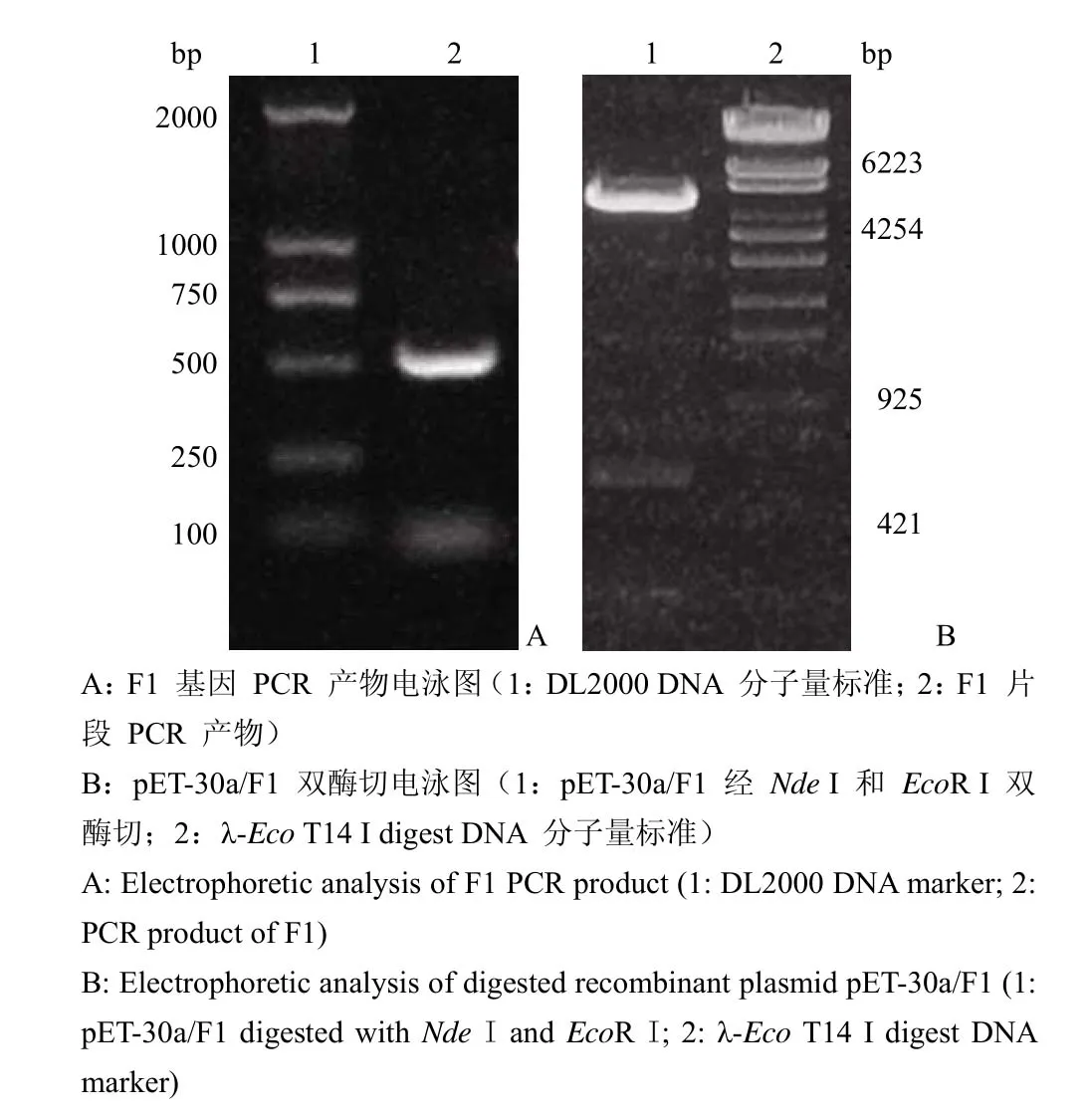
图 1 F1 基因 PCR 扩增及 pET-30a/F1 质粒双酶切电泳图Figure 1 Electrophoretic analysis of F1 PCR product and digested recombinant plasmid pET-30a/F1
PCR 扩增目的基因片段经 1% 琼脂糖凝胶电泳,在 500 bp 分子量处见一明显电泳带(图 1A),与理论分子量一致。
以NdeI 和EcoR I 双酶切重组质粒 pET-30a/F1,可见一条 500 bp 的目的基因带和一条5300 bp 大小的载体片段(图 1B)。
阳性克隆由 Invitrogen 公司进行 DNA 测序,结果表明,重组质粒中 F1 抗原结构基因序列与Gene-Bank(X61996)的基因序列完全相同。
2.2 重组蛋白的表达及纯化
重组蛋白 F1 有 3 种表达形式:分泌于细胞外培养基中、细胞内可溶形式以及细胞内包涵体形式(图 2)。经分析,分泌表达于胞外培养基中的 F1蛋白可溶性好而且纯度高,因此我们对该蛋白进行纯化。经离子交换层析和疏水层析纯化,F1 蛋白纯度可达 95%(图 3)。
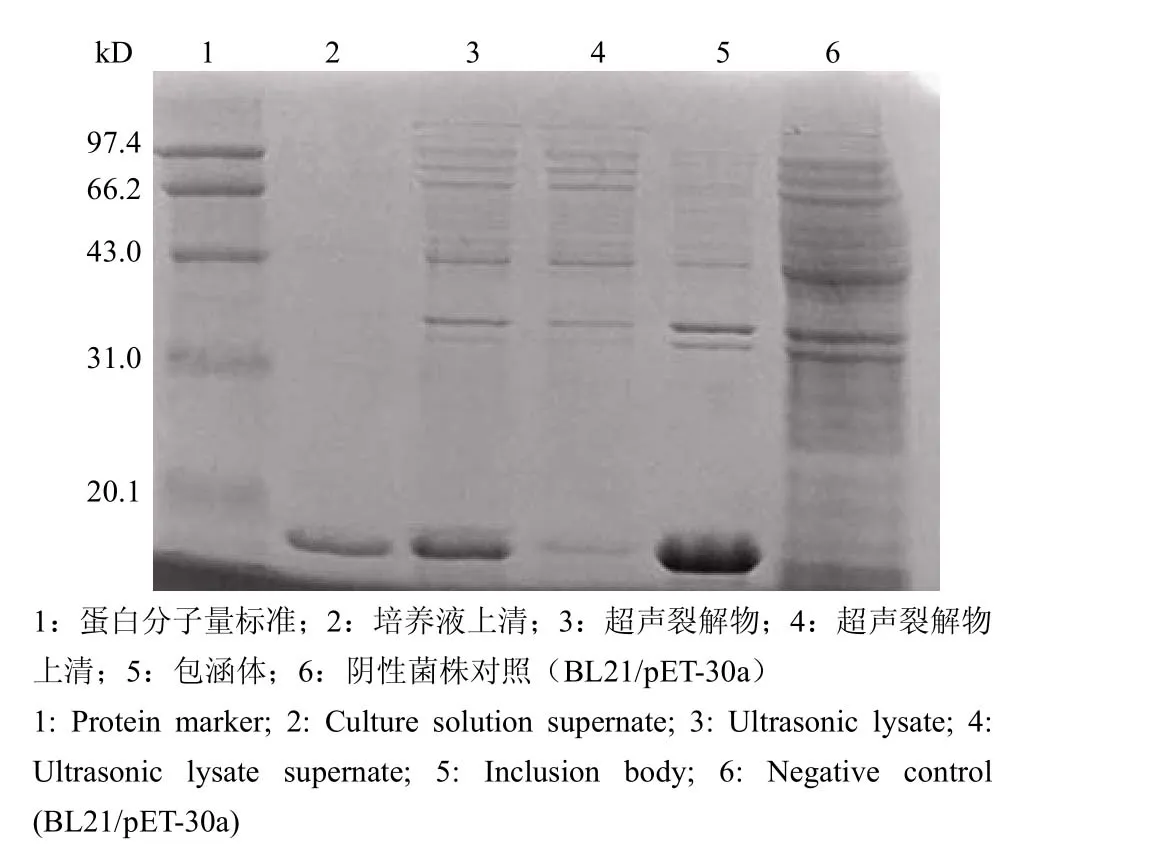
图 2 F1 抗原的表达形式电泳图Figure 2 Expression form analysis of F1
图 3 重组蛋白 F1 的纯化电泳图Figure 3 Analysis of F1 purified products
2.3 Fl 蛋白的检测与鉴定
2.3.1 分子量测定结果 经 SDS-PAGE 电泳,根据薄层扫描的结果,F1 蛋白在 12% 分离胶的SDS-PAGE 中的表观分子量在 15.6 kD 左右(图4)。
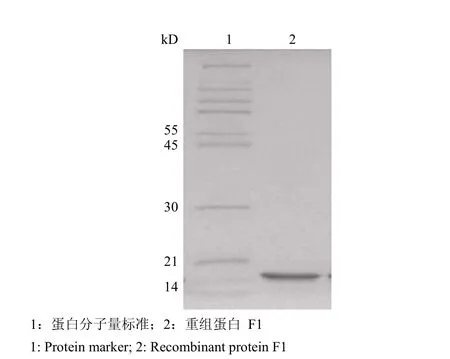
图 4 F1 蛋白 SDS-PAGE 法分子量分析结果Figure 4 Molecular weight analysis of F1 protein
2.3.2 等电点测定结果 等电聚焦电泳法测定F1 蛋白的等电点为 4.15,与理论等电点 4.3 接近。
2.3.3 N 末端氨基酸的测定结果 用氨基酸序列分析仪测定,其 N 末端 15 个氨基酸序列为ADLTASTTATATLVE,与理论序列一致。
2.3.4 蛋白质 Western blot 检测 重组蛋白 F1经 SDS-PAGE 后,将蛋白电转移至硝酸纤维素膜上,进行 Western blot检测。结果显示重组蛋白与抗鼠疫杆菌血清有特异的印迹反应(图 5)。
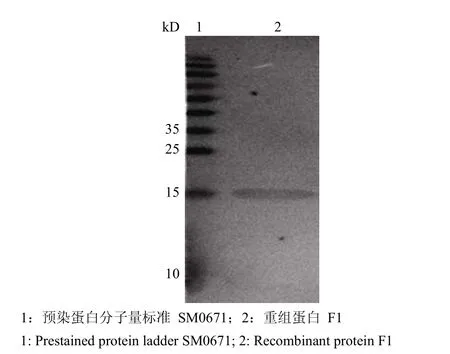
图 5 重组蛋白 F1 的免疫印迹分析Figure 5 Western blot of recombinant protein F1
3 讨论
F1 结构基因(caf1)受温度调节,37 ℃ 时能产生 F1 抗原。结构基因长度为 513 个单核苷酸,编码一种分子量为 17.6 kD 的由 170 个氨基酸组成的多肽,其中包括 21 个氨基酸的信号肽。该信号肽与大肠杆菌信号肽有很高的同源性,在分泌到菌体表面时信号肽已被切除[8]。本研究通过对重组表达的 F1 蛋白 N 末端氨基酸测定表明,该信号肽可被大肠杆菌 BL21(DE3) 识别并切除,重组蛋白 F1 被分泌到细胞外。
F1 抗原为一位于鼠疫菌体表面荚膜物质,表达 F1 抗原的鼠疫菌对巨噬细胞有抗吞噬作用[9]。许多研究表明以 F1 抗原制备的亚单位疫苗可使动物产生对鼠疫的保护作用,表明 F1 抗原是一种重要的保护性抗原[10-11]。世界上许多国家都在进行以 F1 抗原为基础的鼠疫亚单位疫苗研制,有些已经进入临床研究阶段[12]。
本实验通过基因重组技术在大肠杆菌 BL21(DE3) 中成功地表达了 F1 抗原。实验中大肠杆菌表达的 F1 抗原有 3 种表达形式,分泌表达于细胞外可溶形式,细胞内可溶形式以及细胞内包涵体形式。分泌表达于细胞外的 F1 蛋白可溶性好而且纯度高,避免了以包涵体形式存在的蛋白在纯化过程中变性剂对蛋白免疫原性的破坏,有利于 F1 抗原的纯化及抗原性保存。对纯化后重组蛋白 F1 的分子量、等电点及 N 末端氨基酸序列进行测定,结果与理论一致。免疫印迹结果也表明该 F1 抗原能与抗鼠疫诊断血清结合,说明重组的 F1 蛋白有良好的抗原性。本研究为新型鼠疫疫苗的研制奠定了基础。
[1]Gao CH.Trends and forecasting of the plague between 80's and 90's of 20th century.Chin J Endemiology, 2000, 19(4):304-306.(in Chinese)
高崇华.20世纪80-90年代鼠疫动态及预测分析.中国地方病杂志,2000, 19(4):304-306.
[2]Heath DG, Anderson GW Jr, Mauro JM, et al.Protection against experimental bubonic and pneumonic plague by a recombinant capsular F1-V antigen fusion protein vaccine.Vaccine, 1998,16(11-12):1131-1137.
[3]Russell P, Eley SM, Hibbs SE, et al.A comparison of Plague vaccine,USP and EV76 vaccine induced protection against Yersinia pestis in a murine model.Vaccine, 1995, 13(16):1551-1556.
[4]Yan HF.Observations of the serological responses of persons and guinea pigs after vaccination with strain of Yersinia pestis and the guinea pig protection test.Endemic Dis Bull, 1986, 1(3):211-214.(in Chinese)
晏慧芳.鼠疫活疫苗接种后人群和豚鼠血清学反应及豚鼠自动保护力试验观察.地方病通报, 1986, 1(3):211-214.
[5]Jones SM, Day F, Stagg AJ, et al.Protection conferred by a fully recombinant sub-unit vaccine against Yersinia pestis in male and female mice of four inbred strains.Vaccine, 2000, 19(2-3):358-366.
[6]Huang J, D'Souza AJ, Alarcon JB, et al.Protective immunity in mice achieved with dry powder formulation and alternative delivery of plague F1-V vaccine.Clin Vaccine Immunol, 2009, 16(5):719-725.
[7]Chinese Pharmacopoeia Commission.Pharmacopoeia of the People’s Republic of China.Volume 3, 2010.Beijing: China Medical Science Press, 2010: appendix 54-55.(in Chinese)
国家药典委员会.中华人民共和国药典.2010年版三部.北京: 中国医药科技出版社, 2010:附录54-55.
[8]Galyov EE, Smirnov OYu, Karlishev AV, et al.Nucleotide sequence of Yesinia pestis gene encoding F1 antigen and the primary structure of the protein.FEBS Lett, 1990, 277(1-2):230-232.
[9]Du Y, Rosqvist R, Forsberg A.Role of fraction 1 antigen of Yersinia pestis in inhibition of phagocytosis.Infect Immun, 2002, 70(3):1453-1460.
[10]Andrews GP, Heath DG, Anderson GW Jr, et al.Fraction 1 capsular antigen (F1) purification from Yersinia pestis CO92 and from an Escherichia coli recombinant strain and efficacy against lethal plague challenge.Infect Immun, 1996, 64(6):2180-2187.
[11]Galván EM, Nair MK, Chen H, et al.Biosafety level 2 model of pneumonic plague and protection studies with F1 and Psa.Infect Immun, 2010, 78(8):3443-3453.
[12]Williamson ED, Flick-Smith HC, Lebutt C, et al.Human immune response to a plague vaccine comprising recombinant F1 and V antigens.Infect Immun, 2005, 73(6):3598-3608.
www.cmbp.net.cn Chin Med Biotechnol, 2012, 7(3):202-205
Secreted expression and identification of F1 protein ofYersinia pestisin prokaryocyte
WEI Dong, WANG Guo-zhi
ObjectiveTo construct the recombinant plasmid expressing F1 protein ofYersinia pestisinE.coliBL21(DE3).
MethodsThe F1 gene was amplified by PCR, cloned into prokaryotic expression plasmid pET30a(+) and then transformed intoE.coliBL21(DE3).The recombinantE.coliBL21(DE3) was induced by IPTG.The protein was purified, and its molecular weight,isoelectric point and N-terminal amino acid sequence was identified.The antigenicity of the protein was measured by Western blot.
ResultsThe F1 protein is mainly expressed in a secreted form by the recombinantE.coliBL21(DE3) strain.Its molecular weight is 15.6 kD identified by SDS-PAGE, and isoelectric point is 4.15.The N-terminal amino acid sequence of the protein is completely the same as expected.As Western blot result shows, the F1 protein could react with plague anti-sera from rabbit.
Conclusion pET-30a/F1 expressing secretive F1 protein is successfully constructed.The F1 protein developed by this study has good immunoreactivity with plague anti-serum.
Yersinia pestis; Cloning, molecular; Gene expression
WANG Guo-zhi, Email: tbtestlab@vip.tom.com
www.cmbp.net.cn 中国医药生物技术, 2012, 7(3):202-205
10.3969/cmba.j.issn.1673-713X.2012.03.008
国家高技术研究发展计划(863 计划)(2006AA02Z461)
100050 北京,中国食品药品检定研究院细菌一室
王国治,Email:tbtestlab@vip.tom.com
2012-02-13
Author Affiliation: National Institutes for Food and Drug Control, Beijing 100050, China
·综述·
