阿苯达唑对耐顺铂肺癌细胞糖酵解、细胞周期及细胞凋亡的影响
2012-01-26何迎盈罗治彬李少林
何迎盈,罗治彬,李少林△
(1.重庆医科大学基础医学院核医学教研室 400016;2.重庆市合川区人民医院肿瘤科 401520)
阿苯达唑对耐顺铂肺癌细胞糖酵解、细胞周期及细胞凋亡的影响
何迎盈1,罗治彬2,李少林1△
(1.重庆医科大学基础医学院核医学教研室 400016;2.重庆市合川区人民医院肿瘤科 401520)
目的研究阿苯达唑(ABZ)对人耐顺铂肺癌细胞(A549/DDP细胞)糖酵解、细胞周期及细胞凋亡的影响。方法 用MTT比色法检测ABZ对A549/DDP细胞增殖的影响,求得抑制率为0%、25%、50%、75%所对应的ABZ浓度,并按抑制率将实验分为对照组,25%抑制浓度(IC25)组、半数抑制浓度(IC50)组和75%抑制浓度(IC75)组,每组给予相应浓度的ABZ处理,并按作用时间再将每组分为12、24、36h亚组。按照分组,在设定时间点,用比色法测定己糖激酶(HK)和丙酮酸激酶(PK)活性,酶标仪法测定乳酸脱氢酶(LDH)活性,RT-PCR法测定Akt和Myc mRNA表达,流式细胞仪检测细胞周期和凋亡。结果ABZ抑制了A549/DDP细胞增殖,呈剂量依赖性,抑制率为0%、25%、50%、75%所对应的 ABZ浓度分别为(0.00±0.00)μmol/L、(0.99±0.11)μmol/L、(5.73±0.65)μmol/L、(33.15±3.94)μmol/L。ABZ明显降低了 A549/DDP细胞 HK、PK、LDH 的活性,且下调了Akt和Myc mRNA表达,细胞周期阻滞,凋亡明显。结论ABZ能抑制A549/DDP细胞糖酵解酶活性,下调糖酵解相关基因表达,阻滞细胞周期,诱导细胞凋亡。
阿苯达唑;糖酵解;细胞周期;细胞凋亡;肿瘤细胞,培养的
肿瘤细胞主要靠糖酵解获取能量,其活跃的糖酵解与糖酵解酶的 活化[1-2]、Akt及 Myc基 因 的 激 活 有 关[3-4]。 阿 苯 达 唑是临床常用的抗寄生虫药物,通过抑制寄生虫摄取葡萄糖,降低丙酮酸激酶(prruvate kinase,PK)、乳酸脱氢酶(lactate dehydrogenase,LDH)等活性,阻止三磷腺苷产生,耗竭糖原而杀灭寄生虫。国外学者发现,阿苯达唑(albendazole,ABZ)能阻止肿瘤细胞微管蛋白聚合诱导凋亡[5],还能抑制肿瘤血管形成和乏氧诱导因子-1表达[6-7]。本实验研究ABZ对人耐顺铂肺癌细胞(A549/DDP细胞)糖酵解、细胞周期和生存的影响。
1 材料与方法
1.1 材料
1.1.1 细胞系 A549/DDP细胞株购自中国医学科学院肿瘤细胞库。
1.1.2 主要试剂 胎牛血清和RMPI 1640培养基购自Gibco公司;ABZ购自AccuStandard公司,纯度为97.5%;MTT和二甲基亚砜(DMSO)购自Sigma公司;BCA蛋白浓度测定试剂盒购自碧云天公司;己糖激酶(hexokinase,HK)、PK 和LDH活性测定试剂盒购自南京建成公司;RNA抽提试剂盒、引物、逆转录试剂盒、β-actin、Taq酶均购自Takara公司;Annexin V/PI试剂盒购自BD公司。
1.2 方法
1.2.1 实验分组 A549/DDP细胞接种于96孔板,加入含ABZ终浓度为1、2、4、8、16、32、64、128μmol/L的培养液。每个浓度设3个复孔。培养24h后加入5mg/mL MTT 20μL,4h后加入150μL DMSO,酶标仪490nm处测定吸光OD值,计算细胞增殖抑制率。增殖抑制率(%)=[1―(实验孔OD值―空白对照孔OD值)/(阴性对照孔OD值―空白对照孔OD值)]×100%。按照实验结果,将实验分为对照组、25%抑制浓度(IC25)组、半数抑制浓度(IC50)组和75%抑制浓度(IC75)组。
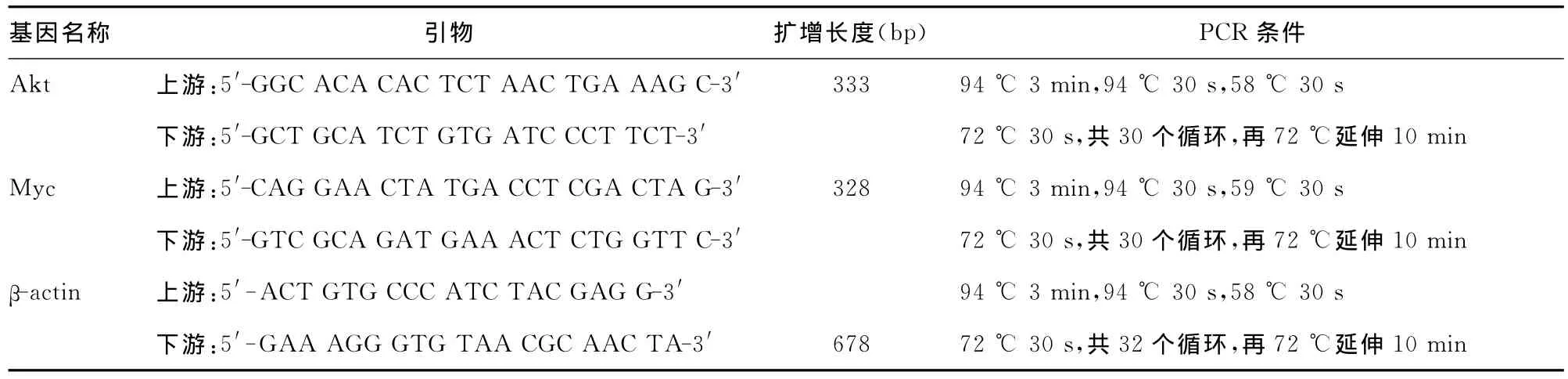
表1 引物序列及PCR反应条件
1.2.2 HK、PK、LDH 活性检测 A549/DDP细胞接种于6孔板,按组加入含 ABZ终浓度为0.0、1.0、5.5、35.0μmol/L的培养液(以下细胞接种和ABZ处理均同此处)。12、24、36 h,用0.25%胰蛋白酶消化并收集细胞,生理盐水漂洗2次后制成0.5mL细胞悬液移至2mL玻璃匀浆管冰上匀浆3min。样本-20℃保存。按BCA蛋白浓度测定试剂盒说明加样,酶标仪562nm处测定吸光度,绘制标准曲线,计算各样本的蛋白浓度。按酶活性测试盒说明加样和处理,分光光度计340nm处测HK和PK的A1和A2值,酶标仪450nm处测LDH吸光值。按说明书计算酶活性,将各组测得的活性与对照组比较,求得相对活性。
1.2.3 半定量 RT-PCR检测 Akt、Myc mRNA表达 ABZ作用12、24、36h,离心弃去培养液,加入磷酸盐缓冲液(phosphate buffer,PBS)轻洗离心两次。用TRIzol法提取总RNA。经Thermo Nanodrop仪检测,提示所获样品无降解和蛋白污染。每个标本以1μg总RNA为模板按逆转录试剂盒说明逆转录合成cDNA。引物序列及PCR反应条件见表1。2%琼脂糖凝胶电泳检测PCR产物,在凝胶成像系统下成像,Quanlity One软件分析灰度值,对比相应内参求出相对灰度值。
1.2.4 细胞周期和细胞凋亡率的流式细胞仪测定 ABZ作用12、24、36h,转移孔内培养基至离心管,PBS轻洗2次孔板并收集清洗液至离心管,胰蛋白酶消化细胞至离心管。室温下,1 000r/min离心3min,弃去上清液。
1.2.4.1 细胞周期检测 加75%乙醇1mL吹打均匀,4℃过夜后离心收集细胞,1mL PBS洗后,加入500μL含50μg/mL的PI、100μg/mL RNase A、0.2%Trion X-100的 PBS溶液,4℃避光孵育30min后上机检测,Modfit软件拟合数据。
1.2.4.2 细胞凋亡率检测 加缓冲液配成1×106/mL的细胞悬液,取100μL至5mL培养管,加PI、Annexin各5μL,避光染色15min,再加缓冲液至400μL后上机检测,CellQuest软件拟合数据。
1.3 统计学处理
所得数据用SPSS18.0软件分析,结果用x±s表示,样本均数的多重比较用单因素方差分析。以P0.05为差异有统计学意义。
2 结 果
2.1 分组实验结果 细胞增殖抑制率0%、25%、50%、75%所对应的 ABZ浓度分别为:(0.00±0.00)μmol/L、(0.99±0.11)μmol/L、(5.73±0.65)μmol/L、(33.15±3.94)μmol/L。因此对照组、IC25组、IC50组和IC75组所对应的ABZ作用浓度分别为:0.0、1.0、5.5、35.0μmol/L,再按 ABZ作用时间将各组分为12、24、36h3个亚组。
2.2 HK、PK、LDH活性检测结果 HK、PK、LDH 活性检测结果见表2。ABZ抑制HK活性有浓度依赖性和时间依赖性。IC75组ABZ抑制PK活性有时间依赖性。ABZ抑制LDH活性呈浓度和时间依赖性。
表2 各组HK、PK、LDH相对活性检测结果(±s)
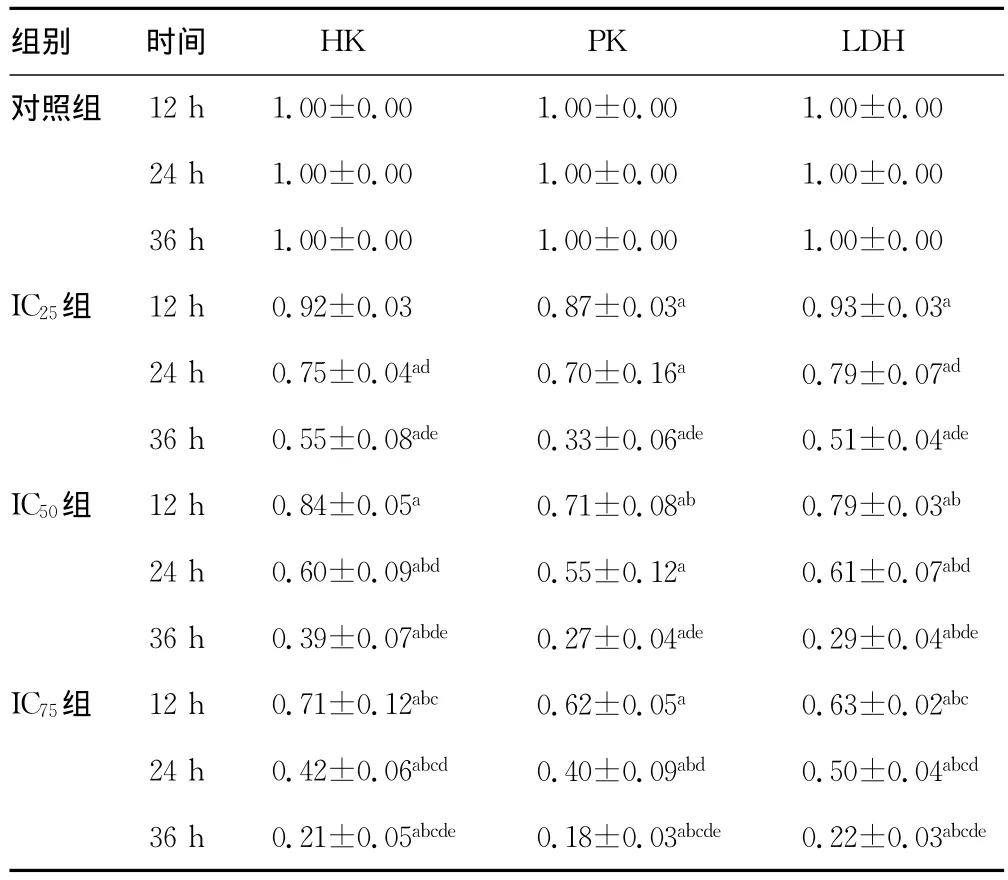
表2 各组HK、PK、LDH相对活性检测结果(±s)
组别 时间HK PK LDH对照组12h 1.00±0.00 1.00±0.00 1.00±0.00 24h 1.00±0.00 1.00±0.00 1.00±0.00 36h 1.00±0.00 1.00±0.00 1.00±0.00 IC25组 12h 0.92±0.03 0.87±0.03a 0.93±0.03a 24h 0.75±0.04ad 0.70±0.16a 0.79±0.07ad 36h 0.55±0.08ade 0.33±0.06ade 0.51±0.04ade IC50组 12h 0.84±0.05a 0.71±0.08ab 0.79±0.03ab 24h 0.60±0.09abd 0.55±0.12a 0.61±0.07abd 36h 0.39±0.07abde 0.27±0.04ade 0.29±0.04abde IC75组 12h 0.71±0.12abc 0.62±0.05a 0.63±0.02abc 24h 0.42±0.06abcd 0.40±0.09abd 0.50±0.04abcd 36h 0.21±0.05abcde 0.18±0.03abcde 0.22±0.03abcde
a:P0.05,与同时间对照组比较;b:P0.05,与同时间IC25组比较;c:P0.05,与同时间IC50组比较;d:P0.05,与同组内12h时比较;e:P0.05,与同组内24h时比较。
表3 各组细胞不同时间Akt、Myc mRNA表达结果(±s)
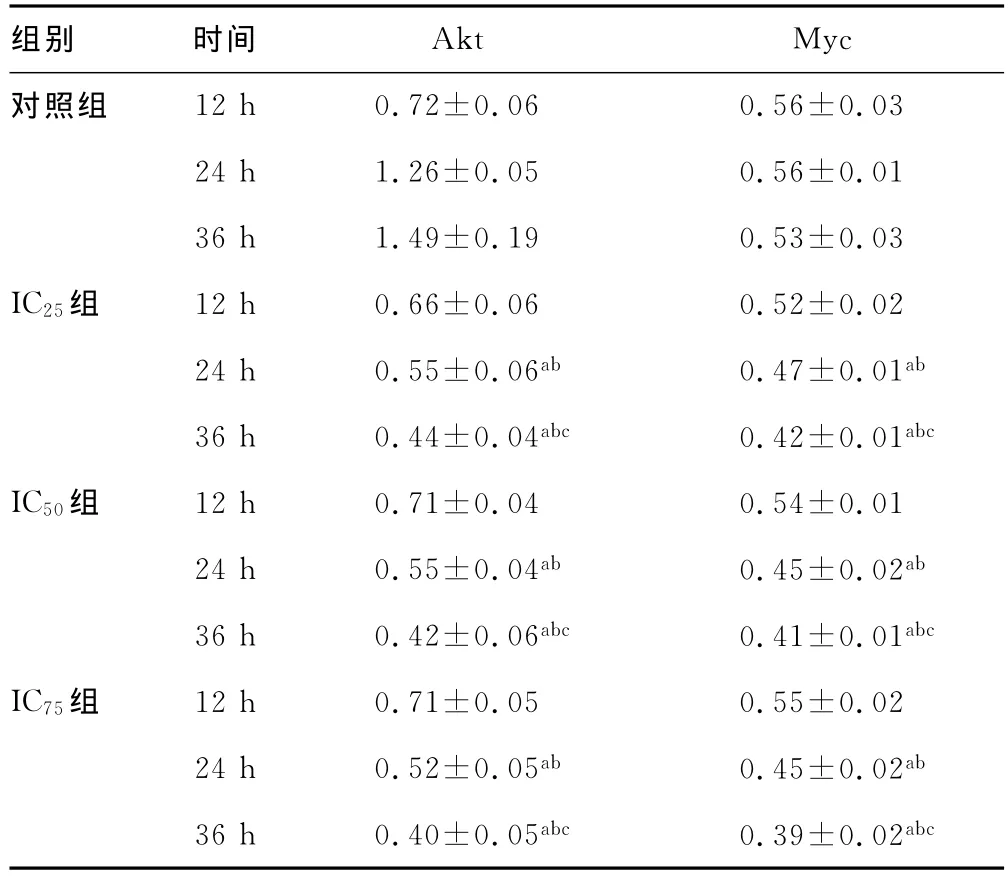
表3 各组细胞不同时间Akt、Myc mRNA表达结果(±s)
组别 时间 Akt Myc对照组12h 0.72±0.06 0.56±0.03 24h 1.26±0.05 0.56±0.01 36h 1.49±0.19 0.53±0.03 IC25组 12h 0.66±0.06 0.52±0.02 24h 0.55±0.06ab 0.47±0.01ab 36h 0.44±0.04abc 0.42±0.01abc IC50组 12h 0.71±0.04 0.54±0.01 24h 0.55±0.04ab 0.45±0.02ab 36h 0.42±0.06abc 0.41±0.01abc IC75组 12h 0.71±0.05 0.55±0.02 24h 0.52±0.05ab 0.45±0.02ab 36h 0.40±0.05abc 0.39±0.02abc
2.3 Akt和Myc mRNA表达结果 作用12h,ABZ不能明显下调Akt、Myc mRNA表达,作用时间延长,两种基因表达水平均明显下降,即ABZ下调作用有时间依赖性,见表3,图1、2。

图1 各组细胞不同时间Akt mRNA的PCR凝胶电泳图
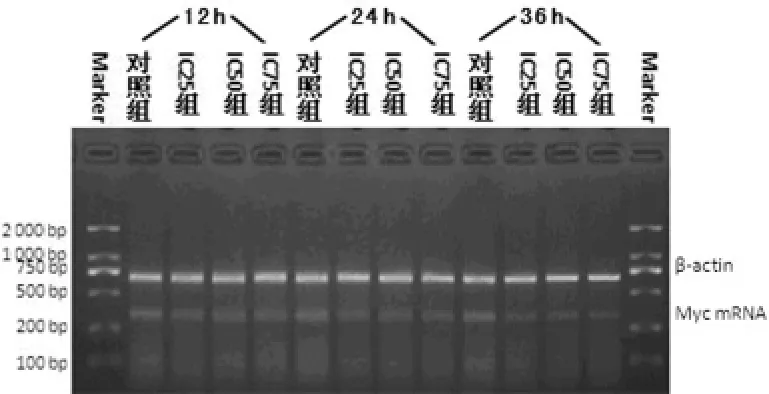
图2 各组细胞不同时间Myc mRNA的PCR凝胶电泳图
2.4 各组细胞不同时间细胞周期和细胞凋亡率比较 各组细胞不同时间细胞周期分布见表4,细胞凋亡率比较见表5。
表4 各组细胞不同时间细胞周期分布(±s,%)

表4 各组细胞不同时间细胞周期分布(±s,%)
a:P0.05,与同时间对照组比较;b:P0.05,与同组内12h时比较;c:P0.05,与同组内24h时比较。
组别 时间 G1期 G2期 S期对照组12h 93.68±1.39 4.81±1.04 1.50±0.46 24h 89.62±1.47 2.36±0.65 8.02±1.08 36h 62.48±1.08 12.48±0.60 25.38±0.74 IC25组 12h 65.01±1.58a 12.46±1.19a 22.53±0.44a 24h 52.98±1.80ab 14.27±1.00a 32.75±1.25ab 36h 12.03±1.18abc 53.09±2.92abc 34.87±2.92abc IC50组 12h 64.97±2.21a 13.50±0.93a 21.53±1.60a 24h 54.65±1.17ab 14.78±0.79a 31.41±1.08ab 36h 11.37±0.92abc 54.51±1.38abc 34.12±2.00a IC75组 12h 65.67±1.42a 13.46±1.23a 20.87±2.62a 24h 54.00±1.06ab 14.06±0.66a 31.94±1.68a 36h 10.38±1.06abc 54.52±2.15abc 35.10±3.18ab
表5 各组细胞不同时间细胞凋亡率比较(±s,%)

表5 各组细胞不同时间细胞凋亡率比较(±s,%)
分组 时间 晚期凋亡细胞比例 正常细胞比例 早期凋亡细胞比例对照组12h 1.28±0.18 94.39±0.69 1.95±0.10 24h 0.58±0.11 94.87±0.80 2.61±0.25 36h 1.53±0.33 93.23±1.23 2.54±0.37 IC25组 12h 3.52±0.44 85.39±1.64a 5.71±0.86a 24h 5.46±0.45ad 78.19±1.84ad 9.74±1.25ad 36h 10.27±1.37ade 72.30±1.71ade 9.80±1.10ad IC50组 12h 8.71±0.92ab 77.78±1.31ab 7.78±0.38ab
续表5 各组细胞不同时间细胞凋亡率比较(±s,%)
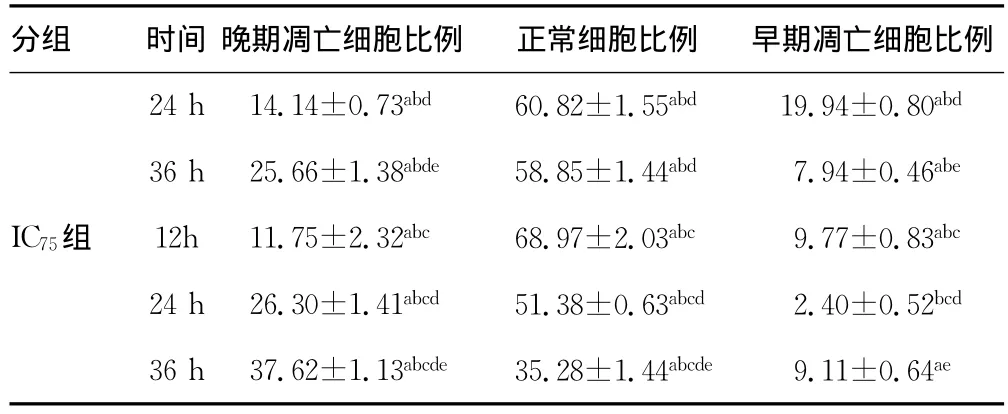
续表5 各组细胞不同时间细胞凋亡率比较(±s,%)
a:P0.05,与同时间对照组比较;b:P0.05,与同时间IC25组比较;c:P0.05,与同时间IC50组比较;d:P0.05,与同组内12h时比较;e:P0.05,与同组内24h时比较。
分组 时间 晚期凋亡细胞比例 正常细胞比例 早期凋亡细胞比例24h14.14±0.73abd 60.82±1.55abd 19.94±0.80abd 36h25.66±1.38abde 58.85±1.44abd 7.94±0.46abe IC75组 12h11.75±2.32abc 68.97±2.03abc 9.77±0.83abc 24h26.30±1.41abcd 51.38±0.63abcd 2.40±0.52bcd 36h37.62±1.13abcde 35.28±1.44abcde 9.11±0.64ae
3 讨 论
大部分学者认为肿瘤细胞活跃的糖酵解代谢与肿瘤细胞线粒体功能障碍[8],酶谱改变,尤其是糖酵解关键酶活性增加和同工酶谱改变有关。HK是肿瘤细胞糖酵解的限速酶,它在肿瘤细胞中活性明显增加,从而保证肿瘤细胞生长和增殖所需要的能量及物质[9]。PK是糖酵解的第2个关键酶,它的活性不依赖于氧含量,它与ATP净生成增加有关,从而保证了肿瘤细胞在低氧环境中也能生存[10]。LDH催化糖酵解产物变为乳酸,酸化微环境,有利于肿瘤生存与生长[11]。另外,在糖酵解过程中,Akt基因和 Myc基因也发挥了重要作用。Akt基因刺激肿瘤细胞选择有氧糖酵解,且使肿瘤细胞依赖糖酵解生存和生长[12]。Myc基因能够直接上调GLUT-1和LDH的表达,促进葡萄糖摄取和加强葡萄糖转化为乳酸[13]。
肺癌的发病率和病死率极高[14],耐药是临床面临的难题。糖酵解与肿瘤恶性程度及耐药相关[15-16]。抑制糖酵解,阻断能量来源,可杀死肿瘤细胞[17-20]。
本实验中,A549/DDP细胞PK和LDH活性非常高,糖酵解相当活跃,这可能与其高度恶性及耐药有关。ABZ作用后,HK、PK、LDH活性明显降低,Akt、Myc基因的表达明显下调,细胞周期阻滞在G2和S期,凋亡明显。
ABZ作为安全有效且价格低廉的临床用药,抗肿瘤的作用机制广泛。微管蛋白是ABZ的主要靶分子,但通过抑制微管蛋白聚合诱导肿瘤细胞凋亡,非ABZ抗肿瘤的惟一机制[21]。通过本实验,可以看出,ABZ对耐药肿瘤细胞仍具有较强的抗肿瘤活性,可能与它抑制糖酵解,切断肿瘤的能量来源有关。作为一种经济、有效、低毒的临床用药,在肿瘤基础研究中,发现了ABZ抑制肿瘤细胞糖酵解,诱导肿瘤细胞凋亡的新用途,希望经过深入研究后,能使ABZ运用到临床肿瘤治疗中,给肺癌患者带来福音。
[1] Hsu PP,Sabatini DM.Cancer cell metabolism:warburg and beyond[J].Cell,2008,134(5):703-707.
[2] Luo W,Semenza GL.Pyruvate kinase M2regulates glucose metabolism by functioning as a coactivator for hypoxia-inducible factor 1in cancer cells[J].Oncotarget,2011,2(7):551-556.
[3] Robey RB,Hay N.Is Akt the“warburg kinase”?——Akt-energy metabolism interactions and oncogenesis[J].Semin Cancer Biol,2009,19(1):25-31.
[4] Dang CV.Rethinking the warburg effect with Myc micromanaging glutamine metabolism[J].Cancer Res,2010,70(3):859-862.
[5] Chu SW,Badar S,Morris DL,et al.Potent inhibition of tubulin polymerisation and proliferation of paclitaxel-resistant 1A9PTX22human ovarian cancer cells by albendazole[J].Anticancer Res,2009,29(10):3791-3796.
[6] Pourgholami MH,Cai ZY,Wang L,et al.Inhibition of cell proliferation,vascular endothelial growth factor and tumor growth by albendazole[J].Cancer Invest,2009,27(2):171-177.
[7] Pourgholami MH,Cai ZY,Badar S,et al.Potent inhibition of tumoral hypoxia-inducible factor 1alpaha by albendazole[J].BMC Cancer,2010,10(7):143-148.
[8] Wu M,Neilson A,Swift AL,et al.Multiparameter metabolic analysis reveals a close link between attenuated mitochondrial bioenergetic function and enhanced glycolysis dependency in human tumor cells[J].Am J Physiol Cell Physiol,2007,292(1):C125-136.
[9] Marín-Hernández A,Rodríguez-Enríquez S,Vital-González PA,et al.Determining and understanding the control of glycolysis in fast-growth tumorcells.Flux control by an over-expressed but strongly product-inhibited hexokinase[J].FEBS J,2006,273(9):1975-1988.
[10]Mazurek S,Boschek CB,Hugo F,et al.Pyruvate kinase type M2and its role in tumor growth and spreading[J].Semin Cancer Biol,2005,15(4):300-308.
[11]Fantin VR,St-Pierre J,Leder P.Attenuation of LDH-A expression uncovers a link between glycolysis,mitochondrial physiology,and tumor maintenance[J].Cancer Cell,2006,9(6):425-434.
[12]Elstrom RL,Bauer DE,Buzzai M,et al.Akt Stimulates Aerobic Glycolysis in Cancer Cells[J].Cancer Res,2004,64(11):3892-3899.
[13]Osthus RC,Shim H,Kim S,et al.Deregulation of glucose transporter 1and glycolytic gene expression by c-My[J].J Biol Chem,2000,275(29):21797-21800.
[14]Siegel R,Ward E,Brawley O,et al.Cancer statistics,2011:the impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer J Clin,2011,61(4):212-236.
[15]Sattler UG,Mueller-Klieser W.The anti-oxidant capacity of tumour glycolysis[J].Int J Radiat Biol,2009,85(11):963-971.
[16]Milane L,Duan Z,Amiji M.Role of hypoxia and glycolysis in the development of multi-drug resistance in human tumor cells and the establishment of an orthotopic multidrug resistant tumor model in nude mice using hypoxic pre-conditioning[J].Cancer Cell Int,2011,11(4):3-12.
[17]Gatenby RA,Gillies RJ.Glycolysis in cancer:apotential target for therapy[J].Int J Biochem Cell Biol,2007,39(7/8):1358-1366.
[18]Kim W,Yoon JH,Jeong JM,et al.Apoptosis-inducing antitumor efficacy of hexokinaseⅡinhibitor in hepatocellular carcinoma[J].Mol Cancer Ther,2007,6(9):2554-2562.
[19]Le A,Cooper CR,Gouw AM,et al.Inhibition of lactate dehydrogenase A induces oxidative stress and inhibits tumor progression[J].Proc Natl Acad Sci USA,2010,107(5):2037-2042.
[20]Priebe A,Tan L,Wahl H,et al.Glucose deprivation activates AMPK and induces cell death through modulation of Akt in ovarian cancer cells[J].Gynecol Oncol,2011,122(2):389-395.
[21]Sebastian M.Review of catumaxomab in the treatment of malignant ascites[J].Cancer Manag Res,2010,2:283-286.
Effects of albendazole on glycolysis,cell cycle and cell apoptosis of cisplatin-resistant lung cancer cells
ObjectiveTo investigate effect of albendazole(ABZ)on glycolysis,cell cycle and cell apoptosis of human cisplatin-resistant lung cancer cells(A549/DDP cells).MethodsEffect of ABZ on proliferation of A549/DDP cells was detected by methyl thiazolyl tetrazolium(MTT)colorimetry,then according to inhibition concentrations(IC)of 0%,25%,50%,75%to devide cells into 4 groups-control group,IC25group,IC50group,IC75group,moreover,based on ABZ action time to invide every group into 12,24and 36hsub-groups.At the setting points of action time,activitie of hexokinase(HK),pyruvate kinase(PK),dehydrogenase(LDH)were detected by colorimetry and ELIASA,expression of Akt and Myc mRNA were detected by RT-PCR,cell cycle and cell apoptosis were detected by flow cytometry(FCM).ResultsABZ inhibited proliferation of A549/DDP cells in a dose-dependent manner,IC0,IC25,IC50and IC75respectively were(0.00±0.00)μmol/L,(0.99±0.11)μmol/L,(5.73±0.65)μmol/L,(33.15±3.94)μmol/L.The activity of LDH,HK and PK of test groups decreased,expression of Akt mRNA and Myc mRNA was downregulated.Cell cycle was blocked,apoptosis was obvious.ConclusionABZ can inhibit activity of glycolytic enzymes and expression of glycolysis-related genes,block cell cycle and induce apoptosis in vitro.
albendazole;glycolysis;cell cycle;apoptosis;tumor cells,cultured
10.3969/j.issn.1671-8348.2012.18.009
A
1671-8348(2012)18-1811-04
△通讯作者,E-mail:nescafe_1985@126.com。
2011-12-07
2012-02-22)
•论 著•
