泻肺逐饮汤对恶性胸水大鼠胸水及胸膜组织中TGF-β1的影响*
2012-01-23李竹英王晶波刘建秋
李竹英 王 珏 王晶波 刘建秋
(黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
恶性胸水是泛指恶性肿瘤的胸膜转移或胸膜自身恶性肿瘤所致的胸腔积液,是癌症晚期的一种常见并发症[1],严重影响患者生活质量。本研究通过观察泻肺逐饮汤联合力尔凡对恶性胸水大鼠胸水及胸膜组织中转化生长因子(TGF)-β1的影响,探讨了泻肺逐饮法防治恶性胸水的作用机理,为进一步的临床应用提供理论和实验依据。
1 材料与方法
1.1 动物 Wistar清洁级大鼠100只,雌雄各半,购自哈尔滨医科大学第二附属医院实验动物中心,体质量(220±20)g。大鼠雌雄分笼于室温约23℃,黑夜和白昼各12 h的环境中,适应性喂养3 d后进行造模。
1.2 药物 泻肺逐饮汤:由葶苈子、党参、生黄芪、薏苡仁、山慈菇、桂枝、白术、茯苓、椒目、甘草组成。上药以常温常压煎药机煎煮而成,黑龙江中医药大学附属第一医院制剂室提供。力尔凡:吉林省一心制药有限公司生产,批号10970426,规格:10 mg/支,以生理盐水按1∶1比例稀释。
1.3 试剂及瘤株 艾氏腹水瘤(EAC)细胞株,购自南京康克诺德实验动物有限责任公司。石蜡、4%多聚甲醛、乙醇、苏木精、伊红等,均由黑龙江中医药大学附属第一医院病理科提供。兔抗大鼠TGF-β1免疫组化试剂盒:购自北京中山生物技术有限公司。生物素化山羊抗兔IgG(H+L):购自北京中杉金桥生物技术有限公司。辣根酶标记链亲和素:购自上海研域化学试剂有限公司。显色剂DBA:购自福州迈新生物技术有限公司。乌拉坦,北京通州育才精细化工厂,批号980922。
1.4 仪器 光学显微镜:OLYMPUS光学工业株式会社,型号:OLYMPUSU-LBD-2;超净工作台:苏州安泰空气净化有限公司,型号:SW-CJ-Fl;石蜡包埋机:沈阳龙首电子仪器有限公司,型号:L-100;石蜡切片机:德国SLEE公司;超低温冰箱:日本三洋公司,型号:MDF-328;恒温箱:Eppendorf德国;电子天平:JA1003,Pharmacia Bioteeh,Britain。
1.5 分组与造模 将100只大鼠随机分为正常对照组、模型组、中药组、力尔凡组、联合用药组共5组,每组20只。参照文献[2]方法改进。艾氏腹水癌细胞株每周传代1次,取荷瘤7 d的Wistar大鼠,抽取小量腹水,置于消毒的干试管内,镜下进行细胞分类计数。以生理盐水调整细胞浓度,用细胞计数板计数肿瘤细胞浓度至5×107/mL。用台盼蓝拒染法检测细胞存活性,提示活细胞数>95%时,再抽取腹水放入无菌容器内,置冰块上保存,以上法稀释调整细胞浓度至1×108/mL。大鼠以25%乌拉坦麻醉后,将大鼠右侧背部用刮刀脱毛,局部常规消毒,用穿刺针自大鼠右侧腋后线与第11、12肋间交点处垂直刺入,当针头刺入胸膜腔时感觉有落空感后注入0.3 mL上述肿瘤细胞悬液。共造模80只。正常对照组用同样方法胸腔注射生理盐水0.3 mL。
1.6 给药方法 正常对照组及模型组:予3 mL生理盐水灌胃,每日1次。中药组:按生药量16.14 g/(kg·d)灌胃泻肺逐饮汤,每日 1次。 力尔凡组:力尔凡用生理盐水 1∶1稀释,按 1 mg/(kg·d),于造模后1、3、5、7 d,腹腔注射。联合用药组:按生药量16.14 g/(kg·d)灌胃泻肺逐饮汤,并予力尔凡以生理盐水 1∶1稀释,按1 mg/(kg·d),于造模后 1、3、5、7 d,腹腔注射。 各组给药时间均为7 d。
1.7 标本采集与检测 在造模后的第8日,将大鼠以25%乌拉坦麻醉后,颈动脉放血处死,每组处死12只。(1)大鼠恶性胸腔积液的采集:以75%乙醇消毒后切开皮肤,在胸前区右侧第9肋间隙处以眼科镊钝性分离胸肌达胸腔内,游离膈肌腹面,小心地暴露右侧胸腔,自膈肌腹面向右侧胸腔进针,用5 mL注射器尽量抽取胸腔积液。观察胸腔积液外观,并记录各组大鼠胸腔积液量,精确到0.1 mL。同时每只鼠收集2 mL胸液,以4℃、2500 r/min离心15 min,取上清液置于4℃恒温箱内保存待测。(2)大鼠胸膜组织的采集:处死大鼠后,剪开右侧胸腔,剪取壁层胸膜,固定于4%多聚甲醛固定液中,常规脱水,石蜡包埋,切成4 μm厚的切片,苏木素-伊红(HE)染色,光镜下观察组织形态学改变。组织标本制作固定后72 h内进行免疫组织化学染色法检验。
1.8 统计学处理 应用SPSS18.0统计软件。计量资料以(±s)表示,等级资料采用χ2检验;组间比较用多样本方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠胸水TGF-β1免疫组化结果 见表1。正常对照组大鼠胸水TGF-β1少量表达,各治疗组胸水中癌细胞间质上均有表达。
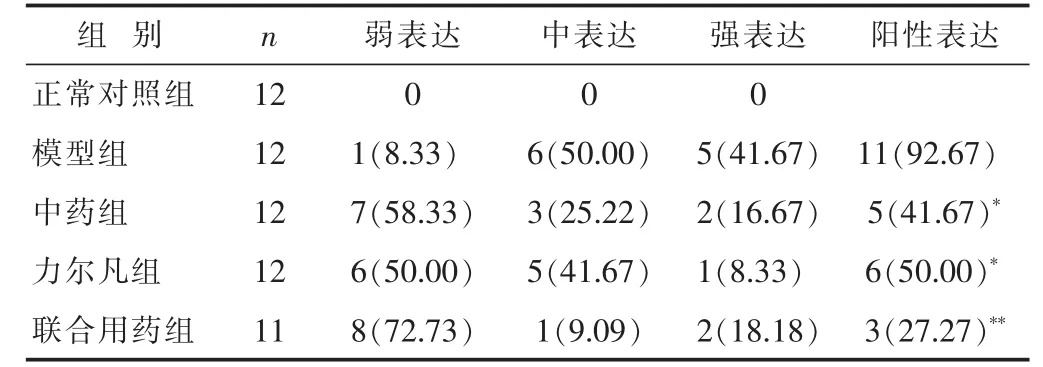
表1 各组大鼠胸水TGF-β1免疫组化结果比较n(%)
2.2 各组大鼠胸膜组织TGF-β1免疫组化结果 见表2。正常对照组大鼠胸膜组织TGF-β1少量表达,各治疗组胸膜中癌细胞均有表达。
表2 各组大鼠胸膜TGF-β1免疫组化结果比较(±s)
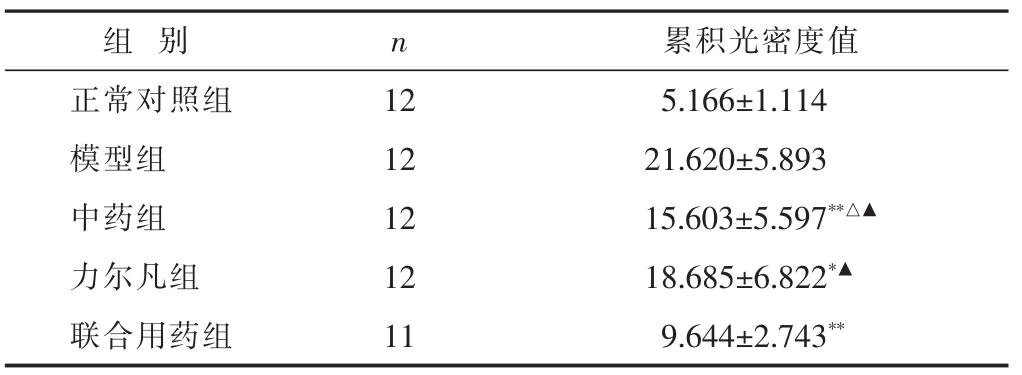
表2 各组大鼠胸膜TGF-β1免疫组化结果比较(±s)
与力尔凡组比较,△P<0.05;与联合用药组比较,▲P<0.01。
组 别正常对照组n 12累积光密度值5.166±1.114模型组 12 21.620±5.893中药组 12 15.603±5.597**△▲力尔凡组 12 18.685±6.822*▲联合用药组 11 9.644±2.743**
3 讨 论
TGF-β是一组具有多种调节功能的细胞因子,对细胞的生长、分化、凋亡、细胞外基质合成和免疫反应等有着广泛影响[3]。TGF-β1对肿瘤细胞的生长具有双向调节作用。肿瘤早期,TGF-β1能够抑制c-myc基因表达的,使肿瘤细胞的生长停滞在G1期,而在肿瘤的晚期,由于机体对TGF-β1反应性降低,从而促进肿瘤细胞过度生长,TGF-β1对于T细胞的免疫抑制作用,也造成了肿瘤细胞的免疫逃逸。加之,TGF-β1可以促进肿瘤血管的形成,促进了肿瘤的过度生长。研究表明,TGF-β1还是一种致纤维化因子,可以促进胸膜组织的纤维化[4]。
本实验结果显示:模型组大鼠胸水中TGF-β1含量高于各治疗组,与中药组、力尔凡组、联合用药组比较差异显著(P<0.05或0.01);力尔凡组、中药组与联合用药组比较无差异(P>0.05)。模型组大鼠胸膜组织中TGF-β1含量高于各治疗组,与中药组和联合用药组比较有显著差异(P<0.01);中药组含量低于力尔凡组(P<0.05);联合用药组含量明显低于中药组和力尔凡组(P<0.01)。模型组大鼠胸水和胸膜组织中的TGF-β1含量高,提示了在恶性胸腔积液和组织中TGF-β1出现高表达,证实了TGF-β1对晚期的恶性肿瘤具有促进作用。而泻肺逐饮汤能够降低胸水和胸膜组织中的TGF-β1含量,说明泻肺逐饮汤能降低恶性肿瘤组织TGF-β1的表达,从而抑制肿瘤的生长和转移。
[1]Sahn SA.Management of malignant pleural effusions[J].Monaldi Arch Chest Dis,2001,56(5):394-399.
[2]蒋鹏娜.逐饮I号对恶性胸水大鼠血清TUM2-PK和胸膜组织bFGF 的影响[D].哈尔滨:黑龙江中医药大学,2008:26.
[3]Scott A,Sasse-Martin RJ,Gary DK.Pleural fluidtransforming growth factor-beta1 correlates with pleural fibrosis in experimental empyema[J].Am J Respir Crit Care Med,2003,168(6):700.
[4]Chen CH,Seguin-Devaux C,Burke NA,et al.Transforming growth factor beta blocks Tec kinase phosphorylation,Ca2+influx,and NFATc translocation causing inhibition of T cell differentiation[J].J Exp Med,2003,197(12):1689-1699.
