在大鼠创伤性脑损伤模型中神经干细胞移植对突触素表达的影响
2011-12-15马海英马学虎石玉秀
马海英 喻 博 关 水 马学虎 石玉秀
在大鼠创伤性脑损伤模型中神经干细胞移植对突触素表达的影响
马海英1,3喻 博2关 水4马学虎4石玉秀1*
(1中国医科大学组织学与胚胎学教研室,病理学与病理生理学研究所,沈阳110001;2中国医科大学附属盛京医院神经外科,沈阳110004;3大连医科大学组织学与胚胎学教研室,辽宁116044;4大连理工大学干细胞与组织工程研发中心,辽宁116024)
目的 探讨神经干细胞(NSCs)移植对创伤性脑损伤(TBI)模型大鼠感觉运动功能的恢复作用及其对损伤脑组织中突触素(SYP)表达的影响。方法 体外培养大鼠胚胎皮质NSCs;采用Feeney法制备TBI模型,于造模后72 h,移植组采用PKH26荧光示踪剂标记的NSCs直接移植于脑损伤区,对照组以等量生理盐水代替NSCs;分别于移植后不同时间点,采用Grid walk和Latency试验检测TBI大鼠的感觉运动功能;荧光显微镜下计数移植细胞的存活数量;采用免疫印迹和RTPCR技术检测脑损伤区及周围组织中SYP的表达。结果 NSCs移植大鼠前、后肢功能分别在移植后第2 w和4 w恢复至手术前水平,而直到第8 w,对照组大鼠后肢功能和通过平板移动时间与NSCs移植组和基线比较仍有显著性差异(P<0.05)。移植的NSCs随移植时间延长存活数量减少,移植后第4 w和8 w的存活数分别为6.3%±1.0% 和4.1%±0.9%。在移植后的8 w期间,移植组脑损伤区及周围组织中SYP的表达均明显高于对照组(P<0.05)。结论 移植的NSCs在TBI脑内能够存活,并明显改善了TBI大鼠对侧肢体的感觉运动功能;NSCs移植促进了脑损伤区及周围组织中SYP的表达,这可能是NSCs移植促进功能恢复的机理之一。
神经干细胞;移植;创伤性脑损伤;突触素
创伤性脑损伤(Trau matic Brain Inj ury,TBI)是指由外伤引起的脑组织损伤。在美国,每年大约170万人发生TBI,是损伤致死的主要原因之一,也是儿童和青少年致残的主要原因之一[1]。随着现代医疗技术的不断发展,对TBI的治疗已经取得了很大的进展。然而,临床上治疗TBI失败的主要原因可能是由原发损伤引起的二次损伤[2]。严重的脑损伤产生不同程度的功能缺陷,甚至导致永久性残疾或植物人。目前,对TBI缺乏有效的治疗措施来恢复患者由损伤引起的各种功能缺陷。
神经干细胞(Neural stem cells,NSCs)的特征和成功分离培养使直接移植这些细胞治疗脑损伤成为可能。研究表明,在发育期胚胎和成年哺乳类动物的中枢神经系统存在着具有多向分化潜能的神经干细胞。神经干细胞在胚胎脑的端脑、小脑、海马、纹状体、大脑皮质、脑室/脑室下区、室管膜/室管膜下区、脊髓等处分布广泛[3]。在成年哺乳动物,神经干细胞主要分布在侧脑室的脑室下区(subvent ricular zone,SVZ)和海马的颗粒下带(subgranular zone,SGZ),具有分化为神经元和神经胶质细胞的潜能,并能向损伤区定向移动,在不同的微环境中分化为不同细胞[4]。NSCs在促分化因子的作用下可以在体外定向分化发育成神经元和神经胶质细胞的研究,使中枢神经系统损伤修复出现了新的希望。国外实验研究证明,通过NSCs移植替代治疗可能实现修复中枢神经系统损伤或疾病引起的组织损伤并部分恢复由损伤引起的功能缺陷。其机制除细胞代替治疗作用外,可能与神经营养因子释放、细胞与细胞间信号传导等有关[5,6]。NSCs移植治疗中枢神经系统损伤恢复受损功能的机制尚不完全清楚。
突触素(Synaptophysin,SYP)是突触前神经末梢的标志蛋白,能够与其它的蛋白相互作用,具有调节神经递质释放,突触小泡融合、突触形成和能量代谢等广泛作用。因为突触的丢失与脑功能障碍的程度有 关[7-9],SYP 的 水 平也 作 为脑 的 功 能 性 标志[10]。
本研究采用荧光示踪剂PKH26标记NSCs,移植于TBI模型大鼠脑内,观察其存活及其对损伤脑组织中SYP表达的影响,探讨了NSCs移植TBI恢复感觉运动功能可能的机制。
材料和方法
1.实验材料
1.1 实验动物
E14 Wister大鼠胚胎15只,150-200g Wister大鼠60只,雌雄各半,由大连医科大学实验动物中心提供。
1.2 主要试剂
PKH26、DMEM/F12、B27、EGF和b FGF培养基(Sig ma公司);抗鼠巢蛋白单克隆抗体,兔抗鼠βⅢ-微管蛋白多克隆抗体(SANTA CRUZ公司)。FBS(Invitrogen);Accutase T M 酶(eBioscience)。
2.方法
2.1 NSCs的培养、体外分化
原代培养的NSCs由大连理工大学干细胞与组织工程研发中心提供。将原代培养的NSCs以2×105/ml的密度接种于50 ml培养瓶中,培养条件为6 ml DMEM/F12 培养基(含 B27、EGF、b FGF),37℃,5%CO2,每6-7d传代1次,传3-10代备用。采用多聚鸟氨酸处理无菌盖玻片,置于24孔板中,用含10%FBS的培养基对传代培养的NSCs进行体外诱导分化。
2.2 免疫细胞化学检测
分别采用巢蛋白和βⅢ-微管蛋白进行免疫细胞化学染色鉴定NSCs和分化细胞中的神经元表型。细胞经4%多聚甲醛固定,0.3%Triton X-100孵育,非免疫血清孵育。分别滴加鼠抗巢蛋白单克隆抗体(1∶200)和兔抗鼠βⅢ-微管蛋白多克隆抗体(1∶200),4℃过夜,PBS漂洗3次,每次5 min。分别滴加 羊 抗 小 鼠 Texas-Red和 羊 抗 兔 FITC-Ig G(1∶1000),37℃避光孵育30 min。DAPI复染细胞核,封片,荧光显微镜下观察。
2.3 创伤性脑损伤模型制备
采用改良的Feeney法制备创伤性脑损伤模型[11]。将60只成年 Wister大鼠,以10%水合氯醛按40 mg/kg剂量腹腔注射麻醉,麻醉后固定于立体定向仪上,切开头皮,分离皮下组织及骨膜。在前囟后3 mm,矢状缝左3 mm处用颅钻钻取直径约为3 mm的骨窗,保持硬脑膜的完整。采用改良的打击装置,以10g砝码从30c m高处自由坠落,撞击该处硬脑膜,造成颅脑挫裂伤。
2.4 PKH26示踪剂标记NSCs
移植前收集NSCs,加入Accutase T M酶,制备成单细胞悬液。PKH26染色方法按说明书进行。染色体系中PKH26和NSCs的浓度分别为4×10-6 M和1×107/ml。用生理盐水重悬NSCs,终浓度为1×108/ml,置于冰上备用。
2.5 动物分组与NSCs移植
造模后72h,将动物再次麻醉,固定于立体定位仪上,暴露创伤灶,实验组36只,对照组24只,实验组在创伤灶中心,用微量注射泵将3μL PKH26标记的NSCs悬液注入硬脑膜下1.1 mm处,注射10分钟,停留5分钟后拔出注射器。对照组注射等量生理盐水。以后动物常规饲养。每组动物分别于移植后1d、4d、7d,2 w、4w、8w 取材,用于移植细胞计数、免疫印迹和RT-PCR检测。
2.6 神经行为学检查
Grid wal k试验和latency试验[12]广泛的应用于多种中枢神经系统损伤性疾病的感觉运动功能检测。Grid wal k试验装置为64c m×40c m×50c m(长×宽×高)方格网,网孔面积为25 mm×25 mm。方格网的下方放置录像机,用以记录试验动物5分钟内失足次数和总移步次数。% 失步= (失步次数/总移步次数)×100,不对称分值= (% 对侧失步-%同侧失步).失足规定为瘫侧任一肢体不能抓紧格线而导致足落于网格以下或踏空者。
Latency试验装置是30c m×10 c m(长×宽)的平板放置在100 c m高处,将动物放与平板的一次,记录动物通过平板时间,每次检测每只动物试验3次,取平均值。造模前,所有动物接受训练3d,以获得稳定的基线水平,并分别于移植后1d和移植后1 w、2 w、4 w和8 w检查。
2.7 细胞存活计数
分别于不同时间点,动物麻醉后,4%多聚甲醛灌流固定,取全脑,后固定过夜,行全脑冰冻切片。于荧光显微镜下观察NSCs的存活数。200倍镜下,每10张切片计数1张PKH26标记的NSCs(自前囟前1 mm至前囟后4 mm),每只动物计数细胞数×10作为该动物存活细胞数。
2.8 免疫印迹分析
取脑损伤区及周围组织,提取总蛋白。于12%的SDS-PAGE凝胶中电泳分离蛋白,转移法(转膜条件:100 V 3h)将蛋白质从SDS-PAGE凝胶转移至硝酸纤维素(NC)膜,在含5%脱脂奶粉的TBS中室温封闭1h,加入抗鼠SYP单克隆抗体(1∶200),4℃孵育过夜,TBS充分漂洗(10 min×3次),加入HRP标记的羊抗鼠Ig G(1∶2000),室温作用1 h,TBS充分漂洗(10 min×3次),ECL显影,暗室曝光成像。Smartview凝胶成像系统分析条带灰度值。
2.9 RT-PCR 分析
采用异硫氰酸胍-酚-氯仿(TRIzol)两步法提取脑损伤区及周围组织中的总RNA,逆转录为c DNA。PCR反应条件:94℃3分钟预变性;98℃10秒,50℃15秒,72℃1分钟,共30个循环;72℃ 延伸10分钟。PCR引物由宝生物工程(大连)有限公司合成,SYP上游引物:5’-CGATGCGGGCTATGGGCAGG-3’,下游引物:5’-AGTCGCCCTGAGGCCCGTAG-3’,内参照 GAPDH 上游引物:5’-TGTGATGGGTGTGAACCACGAGA-3’;下游引物:5’-GAGCCCTTCCACAATGCCAAAGTT-3’。取2μL PCR产物在1%琼脂糖凝胶中进行电泳,在凝胶成像系统下成像,用Image Master ED软件计算各电泳条带的强度值,以目的基因条带和内参照基因条带的强度之比(SYP/GAPDH)为目的基因mRNA表达的相对值,据此相对值,即可判断各样品中SYP mRNA表达程度的差异。
3.统计学分析
采用SPSS 11.0统计软件分析,计量数据以均数±标准差表示,组间比较采用t检验,P<0.05为差异有统计学意义。
结 果
1.NSCs培养与鉴定在培养基中,NSCs呈球团状悬浮生长,巢蛋白表达阳性(图1 A,B)。用含10%FBS的培养基对NSCs进行体外诱导分化,发现分化后第2天,多数细胞伸出突起,以后突起逐渐延长,分支增加。分化后第5天,βⅢ-微管蛋白阳性细胞为13.9±6.3%(图1C,1D)。
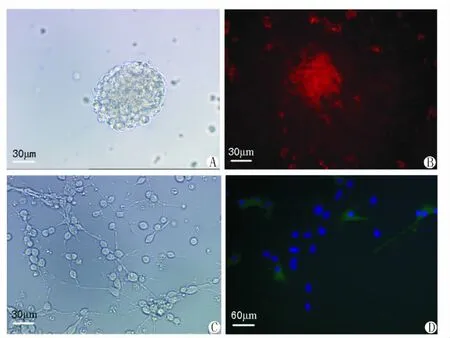
图1 NSCs的培养、分化与鉴定结果A:第10代NSCs球;B:NSCs球巢蛋白染色阳性;C:诱导分化后第5d,NSCs发生分化;D:βⅢ-微管蛋白免疫反应阳性细胞(DAPI复染细胞核)。Fig.1 Culture,differentiation and identification of NSCs A:NSCs neurosphere;B:NSCs neurospheres were Nestin positive;C:NSCs were differentiated f or 5 days;D:βⅢ-t ubulin positive cells for neurons in differentiated NSCs(nuclei were identified by a blue DAPI counterstain).
2.神经行为学检测
所有动物TBI损伤后均表现出明显的运动功能障碍。NSCs移植组和对照组前后肢功能均随时间延长而出现好转。在Grid wal k试验中,NSCs移植组前后肢功能分别在移植后第2w和4w恢复至手术前水平。而对照组前、后肢表现出更明显的对侧肢体障碍,前肢功能直到第8 w恢复至基线水平。T-检验结果表明,至少4 w内对照组前肢不对称分值明显高于移植组(P<0.05)。尽管在第1w后肢功能在两组之间没有显著性差异,但在第8 w,对照组后肢功能与移植组和基线水平比较,均有明显差异(图2 A,2B)。在Latency试验中,在8 w内对照组通过平板的移动时间均明显长于NSCs移植组(P<0.05),而移植组的移动时间于第2 w恢复至手术前水平 (图2C)。
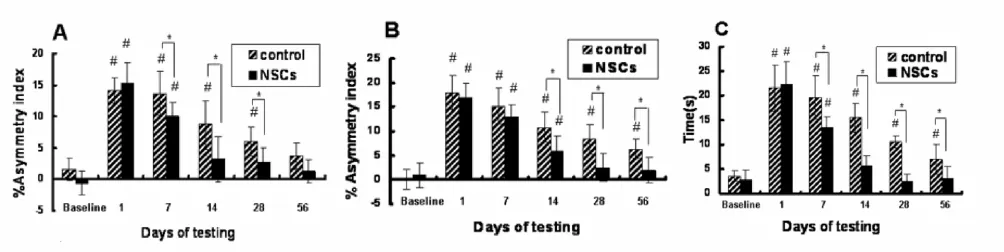
图2 神经行为学检测A:前肢不对称分值;B:后肢不对称分值;C:Latency试验。Fig.2 Behavioral f unctional tests A:foreli mb asy mmetry differences;B:hindli mb asy mmetry differences;C:Latency to move
3.NSCs移植后在脑内的存活
CCI损伤造成实验大鼠左侧皮质及同侧海马发生明显的细胞丢失。在荧光显微镜下观察,对照组未见红色荧光细胞,在NSCs移植组,PKH26标记的NSCs被激发出红光。对PK H26标记的NSCs进行计数发现,实验期间存活细胞逐渐减少(图3 A-G)。移植后第4d,细胞存活数为第1d的41%。在移植后第4 w和第8 w,细胞存活数量分别为移植细胞数的6.3%±1.0% 和4.1%±0.9%。
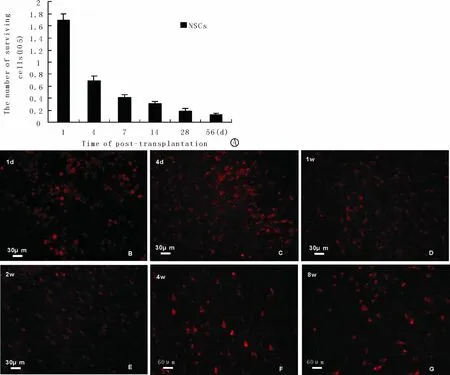
图3 移植后不同时间点,移植NSCs的存活数 可见移植细胞存活数随移植时间延长而减少。自移植后第2 w,移植细胞从胞体伸出明显的突起。Fig.3 Survival of cortical NSCs at different ti me points post-transplantation There was a significantly reduction in the nu mber of survival cells during experi mental period.Many engrafted cells extended pr ocesses since 2 weeks post-transplantation.
4.NSCs移植对损伤脑组织中突触素表达的影响
RT-PCR和免疫印迹检测结果显示,在移植后的不同时间点,SYP在基因和蛋白水平表达均明显高于对照组 (P<0.05)。与对照组比较,在NSCs移植后的第1周,SYP mRNA表达明显增强(P<0.01),且在移植后的第4周达到最高水平(图4 A,4B)。SYP的蛋白表达与基因表达结果相一致(图4C,4D)。
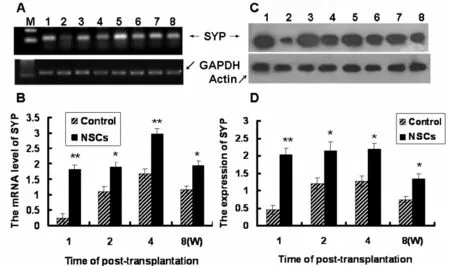
图4 移植后不同时间点,损伤脑组织中SYP的表达A和C分别为RT-PCR电泳图和免疫印迹结果,其中条带1,3,5和7为移植组,2,4,6和8为对照组;1和2,3和4,5和6,7和8分别为移植后1,2,4和8w;B和D分别为SYP/GAPDH 和SYP/Actin的相对值分析。Fig.4 Expression of SYP in transplant site and the boundary zone of the lesion A and C:RT-PCR and Western blot analysis of SYP;C and D:* P<0.05,** P<0.01 vs saline control group at different ti me points.In(A)and(C),Lane 1,3,5 and 7 from NSCs transplant rats,and lane 2,4,6 and 8 from saline control rats.Lane 1 and 2,3 and 4,5 and 6,7 and 8 derived fro m rats at 1,2,4 and 8 weeks post-transplantation,respectively.
讨 论
NSCs被认为是神经系统中的神经前体细胞,具有很强的增殖能力和自我更新能力,能够分化为神经元和神经胶质细胞,在神经系统的发育中起重要作用。NSCs的发现为神经系统损伤的修复提供了巨大的治疗前景。本实验采用目前常用的体外培养NSCs的方法进行NSCs培养。并用巢蛋白和βⅢ-微管蛋白对培养的NSCs和其分化为神经元的表型进行了鉴定。
以前的研究表明NSCs移植急性期TBI可能有助于脑损伤的恢复。在损伤后第3天,通过立体定位进行NSCs脑内移植,移植细胞在创伤性脑损伤脑内可以存活,并分化为神经元和神经胶质细胞,减轻脑损伤引起的运动功能损伤[13]。在我们的研究中,TBI损伤引起了明显的运动功能障碍。在损伤后第3天,于损伤灶直接移植NSCs悬液,在选择性的感觉运动功能试验中,NSCs移植鼠前后肢功能分别在移植后第2周和4周恢复至手术前水平,而直到第8周,对照组大鼠后肢功能和通过平板移动时间与NSCs移植鼠和基线比较仍有显著性差异。这些结果表明,于TBI损伤后第3天,NSCs移植能够明显改善对侧肢体的运动功能,促进TBI损伤引起的运动功能缺陷的恢复。
我们的结果显示,在实验期间内,随着移植时间延长,存活细胞数明显减少。特别是在移植的早期,移植后第4天细胞存活数是移植后第1天细胞存活数的41%。在移植后第8周,移植细胞的存活数是移植细胞数的4.1%。在移植早期,移植细胞存活数明显减少可能与急性损伤引起的微环境改变有关,包括由原发损伤引起的继发损伤、血脑屏障的破坏和一系列复杂的炎性反应介导了细胞死亡,并且负面的影响了移植细胞的存活和迁移[14,15]。研究表明 在TBI损伤后的3-48 h内,炎性反应可能诱导凋亡相关基因的上调[16]。本研究证明,尽管在TBI急性期NSCs移植治疗中,移植细胞能够存活,并且促进了运动功能改善,但是TBI急性期的微环境不利于移植细胞的存活,导致了移植早期大量细胞死亡。因此,我们建议TBI损伤的最佳NSCs移植时间可能是亚急性期,因为TBI引起的炎性反应和细胞因子的释放主要发生在亚急性期之前(1-7 d),而巨噬细胞的聚集和胶质瘢痕的形成发生在1 w以后[17,18]。然而,Harting等人报道[6],于 TBI损伤后7 d,NSCs直接注入损伤灶,在移植后的48 h和2 w,细胞存活数为1.4-1.9%,低于本研究中的细胞存活数。可能的解释是尽管目前还没有研究证明最佳的移植条件,但移植细胞的存活和移植的具体过程有关,包括移植量、注射速度、针头移出等方式有关。
在NSCs移植治疗中枢神经系统损伤中,移植细胞与宿主细胞建立突触联系、建立细胞外信号连接并与宿主神经网络整合的能力是细胞移植恢复受损功能的必要条件。各种损伤后的突触和轴突再建对预测损伤后的神经修复具有重要意义。SYP是一种突触前囊泡上的膜蛋白,与突触结构和功能密切相关。SYP几乎存在于中枢和外周神经系统的所有神经末梢,参与突触囊泡的导入、转运和神经递质的释放、突触囊泡再循环和突触发生[19]。TBI损伤引起的氧化过程可能导致了突触蛋白的丢失,因此影响神经细胞的存活和功能[20]。本研究中,NSCs移植TBI明显促进了损伤脑组织中SYP的基因和蛋白表达,这可能与NSCs移植促进TBI大鼠感觉运动功能的恢复有关,其机制有待于进一步研究。
[1]Colantonio A,Croxford R,Farooq S,et al.Trends in hospitalization associated with trau matic brain injur y in a publicly insured population,1992-2002.J Trauma,2009,66(1):179-183
[2]Bullock MR,Lyeth BG,Muizelaar JP.Current status of neuroprotection trials f or traumatic brain injury:lessons fro m ani mal models and clinical st udies.Neur osur gery,1999,45(2):207-220
[3]Storch A,Schwarz J.Neural stem cells and neurodegeneration.Curr Opin Investig Drugs,2002,3(5):774-781.
[4]Vladi mer D,There?se K,Zaal K.Survival,migration and neuronal differentiation of hu man fetal striatal and cortical neural stem cells grafted in stroke-damaged rat striatu m.Eur J Neuroscience,2007,26(3):605-614
[5]Kari mi-Abdolrezaee S,Eftekharpour E,Wang J,et al.Delayed transplantation of adult neural precursor cells pro motes remyelination and f unctional neurological recovery after spinal cord injury.J Neurosci,2006,26(13):3377-3389
[6]Harting MT,Sloan LE,Ji menez F,et al.Subacute neural stem cell therapy f or traumatic brain injury.J Sur g Res,2009,153(2):188-194
[7]Masliah E,Honer WG,Mallory M,et al.Topographical distribution of synaptic-associated proteins in the neuritic plaques of Alzhei mer's disease hippocampus.Acta Neur opathol,1994,87(2):135-142
[8]Zhai RG,Var dinon-Fried man H,Cases-Langhoff C,et al.Assembling the presynaptic active zone:A characterization of an active one precursor vesicle.Neuron,2001,29(1):131-143
[9]Shojo H,Kibayashi K.Changes in localization of synaptophysin following fluid percussion injur y in the rat brain.Brain Res,2006,1078(1):198-211.
[10]Tarsa L,Goda Y.Synaptophysin regulates activity-dependent synapse for mation in cultured hippocampal neurons.Proc Natl Acad Sci USA,2002,99(2):1012-1016
[11]Feeney DM,Boyeson MG,Linn RT,et al.Responses to cortical injury:Met hodology and local effects of contusions in the rat.Brain Res,1981,211(1):67-77
[12]Li Z,Schallert T,Zheng GZ,et al.A test for detecting long-ter m sensori motor dysf unction in the mouse after f ocal cerebral ischemia.J Neurosci Methods,2002,117(2):207-214
[13]Riess P,Zhang C,Saat man KE,et al.Transplanted neural stem cells survive,differentiate,and improve neurological motor function after experimental traumatic brain injury.Neurosur gery,2002,51(4):1043-1052
[14]Lenzlinger PM,Morganti-Koss mann MC,Laurer HL,et al.The duality of the inflammatory response to traumatic brain injur y.Mol Neurobiol,2001,24(1-3):169-181
[15]Modo M,Stroemer RP,Tang E,et al.Effects of i mplantation site of stem cell grafts on behavioral recovery from stroke damage.Stroke,2002,33(9):2270-2278
[16]Shojo H,Kaneko Y,Mabuchi T,et al.Genetic and histologic evidence i mplicates role of inflammation in trau matic brain injur y-induced apoptosis in t he rat cerebral cortex following moderate fluid percussion injury.Neuroscience,2010,171(4):1273-1282
[17]Hel my A,Car penter KL,Menon DK,et al.The cytokine response to hu man trau matic brain injury:temporal profiles and evidence f or cerebral parenchy mal production.J Cereb Blood Flow Metab,2010,31(2):658-670
[18]Hellewell SC,Yan EB,Agyapomaa DA,et al.Posttrau matic hypoxia exacer bates brain tissue damage:analysis of axonal injur y and glial responses.J Neurotrau ma,2010,27(11):1997-2010
[19]杨春.突触素的若干研究.河南医学研究,2004,13(1):85-89
[20]Ansari MA,Roberts KN,Scheff SW.Oxidative stress and modification of synaptic proteins in hippocampus after trau matic brain injur y.Free Radic Biol Med,2008,45(4):443-452
Effect of neural stem cells transplant on expression of synaptophysin in a rat model of traumatic brain injury
Ma Haiying1,3,Yu Bo2,Guan Shui4,Ma Xuehu4,Shi Yuxiu1*
(1Depart ment of histology and embr yology,Institute of pathology and pathophysiology,China medical university,Shenyang 110001,China;2Depart ment of neurosur ger y,Shengjing hospital af f iliated of China medical university,Shenyang 110004,China;3Depart ment of histology and embr yol ogy,Dalian medical university,Dalian 116044,China;4Dalian R&D Center f or Stem Cell and Tissue Engineering,Dalian University of Technology,Dalian 116024,China)
Objective To evaluate the effect of neural stem cells(NSCs)transplant on sensori motor f unction and synaptophysin(SYP)in injured-brain of a rat model of trau matic brain injur y(TBI).Met hods Cortical NSCs derived from E14 rat embroes were cultured.A rat model of TBI was conducted according to previous report by Feeney.At 72 hours after TBI injur y,t he transplant gr oup
delivery of t he NSCs labeled by PKH26,while Grid wal kand Latency to move t he contr ol gr oup received equivalent saline sol ution tests were used to eval uated t he sensori motor f unction of t he ani mals.The nu mber of sur viving cells was quantified under fluorescent microscope.Western blot and RT-PCR were conducted to assess the expression of SYP in injured brain.Results NSCs transplant rats to returned to pre-surgery levels at 2 and 4 weeks in f oreli mb and hindli mb perf or mance,respectively.However,Hindli mb perf or mance and latency to move in saline contr ol rats revealed significant diff erence co mpared to baseline and NSCs transplant rats at 8 weeks.Engrafted NSCs demonstrated a decrease in t he nu mber of survival cells during the 8-week period.The percentage of surviving cell is 6.3%±1.0%and 4.1%±0.9%of engrafted cells at 4 and 8 weeks post-transplantation,respectively.mRNA and protein expression of SYP were significantlyhigher in NSCs transplant rats compared to those in saline control rats during 8-week period post-transplantation(P<0.05).Concl usion NSCs transplanted directl y into t he injured brain are capable of sur viving in a rat model of TBI.Engrafted NSCs increase expression of SYP in inj ured brain of TBI rats,which is suggested as one of t he mechanis ms underlying t he i mproved f unctional recovery on sensori motor behavior due to NSCs transplant f ollowing TBI.
Neural stem cells;Transplant;Trau matic brain inj ury;Synaptophysin
R329
A
10.3870/zgzzhx.2011.06.019
2011-08-10
2011-10-01
辽宁省教育厅科学技术研究项目 (2008851,2008779)
马海英,女(1975年),汉族,博士研究生。
*通讯作者(To whom correspondence should be addressed)
