骨髓间充质干细胞分化为心肌细胞过程中Notch表达的研究
2011-12-15赵月强张端莲
牛 萍 赵月强 张端莲
骨髓间充质干细胞分化为心肌细胞过程中Notch表达的研究
牛 萍*赵月强 张端莲1
(武汉大学人民医院儿科;1武汉大学基础医学院人体解剖与组织胚胎学系,武汉430060)
目的 研究骨髓间充质干细胞分化为心肌细胞过程中Notch表达的研究。方法 用密度梯度离心法分离培养犬骨髓间充质干细胞,按照酶法及差速贴壁法分离培养心肌细胞。观察干细胞增殖及传代情况。单独培养的干细胞为对照组,实验组将骨髓间充质干细胞与心肌细胞共培养,用RT-PCR、免疫细胞化学、MTT等方法检测干细胞分化为心肌细胞的情况,及干细胞在增殖与分化为心肌细胞过程中Notch信号系统的表达情况。结果 骨髓间充质干细胞呈梭形、旋涡样生长,增殖及传代能力强,并可诱导分化为心肌样细胞,免疫荧光示心肌细胞标志物的表达。RT-PCR及免疫细胞化学显示实验组有Notch信号通路受体及配体的表达,而对照组表达微弱。结论 骨髓间充质干细胞在增殖及分化过程中存在Notch信号通路,在干细胞分化为心肌细胞过程中Notch信号系统的表达上调。
信号通路;干细胞;分化;心肌细胞;表达
骨髓间充质干细胞在特定微环境及适宜的细胞因子的作用下,可分化成多种组织细胞,已成为组织工程、细胞及基因治疗的理想的靶细胞。并且由于其低免疫原性,在组织构建和再生医学中得到了广泛运用[1-3]。因此,找到与骨髓间充质干细胞增殖与分化相关的信号通路,通过精确调控信号通路,来诱导干细胞向特定的细胞系分化,就可为组织构建提供大量的功能细胞,具有重要的临床意义。有研究表明Notch信号系统几乎涉及所有细胞的增殖、分化活动,其通过临近细胞间的相互作用来调节与细胞增殖和分化相关的基因转录,从而精确调控各谱系细胞的增殖与分化[3]。本研究旨在探讨骨髓间充质干细胞增殖及分化为心肌细胞过程中,是否存在Notch信号通路,以及其具体的作用。
材料和方法
1.材料
实验犬(体重12-20kg)11只,雌雄不拘,乳鼠10只(出生小于24h),均由我院实验动物中心提供。胎牛血清(美国Gibco公司),DMEM,胶原酶,胰蛋白酶(美国Sigma公司),Notch1多克隆抗体及Jagged1多克隆抗体(美国Cell signalling公司),兔抗鼠肌钙蛋白T抗体(武汉博士德公司),鼠抗人连接蛋白43多克隆抗体(CX43,美国Zymed公司),FITC标记的羊抗鼠IgG及CY3标记的羊抗兔IgG(美国Sigma公司)。RT-PCR试剂盒(美国Sigma公司)。倒置相差显微镜(日本Olympus公司)。实验过程中对动物的处置符合中华人民共和国科学技术部年颁布的《关于善待实验动物的指导性意见》标准。
2.方法
2.1 犬骨髓间充质干细胞的复苏、扩增及传代
3%戊巴比妥钠(30mg/kg)麻醉犬,从胫骨平台处抽取骨髓液5ml(注射器内含肝素0.5ml),混匀防凝;将所抽取骨髓液放入15ml消毒离心管,加等量无血清DMEM 培养液(5ml)稀释混匀,离心(1100rpm,5min),去除上层脂肪滴。取15ml消毒离心管,先加入5ml Percoll分层液,在分层液界面上小心加入与分层液等量的稀释骨髓液(5ml),分层离心(1500rpm,20min)。用吸管小心吸取中间分层液界面的絮状物至另一离心管,此絮状物富含所分离的单个核细胞,加入10mlDMEM培养液混匀,洗涤离心(1100rpm,5min)二次,去除上清液,沉积物用5mlDMEM+10%FBS悬浮,以1×106/ml密度接种细胞于一次性塑料培养瓶中,放置37℃、5%CO2培养箱培养。48h后首次换液,去除未贴壁的细胞,以后每3d换一次液,待细胞培养7-10d,细胞融合约80%时,传代培养。去除培养液,PBS洗涤,加入0.125%胰蛋白酶+1%EDTA2ml,消化3min,弃消化液,加入6ml含血清的DMEM培养液终止消化,吸管吹打细胞,以1:2传代扩增。将传代后的骨髓间充质干细胞随机分为二组,一组单独培养,为对照组,一组与心肌细胞共培养,为实验组。
2.2 心肌细胞的分离及培养
按照酶法及差速贴壁法分离培养心肌细胞。于无菌操作下,将乳鼠的心室肌剪成1mm3大小的碎块,用DMEM洗1次。弃去带血的上清液,组织碎块中加入含0.125%胰蛋白酶,0.1%胶原酶消化,每次37℃消化4min,首次消化液弃去,细胞悬液转移到含有10mlDMEM培养液的无菌试管中,并以1000r/min离心5min,弃上清液,细胞沉淀再次用培养液重悬。细胞悬液置于平皿中37℃静置。1h后,小心吸出细胞悬液,接种到六孔板中备用。
2.3 MSCs与心肌细胞的共培养
将部分 MSCs用4,6-二脒基-2-苯基吲哚(DAPI)标记细胞核30min,用D-Hanks液漂洗10遍,与心肌细胞按照1:4的比例,接种于覆有盖玻片的六孔板进行共同培养。于培养后第五天检测搏动频率及分化比率的变化。用RT-PCR及免疫细胞化学方法检测Notch信号因子的表达及心肌细胞标志物的表达。
2.4 免疫荧光检测心肌标志物的表达
将各组制成的细胞爬片用PBS洗净,固定,羊血清封闭,加入1∶100稀释的兔抗鼠TnT抗体,鼠抗人连接蛋白43多克隆抗体,孵育漂洗干净后,分别加入CY3标记的羊抗兔IgG及FITC标记的羊抗鼠IgG孵育,漂洗,晾干封片,荧光显微镜下观察。
2.5 免疫细胞化学检测信号系统细胞因子的表达
将各组制成的细胞爬片进行免疫细胞化学分析,将玻片PBS漂洗数次,加入4%多聚甲醛固定30min,后用PBS漂洗干净,再加入牛血清白蛋白封闭,用PBS漂洗,后加入1∶100稀释的Jagged1抗体及Notch1多克隆抗体,室温孵育120min,用PBS漂洗后,加入辣根过氧化物酶标记的羊抗兔IgG于室温孵育90min,PBS漂洗干净,将DAB浓缩显色液稀释后滴加于玻片显色,以PBS浸洗终止反应,苏木精复染,漂洗,脱水,封片,镜下观察各组表达变化。阳性表达定位于细胞质,均呈棕黄色或棕褐色颗粒样分布。镜下观察染色强度,按信号强弱程度将阳性细胞分为三个等级:着色浅棕色为弱阳性;棕褐色为阳性;无着色为阴性。
2.6 逆转录聚合酶链式反应(RT-PCR)检测Notch1基因的转录
共培养后第七天,用Trizol试剂提取实验组与对照组细胞的总RNA进行逆转录反应,所用引物根据其Genebank上所查序列使用Primer 5.0软件自行设计。扩增条件为94℃预变性2min,PCR循环35个,94℃变性50s,55℃退火45s,72℃延伸1min,循环完成后,72℃延伸5min。Notch1的引物序列为:5 ’-TGTGACAGCCAGTGCAACTC-3 ’; 5 ’-GCAGTGCTTCCAGAGTGCCA-3’,所 得 cDNA进行PCR反应,取反应产物进行琼脂糖凝胶电泳,紫外灯下观察。并对电泳图谱上的条带进行图像分析,计算各基因与GAPDH吸收峰面积之比值。
3. 统计学分析
用SPSS 13.0统计软件进行统计学处理。计量资料的数据均采用平均数±标准差,其结果的比较用t检验,P<0.05被认为有统计学意义。
结 果
1.骨髓间充质干细胞的增殖
刚接种的细胞悬液中90%以上为单个核细胞,48h首次换液后,几乎所有细胞都贴壁,变成椭圆形,少部分已变成梭形。第5d更换培养液时,可见散在分布的贴壁细胞,逐渐聚集在一起,形成多个克隆,逐渐增殖生长,第7至10d,细胞数量增加,细胞排列具有方向性,呈旋涡样生长,旋涡中心细胞呈多层分布,细胞形态呈细长的梭形,折光性强,融合70-90%。传代后细胞增长迅速,倍增时间为21h,第3至4d,达到高峰期,第7d左右进入平台期(图1-2)。
2.骨髓间充质干细胞向心肌细胞分化的诱导
普通光镜下可见骨髓间充质干细胞分裂,变成菱形、多角形、宽梭形等形状,穿插在心肌细胞之中,变成圆柱形聚集在一起,可见明暗相间的横纹,形成放射状细胞簇,一起同步收缩,出现节律性搏动。干细胞与心肌细胞共培养后的第三天,约有42%的干细胞分化为心肌细胞,与心肌细胞一起出现自发性搏动,频率为46±13次/分,以后逐渐增长到76±11次/分,细胞分化比率提高到84%,到第八天时,仍有自主搏动,频率为71±12次/分(图3)。
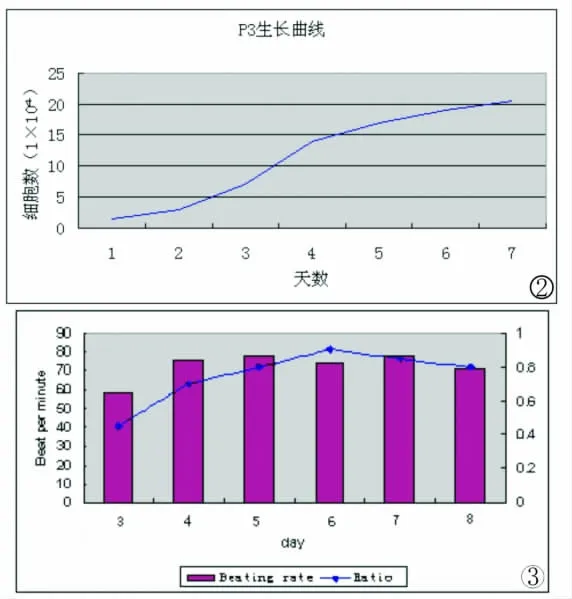
图2 骨髓间充质干细胞的生长曲线。第3代骨髓间充质干细胞的细胞增殖旺盛,倍增时间为21h,第7d左右进入平台期。图3 共培养后细胞搏动频率及分化比率的比较。干细胞与心肌细胞共培养后的搏动频率由46±13次/分逐渐增长到76±11次/分,并持续到第八天。细胞分化比率从大约42%提高到84%Fig.2 Growth curve of mesenchymal stem cells.Mesenchymal stem cells of passage 3growed productively and entered the platform in the seventh day.Fig.3 Comparison of beating rate and rate of differentiation.Spontaneously beating rate increased from 46±13bpm to 76±11bpm.The rate of differentiation increased from 42%to 84%.
3.免疫荧光检测心肌细胞标志物的表达
结果显示肌钙蛋白TnT在实验组有表达,对照组无表达,说明骨髓间充质干细胞分化为心肌细胞。培养的干细胞及心肌细胞间可见间隙连接蛋白CX43的表达,分布在胞浆与胞膜(图4)。蓝色荧光代表干细胞的核,红色荧光代表TnT,绿色荧光代表CX43。说明干细胞与心肌细胞间形成了电机械偶联。
4.免疫细胞化学检测Notch信号系统的表达
二组均可见Notch信号系统受体及配体的表达,实验组较对照组表达强烈。说明骨髓间充质干细胞在分化为心肌细胞过程中,Notch信号系统的表达上调(图5)。
5.Notch通路信号分子mRNA的表达
实验组可见Notch1信号通路受体及配体的表达,而对照组表达微弱。说明骨髓间充质干细胞在增殖及分化过程中存在Notch信号通路,在干细胞分化为心肌细胞过程中Notch1信号系统的表达上调,显示Notch1对骨髓间充质干细胞分化为心肌细胞起正向调控作用(图6)。
讨 论
Notch信号通路广泛存在于各种动物细胞中,在调节细胞分化、增殖和凋亡中发挥重要作用。完整的Notch信号通路包括Notch受体、Notch配体、CSL DNA结合蛋白、靶基因和效应物等。目前得到公认的Notch信号传递过程,是Notch受体与临近细胞表面配体相结合后,Notch蛋白相继发生水解,其胞内区(NIC)被切割,从细胞膜上脱离,转运进入细胞核并与转录抑制子结合,激活Notch诱导基因的转录,从而调节与细胞增殖和分化的相关基因转录[4-6]。它的配体和受体都是细胞膜表面蛋白,信号通讯被限于两相邻细胞间进行。因此,是介导细胞间通讯的一种重要方式。
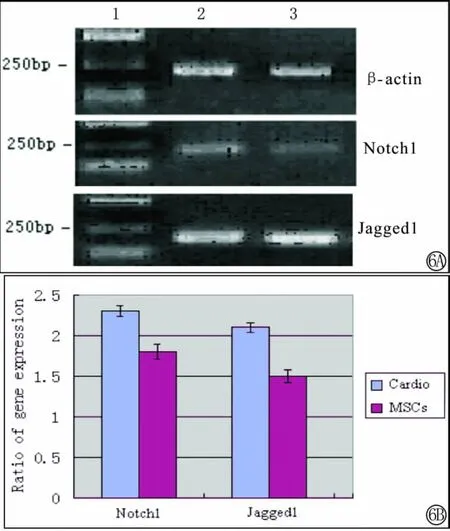
图6 RT-PCR检测Notch信号系统的表达。A中1为Marker,2为干细胞来源的心肌细胞,3为干细胞,可见二组均有Notch1及Jagged1的表达,2组较3组表达强。B为各组基因与GAPDH吸收峰面积之比值,心肌细胞组较干细胞组比值高。Fig.6 Expression of Notch1and Jagged1by RT-PCR.1:Marker;2:cardiomyocytes from MSCs;3:Mesenchymal stem cells.Both of group had the gene expression,and 2 group expressed more highly than 3group;B indicated the ratio of fluorescence of gene fragment.
目前在骨髓间充质干细胞向神经细胞以及成骨细胞分化过程中,均发现Notch信号系统的重要参与[7-8]。最近国外学者研究,在骨髓间充质干细胞向平滑肌细胞分化过程中,Notch起重要的调控作用。当JAG1蛋白被下调时,平滑肌细胞的标志物表达下降,说明激活Notch信号系统,可促使 MSCs向平滑肌细胞分化[9]。骨髓间充质干细胞可在模拟的心脏微环境中分化为心肌细胞,有学者通过直接接触与间接接触心肌细胞两种方法,研究骨髓间充质干细胞分化为心肌细胞的比率,结果表明直接接触是促进MSC向心肌样细胞分化的重要因素,两种细胞间直接接触可能使MSC接受向心肌细胞定向分化的某种特异性信号[10-11]。Notch信号可直接由相邻细胞间接触传递,并传导至细胞核,激活相关转录因子的表达,其不需第二信使和蛋白激酶的参与,因此,此种传导方式能对细胞的分化过程起到精细调控作用[12]。
为了检验Notch信号系统是否对骨髓间充质干细胞的增殖及分化也有调控作用,用RT-PCR检测发现骨髓间充质干细胞中存在Notch1-Jagged1通路,说明Notch信号系统对体外培养的骨髓间充质干细胞有调控作用。骨髓间充质干细胞在体外增殖能力强,可传多代,并可诱导分化为心肌细胞、成骨细胞及软骨细胞。说明其有多向分化潜能[13]。为了明确具体的调控作用,将骨髓间充质干细胞在体外培养后,诱导分化为心肌细胞,研究分化后Notch信号通路表达情况。结果显示Notch信号系统对骨髓间充质干细胞的增殖与分化有调控作用,干细胞进入增殖状态时,Notch信号系统表达微弱;当干细胞向心肌细胞分化时,Notch信号系统表达增强,说明Notch信号系统对干细胞分化为心肌细胞有诱导作用。得出Notch信号对骨髓间充质干细胞分化为心肌细胞起重要的调控作用。说明如果激活Notch信号系统,使其表达上调,可促使MSCs向心肌细胞分化,这为下一步的实验提供了理论依据及实验基础。
骨髓间充质干细胞的多潜能性决定了其分化调控机制的复杂性。在这样一个复杂的调控机制中,是多种信号系统参与的结果[14]。有学者认为骨髓间充质干细胞中存在分化为各种功能细胞的目的基因,在分化的不同阶段,会有不同的基因表达,这种事件是随机的,受微环境、细胞因子及信号系统等影响。如果加入诱导因子或细胞及信号通路调节子,增强目的基因表达,抑制其他基因表达,就可使干细胞向目的细胞分化[15-16]。总之,骨髓间充质干细胞定向诱导分化的分子机制复杂,要想系统性地阐释干细胞多向分化的分子机制还有待投入更多的工作。但从目前研究结果可以看出,Notch信号通路对于干细胞分化为心肌细胞起着重要的调控作用,提示其有重要性和应用前景。如果能找到调节Notch信号途径的有效方式,就可以通过Notch信号的改变来精确调控骨髓间充质干细胞的增殖与定向分化,为临床和科研提供各种功能细胞或目的细胞。
[1]Maillard I,Pear WS.Immunology.Keeping a tight leash on Notch.Science,2007,316(5826):840-842
[2]Wilson AA,Kotton DN.Another notch in stem cell biology:Drosophila intestinal stem cells and the specification of cell fates.Bioessays,2008,30(2):107-109
[3]Ganapati U,Tan HT,Lynch M,et al.Modeling notch signaling in normal and neoplastic hematopoiesis:global gene expression profiling in response to activated notch expression.Stem Cells,2007,25(8):1872-1880
[4]Vujovic S,Henderson SR,Flanagan AM,et al.Inhibition of gamma-secretases alters both proliferation and differentiation of mesenchymal stem cells.Cell Prolif,2007,40(2):185-195
[5]Han W,Yu Y,Liu XY.Local signals in stem cell-based bone marrow regeneration.Cell Res,2006,16(2):189-195
[6]Choi YH,Kurtz A,Stamm C.Mesenchymal stem cells for cardiac cell therapy.Hum Gene Ther,2011,22(1):3-17
[7]Wilson AA,Kotton DN.Another notch in stem cell biology:Drosophila intestinal stem cells and the specification of cell fates.Bioessays,2008,30(2):107-109
[8]Oldershaw RA,Hardingham TE .Notch signaling during chondrogenesis of human bone marrow stem cells.Bone,2010,46(2):286-293
[9]Rosivatz E,Becker I,Specht K,et al.Differential expression of the epithelial-mesenchyalt-ransition regulators Snail,SIP1,and twist in gast ric cancer.Am J Pathol,2002,161(5):1881-1891
[10]Li H,Yu B,Zhang Y,et al.Jagged1protein enhances the differentiation of mesenchymal stem cells into cardiomyocytes.Biochem Biophys Res Commun,2006,34(1):320-325
[11]Perán M,Marchal JA,López E,et al.Human cardiac tissue induces transdifferentiation of adult stem cells towards cardiomyocytes.Cytotherapy,2010,12(3):332-337
[12]Trivedi P,Tray N,Nguyen T,et al.Mesenchymal stem cell therapy for treatment of cardiovascular disease:helping people sooner or later.Stem Cells Dev,2010,19(7):1109-1120
[13]Pedrazzini T.Control of cardiogenesis by the notch pathway.Trends Cardiovasc Med,2007,17(3):83-90
[14]Campa VM,Gutiérrez-Lanza R,Cerignoli F,et al.Notch activates cell cycle reentry and progression in quiescent cardiomyocytes.J Cell Biol,2008,183(1):129-141
[15]Collesi C,Zentilin L,Sinagra G,et al.Notch1signaling stimulates proliferation of immature cardiomyocytes.J Cell Biol,2008,183(1):117-128
[16]da Silva Meirelles L,Chagastelles PC,Nardi NB.Mesenchymal stem cells reside in virtually all post-natal organs and tissues.J Cell Sci,2006,119(Pt 11):2204-2213
图 版 说 明
图1 骨髓间充质干细胞的增殖。A为在普通显微镜下可见培养后第4d的骨髓干细胞呈菱形、多角形、宽梭形等形状,逐渐变形聚集在一起。B为传代后第3d的骨髓间充质干细胞,细胞形态呈细长的梭形,折光性强,呈旋涡样生长,融合70-90%。(×100)
图4 细胞诱导后心肌标志物的表达。A、C组为共培养组,分别可见TnT及CX43的表达,B、D组为单纯干细胞组,未见TnT表达,CX43表达微弱。(×400)
图5 细胞诱导后细胞因子及心肌标志物的表达。A、C组为共培养组,分别可见Notch1及Jagged1的表达,B、D组为单纯干细胞组,Notch1及Jagged1表达微弱。(×400)
EXPLANATION OF FIGURES
Fig.1 Mesenchymal stem cells in culture.A indicated that MSCs appeared as heterogeneous groups of large flat cells,smaller spindle-shaped cells,and formed focal areas of cell aggregation after 4days of coculture.B indicated that mesenchymal stem cells of passage 3had confluence of 70-90% .(×100)
Fig.4 Expression of TnT and CX43after induction of MSCs.A and C indicated cardiomyocytes from MSCs had expression of TnT and CX43;B indicated MSCs had no expression of TnT,D indicated MSCs had weaker expression of CX43.(×400)
Fig.5 Expression of Jagged1and Notch1after induction of MSCs.A and C indicated cardiomyocytes from MSCs had expression of Jagged1and Notch1;B and D indicated MSCs had weaker expression of Jagged1and Notch1.(×400)

The study of expression of Notch signaling in the differentiation of mesenchymal stem cells into cardiomyocytes
Niu Ping*,Zhao Yueqiang,Zhang Duanlian1
(Department of Pediatrics,Renmin Hospital of Wuhan University;1Department of Anatomy,Histology and Embryology,Wuhan University,Wuhan 430060,China)
Objective To investigate the expression of Notch signaling of the differentiation of mesenchymal stem cells(MSCs)into cardiomyocytes.Methods MSCs were isolated from canine bone marrow and cultured with cell culture techniques,and then cardiomyocyte differentiation wad induced.The identification of the differentiation of MSCs and the Notch signal was carried out by RT-PCR and immunohistochemistry.MTT method was used to calculate the growth curve.Results MSCs looked fusiform under light microscopy.MSCs differentiated into cardiomyocytes.Immunofluorescence showed a significantly increased expression of TnT and CX43.RT-PCR and immunohistochemistry showed that the protein of the Notch signal was expressed during differentiation,and the level of expression was significantly lower during proliferation.Conclusion The Notch signaling system participates in the proliferation and differentiation of mesenchymal stem cells,and its expression increased during the differentiation of mesenchymal stem cells into cardiomyocytes.
Notch signal pathway;Stem cell;Differentiation;Cardiomyocyte;Expression
R329
A
10.3870/zgzzhx.2011.06.001
2011-03-11
2011-09-21
国家自然科学基金(30801131);教育部高等学校博士学科点专项科研基金(200804861045)
牛萍,女(1978年),汉族,主治医师。
*通讯作者(To whom correspondence should be addressed)
