抗HIV-1活性化合物作用靶点的快速判断方法
2011-12-01马铃张全殷霄李晓宇赵立勋岑山
马铃,张全,殷霄,李晓宇,赵立勋,岑山
目前,艾滋病的防治工作主要依靠抗 HIV-1 药物,临床使用的抗 HIV 药物主要是逆转录酶抑制剂、蛋白酶抑制剂、融合抑制剂和整合酶抑制剂。逆转录酶抑制剂包括核苷类逆转录酶抑制剂(NRTI),如 Zidovudine(AZT)、Lamivudine(3TC)、Emtricitabine(FTC)等,非核苷类逆转录酶抑制剂(NNRTI),如 Efavirenz(EFV)、Nevirapine(NVP)、Delavirdine(DLV)等。蛋白酶抑制剂主要有Ritanovir(RTV)、Saquinavir(SQV)、Indinavir(IDV)等。融合抑制剂主要有 Enfuvirtide(T20)。整合酶抑制剂主要有 Elvitegravir(GS- 9137)和Raltegravir(MK-0518)[1-2]。
尽管目前临床上抗 HIV-1的药物已多达 20 余种,但由于HIV-1 高变异而导致的多重或交叉耐药性等问题,开发新作用机制的抗 HIV-1 药物仍然是当务之急[3]。在抗HIV-1 活性化合物筛选过程中,对化合物作用机制的快速判断,以及排除药物筛选过程中的脱靶现象,将减少药物研发过程中的盲目性,同时也能降低研究成本。因此,本研究针对这一问题,建立了一种对抗 HIV-1 活性化合物作用靶点的快速判断方法。
HIV-1的基因组为约 9 kb的正义RNA,其两端是长末端重复序列(long terminal repeats,LTR),含顺式调控序列,控制前病毒的表达,在LTR 有启动子和增强子并含有负调控区。两端 LTR 之间表达 gag,pol,env,tat,rev,vpu,vpr,vif和nef 9个主要蛋白。HIV 侵袭靶细胞的主要过程为:识别和黏附、膜融合、逆转录、整合、修饰和翻译、装配和释放。一般将整合以前归为早期事件,之后归为晚期事件[4](图 1)。
本研究以荧光素酶作为报告基因,其活性代表病毒的感染性,并用抗 HIV-1 作用靶点明确的药物(EFV、3TC、MK-0518、SQV和T20)作为阳性对照,验证不同药物对病毒生活周期的影响,最终确立快速判断未知化合物抗HIV-1 活性作用靶点的方法,为后续的筛选及研究工作提供便利。
1 材料和方法
1.1 主要材料

图1 HIV-1 病毒生活周期
293T 细胞(本室保存)培养于含 100 U/ml 青霉素、链霉素和10% 胎牛血清的DMEM 培养基中;SupT1 细胞(本室保存)培养于含 100 U/ml 青霉素、链霉素和10%胎牛血清的1640 培养基中;质粒 pNL-Luc-E-和表达水泡性口膜炎病毒的外壳糖蛋白 pHCMV-G(VSV-G)质粒由医科院病原所何玉先教授提供;表达 HIV-1的包膜蛋白pHXB2-Env、阳性对照 EFV、3TC、T20、MK-0518和SQV均由美国国立卫生研究院(NIH)惠赠,其中 T20 溶于磷酸盐缓冲液(PBS),其他药物均溶于二甲基亚砜(DMSO);转染试剂 Lipofectamine 2000、Trizol DNA 提取试剂盒均购于美国 Invitrogen公司;MJ MiniTMPCR 仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 假病毒的制备 293T 细胞转染前接种于6 孔板,细胞浓度为1.5×105/ml,于2ml 培养基中培养,24 h 后转染。质粒 pNL-luc-E- 为全长的HIV-1 缺失了 HIV-1-env基因,并在nef 区插入了一个荧光素酶基因,用量为每孔300 ng,pHCMV-G(VSV-G)每孔 210 ng(或 pHXB2-Env每孔 300 ng)。转染试剂为Lipofectamine 2000,根据使用说明书进行转染。48 h 后收上清,分别为VSV-G-HIV和Env-HIV。其中 T20 所用病毒颗粒为Env-HIV,其余药物为VSVG-HIV,以下操作相同。
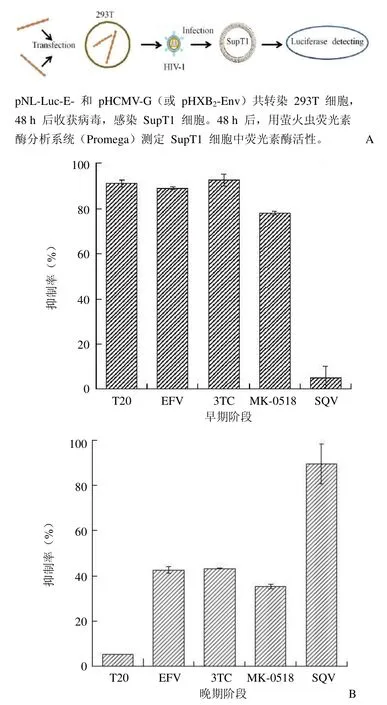
图2 实验流程示意图(A)以及阳性药物对病毒早晚期活动的影响(B)
1.2.2 病毒感染性测定 为了快速判断抗 HIV-1 活性化合物的作用机制,我们利用转染细胞产生假型病毒和假型病毒感染细胞两种技术手段,人为地将病毒的生活周期分为两个阶段(图 2A)。假型病毒感染细胞的过程代表了 HIV-1从吸附到病毒 DNA 整合的过程,即早期阶段。当在病毒感染的步骤中加入阳性药物,可以研究药物对病毒早期阶段的影响。SupT1 细胞浓度为5×105/ml,加入 1.2.1 中制备的假病毒颗粒,固定 MOI 为1,直接铺 96 孔板,每孔200 µl(env-HIV 感染性较弱,铺 24 孔板,每孔 1ml),每孔加入 2 µl 药物,设空白和DMSO 对照(其中 T20 为PBS 对照),48 h 后检测荧光素酶活性。取 50 µl 细胞悬液,加入裂解液 50 µl,37 ℃ 孵育 0.5 h 后,取其中 5 µl 细胞裂解液加 40 µl 荧光素酶底物,在荧光检测器上测定荧光素酶的活性。
转染细胞产生假型病毒的过程包含了从病毒蛋白的表达到病毒成熟的各个环节,为病毒生活周期的晚期阶段。对药物晚期活性的测定,选在转染 293T细胞产生假病毒后6 h 加入阳性药物,浓度为近似的IC90,48 h 后收假病毒感染 SupT1 细胞。测定阳性药物对病毒复制周期的影响,分别取 0、0.5、1、2、4、6、7、21 h 作为加药时间点,并在感染病毒后,将细胞在4 ℃ 放置1 h。离心收集细胞,将沉淀用 PBS 洗 2 遍,以去掉没有吸附在细胞上的病毒,确保病毒在同一时间进入生活周期。
1.2.3 病毒 DNA的PCR 检测 由于目前的药物研发靶点多集中在早期,如进入、逆转录、整合等时期,如果能快速判断活性化合物的作用靶点,对药物研发具有指导意义。病毒从进入到整合的过程具有时相性。通过药物在不同阶段对病毒复制产生的影响,就可以判断药物的作用靶点。病毒生活周期早期大致包括:从结合在基因组RNA的PBS(primer binding site)的tRNALys3 开始形成–sssDNA(minus strand strong-stop cDNA),–sssDNA的链转移,+sssDNA的合成起始,+sssDNA的链转移,完整双链 DNA的合成,形成前病毒 DNA,最终整合到宿主细胞基因组上[4]。本研究利用 PCR 技术研究病毒感染早期病毒 DNA的复制状态,以确定感染早期病毒 DNA 随时间的变化情况,进而证明病毒复制过程的时相性。根据需要设计了U5-R、U5-gag和Alu-U5 三对引物,分别说明病毒进入细胞后逆转录的起始、完成以及整合的完成。
确保病毒在同一时间进入细胞后,SupT1 细胞用新鲜培养基稀释至浓度为5×105/ml,分别在0、0.5、1、2、4、6、7、21 h 这几个时间点(与加药的时间点一致)收集细胞,提取总 DNA,用 PCR 扩增病毒 U5-R、U5-gag和Alu-U5,根据结果可相应判断出HIV-1的逆转录是否起始、完成,整合是否完成。用 GAPDH 作内参对照。引物分别为:U5-R 上游:TCTGGCTAACTAGGGAACCCA;U5-R 下游:CTGACTAAAAGGGTCTGAGG;U5-gag 上游:TGTGT GCCCGTCTGTTGTGTGA;U5-gag 下游:TCAGCAAGCCG AGTCCTGCGT;Alu-LTR 上游:TCCCAGCTACTCGGGAG GCTGAGG;Alu-LTR 下游:AGGCAAGCTTTATTGAGGC TTAAGC;IN 上游:CACACACAAGGCTACTTCCCT;IN下游:TAGCCACTCCCCAGTCCCGCCC[4-5]。
2 结果
2.1 阳性药物最佳工作浓度的确定
为了验证上述方法测定的药物活性与常规方法结果是否具有一致性,即阳性药物的工作浓度是否与文献报道一致,我们测定了上述几种阳性药物的剂效关系,并利用Origin 软件作图,计算出阳性药物的IC50。如表1 所示,所测定的药物抗病毒活性与文献报道基本一致。在随后的实验中,我们参考阳性药物的IC90值,确定了各阳性药物的工作浓度分别为:T20,15.00 nmol/L;EFV,1.50 nmol/L;3TC,0.50 µmol/L;MK-0518,15.00 nmol/L;SQV,3.00 nmol/L。
2.2 药物早晚期活性的确定
根据病毒感染性的测定方法,通过测定感染细胞中荧光素酶活性,定量研究药物对病毒感染性的影响,判断药物在病毒各生活周期中的活性。为了验证该方案的可行性,我们选择了作用机制明确的抗 HIV-1 药物 T20、EFV、3TC、MK-0518和SQV 进行测试。结果显示作用于病毒生活周期早期的药物为T20、EFV、3TC和MK-0518,作用于晚期的药物为SQV(图 2),完全符合药物已知的作用机制。
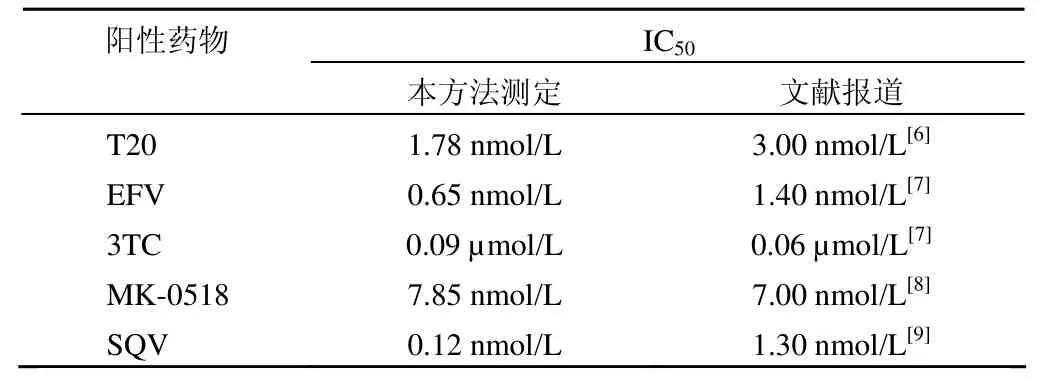
表1 Origin 软件计算的各阳性药物 IC50值与文献报道值的比较
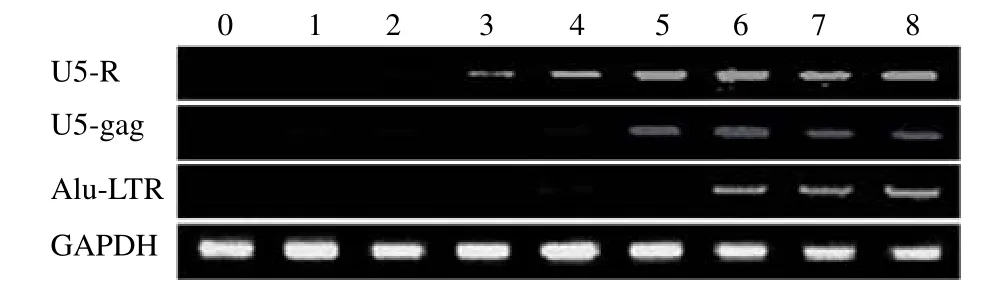
图3 感染 HIV-1 病毒的SupT1 细胞在不同时间点的HIV-1 cDNA PCR 分析
2.3 病毒生活周期早期的界定
从病毒 DNA的PCR 检测结果可以看出,病毒在进入细胞 1 h 左右逆转录开始,到第 4 小时左右完成双链DNA的合成,第 6个小时左右整合起始,到第 21个小时达到整合最大值(图 3)。
2.4 快速判断方法的建立
根据测定靶点明确的药物对病毒复制不同时期的影响可以看出,T20 作为融合抑制剂只在病毒进入细胞之前起作用,而在之后的各个时期及生活周期晚期均不起作用;EFV 非核苷类逆转录酶抑制剂主要在病毒感染后2 h 起作用,之后作用下降直到消失;3TC 核苷类逆转录酶抑制剂主要在感染后1 h 起作用,之后作用下降直到消失;MK-0518 整合酶抑制剂主要在感染后7 h 起作用,之后作用下降,21 h 作用完全消失;而 SQV 在病毒复制早期几乎不起作用;与各个时期 DNA 状态基本一致(图 4)。上述实验结果表明我们可以通过在不同时间点加入待检测的药物,根据药物抗病毒活性的时相性,快速判断药物的作用位点。
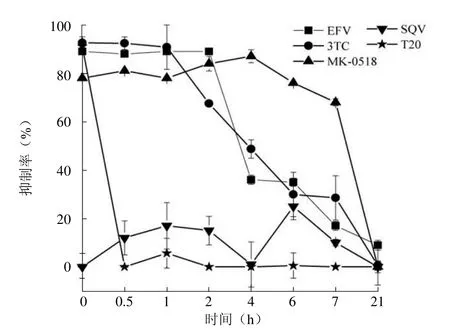
图4 T20、EFV、3TC、MK-0518和SQV 对病毒感染性的影响
3 讨论
目前,艾滋病治疗工作主要依靠于抗 HIV-1 药物。在对抗 HIV-1 活性化合物筛选时多采用定靶筛选,其缺点在于筛选过程中可能出现脱靶现象,并影响对化合物作用机制的判断,为后续的研究带来不便。因此,如果能快速判断活性化合物的作用靶点,对药物的研发具有指导意义。
本方法选择 T20、EFV、3TC、MK-0518和SQV作为阳性药物,鉴于细胞系、质粒、药物来源等客观条件的不同,以及人为、机器及软件分析等方面的误差,此系统中得出的数据与文献报道有些许不同,但基本一致,表明此方法与常规方法具有可比性,可用作抗 HIV-1 活性化合物的筛选。与其他方法(如测 p24 抗原)相比较,具有简单、微量、费用低廉、安全、不受 BSL-3 实验室限制及不用同位素等特点。此外,如果发现针对新靶点的有效药物,也可同理加入到此方法中,使之更加系统化。本研究为实验室抗 HIV-1药物筛选模型的建立提供借鉴与指导,具有较强的实践意义。
[1]Han Y, Wind-Rotolo M, Yang HC, et al.Experimental approaches to the study of HIV-1 latency.Nat Rev Microbiol, 2007, 5(2):95-106.
[2]Serrao E, Odde S, Ramkumar K, et al.Raltegravir, elvitegravir, and metoogravir: the birth of "me-too" HIV-1 integrase inhibitors.Retrovirology, 2009, 6:25.
[3]Clavel F, Hance AJ.HIV drug resistance.N Engl J Med, 2004,350(10):1023-1035.
[4]Li XY, Guo F, Zhang L, et al.APOBEC3G inhibits DNA strand transfer during HIV-1 reverse transcription.J Biol Chem, 2007,282(44):32065-32074.
[5]Chun TW, Stuyver L, Mizell SB, et al.Presence of an inducible HIV-1 latent reservoir during highly active antiretroviral therapy.Proc Natl Acad Sci U S A, 1997, 94(24):13193-13197.
[6]Perez-Bercoff D, Wurtzer S, Compain S, et al.Human immunodeficiency virus type 1: resistance to nucleoside analogues and replicative capacity in primary human macrophages.J Virol, 2007,81(9):4540-4550.
[7]Cao J, Isaacson J, Patick AK, et al.High-throughput human immunodeficiency virus type 1 (HIV-1) full replication assay that includes HIV-1 Vif as an antiviral target.Antimicrob Agents Chemother, 2005, 49(9):3833-3841.
[8]Miller M, Witmer M, Stillmock K, et al.Biochemical and antiviral activity of MK-0518, a potent HIV integrase inhibitor//16th International AIDS Conference, Toronto, 2006.
[9]Owen A, Chandler B, Bray PG, et al.Functional correlation of P-glycoprotein expression and genotype with expression of the human immunodeficiency virus type 1 coreceptor CXCR4.J Virol, 2004,78(21):12022-12029.
