基于rDNA序列的酵母整合载体的构建及应用
2011-12-01支晓慧王丽娜朱平王伟孔建强
支晓慧,王丽娜,朱平,王伟,孔建强
酿酒酵母(Saccharomyces cerevisiae,S.cerevisiae)是一种背景清楚,生长迅速,繁殖简单的单细胞真核生物,很早就作为外源蛋白诱导表达以及代谢工程的宿主菌使用。
在酿酒酵母表达系统中,使用最为广泛的载体分别是附加体型载体(yeast episomal plasmid,YEP)和整合体型载体(yeast integration plasmid,YIP)。其中,YEP 型载体由于含有自主复制序列,在酵母中能独立存活,拷贝数较高;但如果没有选择压力,随着酵母的生长和繁殖,这类质粒会出现丢失的现象,稳定性较差。YIP 型载体不含酵母复制子,因此,不能在酵母中单独存活,必须整合到酵母基因组上才能发挥功能[1]。这类整合载体在酵母中的整合是高特异性的,很稳定,因此,在以酿酒酵母为宿主菌的天然产物合成生物学研究中,酿酒酵母整合体型载体得到了广泛地应用[2-4]。但由于整合体型载体拷贝数较低,致使目的基因的表达水平不高,目的产物含量达不到工业化生产的水平[3]。因此,构建一些高拷贝的整合体型载体对于天然产物合成生物学的研究显得十分必要。
核糖体 DNA(ribosomal DNA,rDNA)序列是指细胞核中编码核糖体 RNA的DNA 序列,它是一段高度重复序列,其重复单位由转录区段和非转录区段组成。在酿酒酵母的XII 染色体中,rDNA存在100~140个重复单位[5]。如果以酿酒酵母rDNA 序列为整合位点,从理论上说,可以得到100~140个目的基因拷贝数。因此,本实验基于rDNA 序列,构建了一个以 rDNA 序列为整合位点的酿酒酵母整合体型载体,并通过该载体,将青蒿紫穗槐-4,11-二烯合酶基因整合到酿酒酵母 rDNA序列上。GC-MS结果表明,该工程菌确实能产生紫穗槐-4,11-二烯,表明紫穗槐-4,11-二烯合酶基因已经整合到了酿酒酵母上。
1 材料与方法
1.1 材料
1.1.1 工具酶和试剂 T4 DNA 连接酶、限制性内切酶和Taq DNA 聚合酶购自宝生物工程(大连)有限公司;克隆质粒 pGEM-T 购自美国 Promega公司;胶回收试剂盒购自加拿大 BBI公司;酵母基因组和质粒提取试剂盒购自天根生化科技(北京)有限公司;朱栾倍半萜(valencene)标准品购自美国 Fluka公司;5-氟乳清酸(5-FOA)购自美国 Sigma公司;正十二烷购自日本 TCI公司;其他试剂均为分析纯。
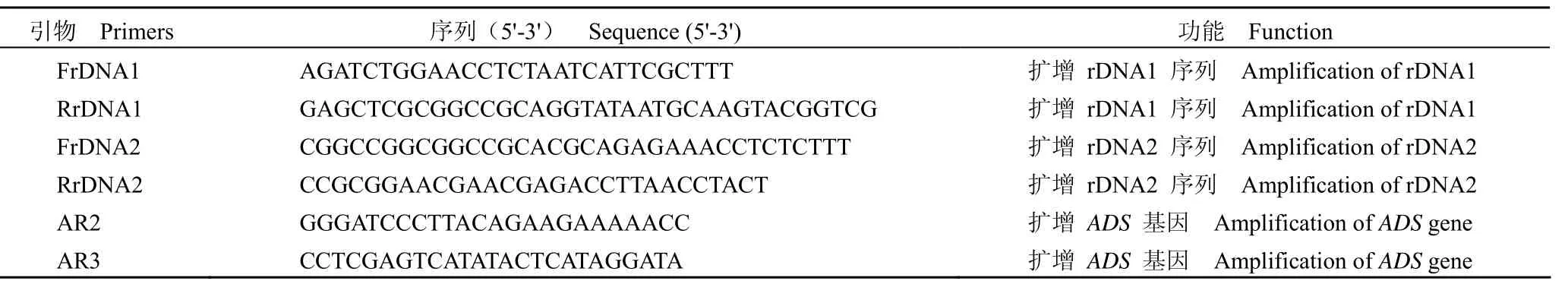
表1 本研究使用的引物Table1 Primers used in the study
1.1.2 质粒、菌种和培养基 克隆质粒 pMD18-T购自宝生物工程(大连)有限公司;宿主菌 E.coli TG1 为本实验室保存;大肠杆菌质粒 pMECA 由美国 Georgia 大学 Wayne Parrott 教授馈赠[6]。酿酒酵母 W303A(MATa;ade2-1;his -11,-15;leu2-3,-112;ura3-1;trp1-1)为本实验室保存。酵母表达载体 M4366 为美国犹他大学 David Stillman 教授馈赠[7];质粒 pMDADS 为本实验室构建,是将紫穗槐-4, 11-二烯合酶基因(ADS)克隆到pMD18-T 载体上重组而来;pGEMADH 为本实验室构建,是将酿酒酵母 ADH1 启动子序列克隆到pGEM-T 上得到的。
LB 培养基用于大肠杆菌的培养(10 g/L 胰蛋白胨、5 g/L酵母提取物、10 g/L NaCl;固体培养基添加 1.5% 琼脂粉);YPD 培养基(10 g/L 酵母抽提物、20 g/L 细菌蛋白胨、20 g/L 葡萄糖;固体培养基添加 2%的琼脂粉)用于酵母的培养;SC 培养基(7 g/L 无氨基酵母氮源、2 g/L drop-out 混合物、20 g/L 葡萄糖;固体培养基添加 2%的琼脂粉)用于酵母的胁迫培养。
1.2 方法
1.2.1 rDNA 基因的克隆 根据酵母 rDNA 序列,设计合成两对引物:FrDNA1/RrDNA1和FrDNA2/RrDNA2(表1)。
引物 FrDNA1/RrDNA1 配对,酵母基因组DNA 为模板,通过 PCR 扩增,得到长度为1137 bp的rDNA1 片段,通过 T-A 克隆将其连接到载体pMD18-T 中,得到载体 pMDr1,送样测序,与已经发表的rDNA1 序列完全一样。引物 FrDNA2/RrDNA2 配对,酵母基因组DNA 为模板,PCR 扩增得到长度为1111 bp的rDNA2 片段,通过 T-A克隆将其插入到载体 pMD18-T 中,得到重组质粒pMD-r2,送样测序,与已经发表的rDNA2 序列完全一样。
1.2.2 酵母整合载体的构建 ①用 SalI/EcoRI酶切 M4366和pMECA,连接得到 pMECAURA;②用 SacI/BglII 酶切pMDr1,得到长为1.1 kb的条带,克隆到用 SacI/BamHI 酶切的pMECAURA中,获得含 rDNA1 片段的载体 pMECAURAr1;③用 SmaI/ PstI 酶切 pMDr2,得到长为1.1 kb的rDNA2 片段,将其插入用同样两个酶切的pMECA 中,得到 pMECAr2;④用 XhoI/SwaI 酶切 pMECAr2 得到的片段与用 SalI/HpaI 酶切后的载体 pMECAURAr1 进行连接,得到重组载体pMECAURAR。载体构建涉及到的常规分子生物学实验技术,如质粒提取和酶切,DNA 纯化回收和连接,转化等可参考文献[8]。
1.2.3 含 ADS 基因的酵母整合载体的构建 用BamHI/XhoI 酶切 pMDADS和pGEMADH,然后连接成载体 pGEMADS。然后用 SacII/PvuI 酶切pGEMADS,得到一条长为3.4 kb的条带,将该片段插入用 SacII/PacI 酶切的载体 pMECAURAR中,得到含 ADS 基因的酵母重组质粒 pADSRDNA。载体构建涉及到的常规分子生物学实验技术,如质粒提取和酶切,DNA 纯化回收和连接,转化等参考文献[8]。
1.2.4 含 ADS 基因的整合体型酵母工程菌的构建及鉴定 通过 LiAc 法[9]将 pADSRDNA 转化酿酒酵母 W303A,转化产物涂布在SC-ura 筛选培养基上,28 ℃ 倒置培养 3~4 d,挑取克隆转接于含有 1 mg/ml的5-FOA和尿嘧啶的SC 固体培养基上,28 ℃ 倒置培养 3~4 d。挑取生长状况良好的克隆再次转接于含有 1 mg/ml的5-氟乳清酸和尿嘧啶的SC 固体培养基上,28 ℃ 倒置培养3~4 d。挑取生长状况良好的克隆接种在SC-ura筛选培养基上,28 ℃ 倒置培养 3~4 d。没有生长的克隆证明其 Ura3 基因失去了功能,是阳性克隆,表示为W303A[rDNA:ADS]。挑取这种克隆在SC 固体培养基(含 5-氟乳清酸和尿嘧啶)上的对应克隆进行后续的PCR 鉴定。
挑取 SC 固体培养基(含 5-氟乳清酸和尿嘧啶)上的阳性克隆接种到 10ml YPD 液体培养基中,28 ℃ 振荡培养 1~2 d,7000×g 离心 5 min收集菌体,提取酵母基因组。以酵母基因组为模板,ADS 基因特异的序列 AR2/AR3 为引物(表1)进行 PCR,以鉴定 W303A[rDNA:ADS]基因组中是否含有紫穗槐-4,11-二烯合酶基因。
1.2.5 酵母工程菌目的产物的发酵与鉴定 选取3 株筛选正确的W303A[rDNA:ADS]工程菌菌株接种到 10ml YPD 液体培养基中,28 ℃ 振荡培养到 OD600 达到 1.0。然后取 1ml 转接到 50ml新鲜的YPD 液体培养基中,同时加入 3ml 正十二烷覆盖培养,28 ℃ 培养 5 d,静置30 min,吸取 10 μl 正十二烷进行 GC-MS 定性定量检测。
GC-MS 检测仪器为Agilent6890-5975 气-质联用仪。色谱条件:DB-5ms 毛细管色谱柱(30 m×0.25 μm×0.25 mm);升温程序:初始温度 100 ℃,保持 2 min,以 5 ℃/min 升至 200 ℃后再以 25 ℃/min 升至 250 ℃,保持 10 min;进样口温度 250 ℃,分流进样(分流比 10∶1)1 μl;载气(氦气)流量 2ml/min,恒流模式;色谱-质谱接口温度 300 ℃。
质谱条件:EI 电离源;电子能量 70 eV;离子源温度 230 ℃;四极杆温度 150 ℃;溶剂延迟时间 5 min;质量扫描方式:全离子扫描;定量离子:m/z 204。
2 结果
2.1 整合体型载体 pMECAURAR的构建
成功构建了整合型酵母表达载体 pMECAURAR(图 1)。该载体的整合臂是 rDNA 序列,该序列在酵母基因组中存在多拷贝,这样保证目的基因能以多拷贝的形式整合到酵母基因组中。该载体中包含一个 hisG-URA-hisG结构,这样使得 URA3 标记能反复用于该工程菌中。
2.2 整合型载体 pADSRDNA的构建
将 ADS 基因表达盒序列插入整合载体Pmecaurar 中,得到了含 ADS 基因的酿酒酵母表达载体 pADSRDNA(图 2)。在该载体中,ADS 基因表达盒序列包括 ADH1 启动子,ADS 基因和ADH1 终止子序列。
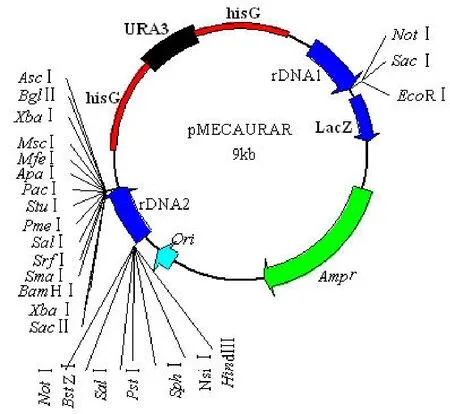
图1 pMECAURAR的质粒图谱Figure1 Plasmid map of pMECAURAR
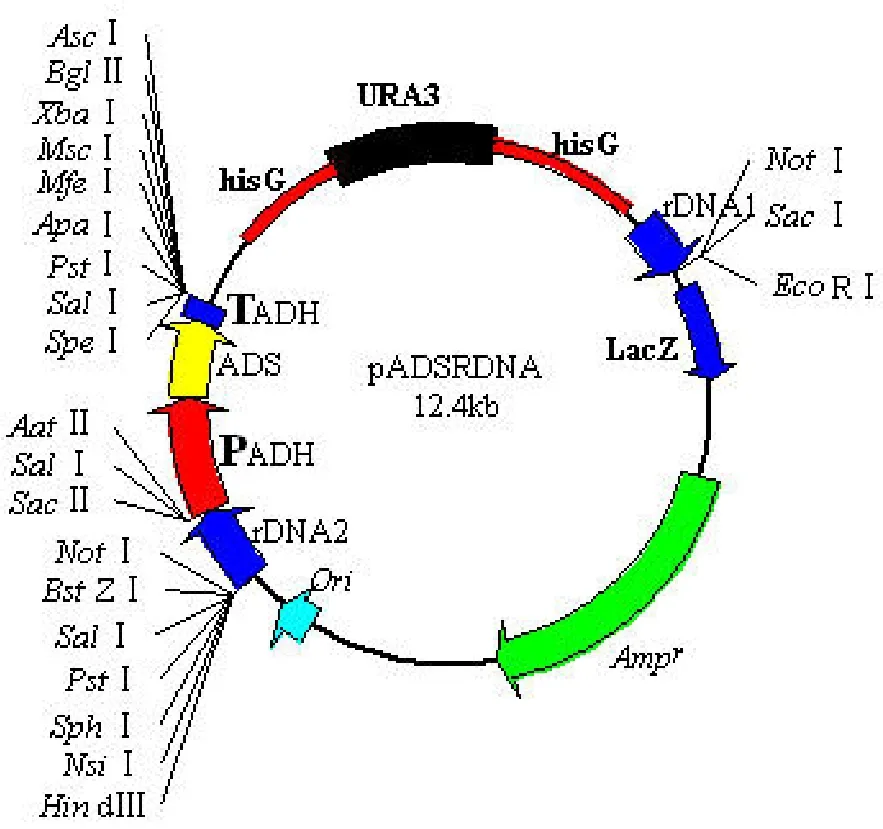
图2 pADSRDNA的质粒图谱Figure2 Plasmid map of pADSRDNA
2.3 酵母工程菌阳性克隆的鉴定
从图 3 可以看出,所鉴定的11个克隆中,都扩增得到了长约 1650 bp的条带,与理论值相符,由此证明这 11个克隆都是阳性克隆,其中都整合了 ADS 基因全长。
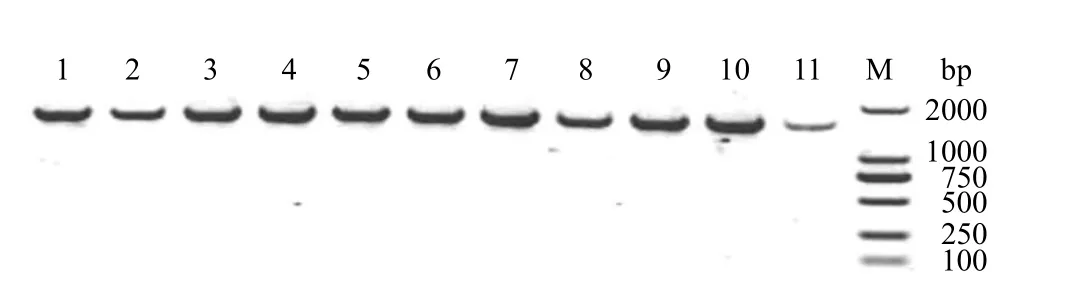
图3 整合体型酵母工程菌中 ADS 基因 PCR结果Figure3 PCR analysis of ADS gene in engineered yeasts
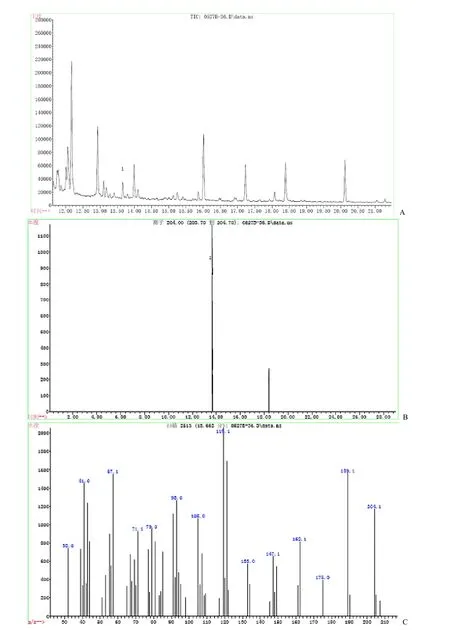
图4 酵母工程菌发酵产物的GC-MS 鉴定Figure4 GC-MS analysis of amorpha-4,11-diene generated by S.cerevisiae W303A[rDNA:ADS]
2.4 GC-MS检测紫穗槐-4,11-二烯
选取 3 株筛选正确的W303A[rDNA:ADS]工程菌菌株进行发酵培养。培养合适的时间后,吸取发酵培养过程中的正己烷覆盖层进行气相色谱分析,总离子流图如图 4A 所示。由于紫穗槐-4,11-二烯的分子离子峰是204,因此,选择m/z204进行选择离子扫描,结果如图 4B 所示,得到两个没有干扰的色谱峰,其中标记为“1”的色谱峰的质谱图如图 4C 所示,与已知的紫穗槐-4,11-二烯标准品的质谱图完全吻合,表明发酵产物中产生了紫穗槐-4,11-二烯。以朱栾倍半萜为标准品,绘制标准曲线,对发酵产物中的紫穗槐-4,11-二烯进行定量,紫穗槐-4,11-二烯产量达到(91.33±7.57)mg/L。
3 讨论
将外源基因通过同源置换整合到酵母基因组上,主要有两种方式,一种是构建含目的基因的酿酒酵母表达载体,接着通过酶切,将含有整合位点序列的片段线性化,然后通过同源交换的方式将该线性化的片段整合到酵母染色体上。早期的酵母同源整合都采用的是这种方式,但这种方式需要频繁地构建载体,酶切,纯化回收 DNA 片段,操作繁琐,且需要消耗大量的酶来制备线性化片段,因此,现在科研人员更多地采用第二种方式进行外源基因的同源整合。这种方式就是 PCR 介导的同源置换,在这种基因敲除方式中,整合片段不需通过酶切,只需要通过一对含有同源整合位点的引物,以含有目的基因的载体为模板,通过 PCR 就可以简单获得大量的整合产物,和第一种方式相比,这种方式操作简单,现在已经被广泛运用到酿酒酵母的同源整合中[2-4],在以酿酒酵母为宿主菌的天然产物合成生物学研究中,往往采用这种方式快速地在酿酒酵母中构建稳定的天然产物生物合成途径[2]。但这种方式也存在一定的缺陷,比如插入片段的保真性问题。因此,构建一种同源整合载体,既不需要通过消耗过多的内切酶进行线性化处理,又能有效地避免 PCR 过程所带来的片段保真性问题。本实验基于上述目的,构建了一个以 rDNA 为整合位点的酵母整合载体,该载体不需要经过酶切线性化就能将克隆到该载体上的目的基因整合到 rDNA位点上。
近些年来,随着酵母分子遗传学的发展,人们发展了多种策略来提高整合目的基因的拷贝数,如将同一个目的基因整合到酿酒酵母的不同位点;或者将目的基因整合到酿酒酵母基因组中的高拷贝位点上,如 rDNA 序列[10-11]。这些措施逐步改善了整合载体拷贝数低的不足,有力地促进了酿酒酵母代谢工程的发展。本实验构建的酵母整合载体便是以 rDNA 为整合位点,这样,在保持整合载体稳定性的优点外,本试验构建的载体还能确保整合目的基因的高拷贝性,有利于目的基因表达水平的提高和目的产物产量的提高。
在酿酒酵母中,能够利用的氨基酸营养缺陷标记不是特别多,不利于多个目的基因的整合,本试验构建的酿酒酵母整合载体中,含有 HisG-Ura3-hisG 序列,这样保证了营养缺陷标记能被反复地应用,无疑增加了整合目的基因的个数,有利于天然产物代谢途径在酿酒酵母中的稳定重构。
为了验证所构建载体的效率,本项目将青蒿紫穗槐-4,11-二烯合酶基因克隆到该载体上,然后将该整合载体在没有线性化的情况下转化酿酒酵母,试验表明,ADS 基因已经整合到了酿酒酵母基因组上,而且能够产生紫穗槐-4,11-二烯,表明本实验构建的整合载体是非常有效的。
以前构建的以 rDNA 为整合臂的载体,有的需要利用酶切进行线性化[11],有的不能重复整合[10]。而本试验构建的酿酒酵母表达载体克服了上述不足,具有如下特点:①能将外源基因表达盒序列整合到酿酒酵母 rDNA 序列上,增加目的基因的拷贝数;②选择标记能反复应用,方便获得多拷贝的整合形式;③整合片段不需要酶切线性化,节省了内切酶,而且简化了操作程序。并且验证了这个载体的功能,为工程菌的构建贮备了出发质粒。
[1]Burke D, Dawson D, Stearns T.Methods in yeast genetics - a cold spring harbor laboratory course manual.2000 ed.New York: Cold Spring Harbor Laboratory Press, 2000.
[2]Ro DK, Paradise EM, Ouellet M, et al.Production of the antimalarial drug precursor artemisinic acid in engineered yeast.Nature, 2006,440(7086):940-943.
[3]Lindahl AL, Olsson ME, Mercke P, et al.Production of the artemisinin precursor amorpha-4,11-diene by engineered Saccharomyces cerevisiae.Biotechnol Lett, 2006, 28(8):571-580.
[4]Lenihan JR, Tsuruta H, Diola D, et al.Developing an industrial artemisinic acid fermentation process to support the cost-effective production of antimalarial artemisinin-based combination therapies.Biotechnol Prog, 2008, 24(5):1026-1032.
[5]Petes TD.Yeast ribosomal DNA genes are located on chromosome XII.Proc Nati Acad Sci U S A, 1979, 76(1):410-414.
[6]Thomson JM, Parrott WA.pMECA: a cloning plasmid with 44 unique restriction sites that allows selection of recombinants based on colony size.Biotechniques, 1998, 24(6):922-928.
[7]Voth WP, Richards JD, Shaw JM, et al.Yeast vectors for integration at the HO locus, Nucleic Acids Res, 2001, 29(12):E59.
[8]Sambrook J.Molecular Cloning: A Laboratry Manual, 3rd ed.New York: Cold Spring Harbor Lab Press, 2001.
[9]Gietz RD, Schiestl RH, Willems AR, et al.Studies on the transformation of intact yeast cells by the LiAc/ss-DNA/PEG procedure.Yeast, 1995, 11(4):355-360.
[10]Kim JH, Kim HR, Lim MH, et al.Construction of a direct starch-fermenting industrial strain of Saccharomyces cerevisiae producing glucoamylase, alpha-amylase and debranching enzyme.Biotechnol Lett, 2010, 32(5):713-719.
[11]Shen Y, Zhang Y, Ma T, et al.Simultaneous saccharification and fermentation of acid-pretreated corncobs with a recombinant Saccharomyces cerevisiae expressing beta-glucosidase.Bioresour Technol, 2008, 99(11):5099-5103.
