利用光波导模式光谱生物传感器研究二级结构对固-液界面DNA杂交动力学的影响
2011-12-01钟连声齐华文潘忠诚马汝海何群姜雪赵雨杰
钟连声,齐华文,潘忠诚,马汝海,何群,姜雪,赵雨杰
随着人类基因组学研究的不断进展,基因芯片正逐步成为检测基因表达最强大的分子生物学技术方法。其中寡核苷酸探针芯片制备比较容易,相对成本较低,并且特异性强。各个位点间的变异比较小,杂交后结果的准确性和重现性比长探针芯片好。
目前美国 affymatrix公司和国内一些研究机构多使用 25-mer 寡核苷酸(Oligo)探针制作基因芯片。尽管寡核苷酸芯片具有很多优点,应用也越来越广泛,但科学家们发现,基因芯片杂交结果的重现性仍然不是十分理想。Zhang等[1]研究表明近70% 检测相同基因的探针阵列点杂交信号数值出现明显偏差。很多学者认为:除了基因芯片设计和制备因素以外,最重要的原因是基因芯片杂交过程的特殊性造成的。因为基因芯片杂交是在固-液界面完成的,与溶液中的核酸杂交不同,探针及靶分子的二级结构会对芯片的杂交结果产生影响。鉴于此,我们设计了一组具有不同二级结构的探针和靶分子,以探讨不同二级结构的探针和靶分子对基因芯片杂交过程的影响。
1 材料与方法
1.1 材料
探针及靶分子均由南京金斯瑞生物科技有限公司合成。OWLS 1.20 及传感器芯片为匈牙利Micro Vacuum公司产品;Gene TACTMLS IV 荧光图像扫描仪为美国 Gnomic Solutions公司产品;202-0 数显电热恒温干燥箱为上海阳光实验仪器有限公司产品。硅烷偶联剂 SCA-1103(3-氨丙基三甲氧基硅烷)购自国泰华荣化工新材料有限公司;戊二醛购自美国 Sigma公司。
1.2 方法
1.2.1 探针及靶分子的设计 为了系统研究二级结构对芯片杂交过程的影响,应用二级结构分析软件 Mfold 分别设计了 3 对 25-mer 完全互补的具有不同二级结构的探针和靶分子(P0T0、P3T3、P4T4),以及1 对尾端有 2个碱基错配的探针和靶分子(P4T3),其序列见表1(下划线示茎环结构的干)。其中 P0T0完全互补,Tm值小于20 ℃,说明其在37 ℃ 溶液中不会形成二级结构;P3T3和P4T4也完全互补,但 P3T3形成的茎环结构含有 3 bp的茎、5 bp的环和2个长分别为4 bp和10 bp的尾巴,P4T4形成的茎环结构含有 4 bp的茎、10 bp的环和1个 6 bp的尾巴(图 1);而 P4T3含有 2个末端的不匹配碱基(A·A、C·C)。
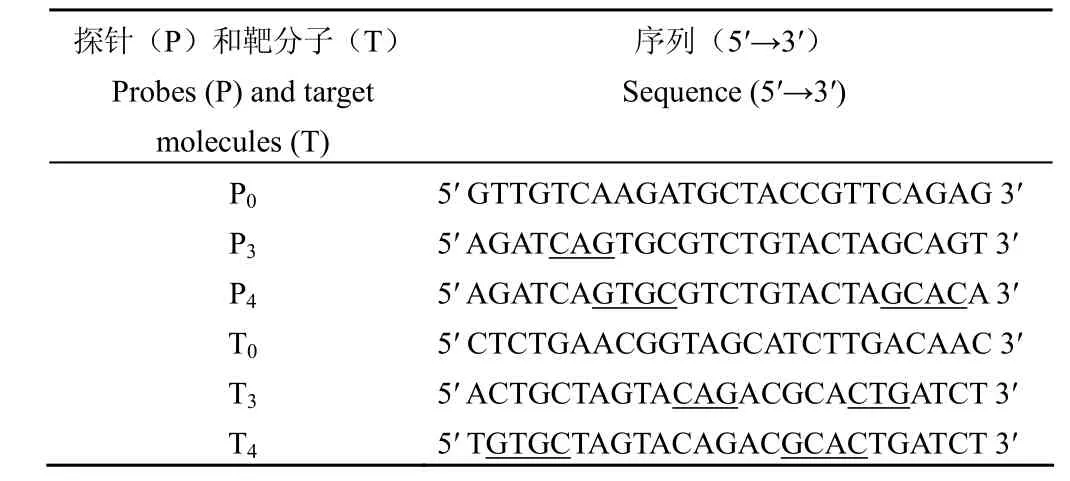
表1 探针和靶分子的序列Table1 Sequence of target molecules and probes
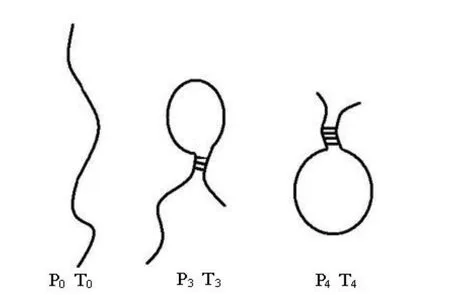
图1 探针和靶分子(P0T0、P3T3、P4T4)在溶液中的二级结构示意图Figure1 The secondary structure of probes and target molecules (P0T0, P3T3, P4T4) in solution
1.2.2 醛基化传感器芯片的制备 将传感器芯片放入重铬酸钾硫酸洗液中浸泡 10 min,1 mol/L NaOH 浸泡 1 h,无水乙醇冲洗脱水;2.5%的硅烷偶联剂浸泡 10 min,入烘箱 104 ℃ 烘烤 1 h;2.5% 戊二醛浸泡 4 h,吹干备用。
1.2.3 探针和靶分子溶液的制备 将各探针和靶分子分别溶于含有 0.12 mol/L MgCl2、0.01 mol/L Tris·HCl的混合溶液(pH 7.6)中,调整探针的终浓度分别为1、2、5、10、20 µmol/L,靶分子的终浓度分别为0.1、0.2、0.5、1.0、2.0、5.0 µmol/L,并以 Cy5 标记靶分子。
1.2.4 最佳杂交条件分析 实验所用溶液都经过100 ℃ 加热 30 min和超声 10 min 处理,以去除溶液中溶解的气体。
1.2.4.1 最佳杂交探针浓度 取各浓度探针 2 µl固定在醛基化传感器芯片中央,37 ℃ 温箱中孵育1 h,置于含有 0.12 mol/L MgCl2、0.01 mol/L Tris·HCl的混合溶液(pH 7.6)中浸泡过夜后,安装至 OWLS上。用含有 0.12 mol/L MgCl2、0.01 mol/L Tris·HCl的混合溶液(pH 7.6)为载液冲洗传感器芯片至基线水平(NTM和NTE 模式导数小于10-8/s),流速为1 µl/min。将浓度为5 µmol/L的Cy5 标记靶分子 120 µl 注入 OWLS的加样环(容积为100 µl)中杂交 1 h。用荧光图像扫描仪进行扫描,检测各浓度探针杂交后荧光信号强度,确定最佳杂交探针浓度。
1.2.4.2 最佳杂交靶分子浓度 以最佳杂交探针浓度构建芯片,分别将各浓度 Cy5 标记的靶分子溶液注入 OWLS,杂交 1 h。用荧光图像扫描仪进行扫描,检测各浓度靶分子杂交后荧光信号强度。
1.2.5 传感器芯片质量验证 将已醛基化的传感器芯片安装在OWLS 上,用含有 0.12 mol/L MgCl2、0.01 mol/L Tris·HCl的混合溶液(pH 7.6)冲洗芯片120 min,流速保持为1 µl/min。将 10 µmol/L 探针注入 OWLS的加样环,待基线平稳后将 1 µmol/L靶分子注入加样环,OWLS 监测传感器芯片表面质量变化。
1.2.6 传感器芯片的化学法再生 选取 0.4%SDS和0.1% NaOH 分别处理杂交后的传感器芯片 10、20、30、60 min,用荧光图像扫描仪进行扫描,检测杂交后荧光信号强度。实验重复 5 次。
1.2.7 杂交复合物质量与杂交效率测定 为避免与探针结合而降低靶分子浓度,确保其浓度稳定,将靶分子进样速度分别控制在15 µl/h、180 μl/h,并依次在杂交 7 h、0.5 h 后冲洗,以 OWLS 测定完全杂交后芯片表面探针与靶分子结合形成的杂交复合物的质量;测定固定时间内各杂交复合物的杂交效率,即计算芯片表面结合的靶分子质量占芯片表面结合的探针质量的百分比;并用 Curve Expert 软件进行数据分析。
2 结果
2.1 最佳杂交条件
2.1.1 探针浓度的选择 将浓度为1、2、5、10、20 µmol/L的探针固定于芯片表面,加入 5 µmol/L Cy5 标记的靶分子进行杂交 1 h,荧光图像扫描结果显示探针浓度为5 µmol/L 时,芯片杂交荧光信号达到饱和(图 2)。为保证芯片表面探针数量达到饱和,后续实验我们采用了浓度为10 µmol/L的探针构建芯片。
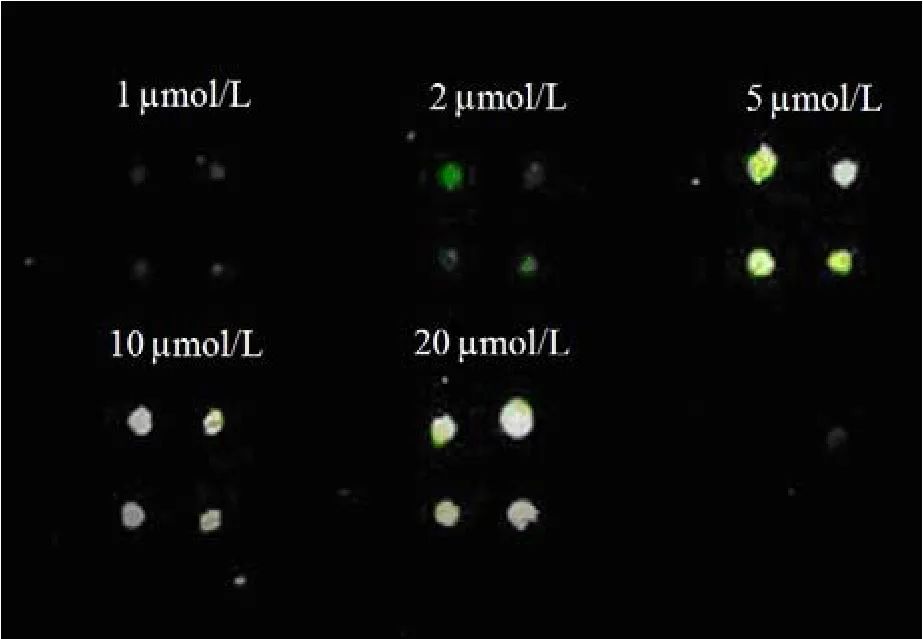
图2 不同浓度探针与5 µmol/L 靶分子杂交的荧光扫描Figure2 The hybridization fluorescence image of different concentrations of probes and 5 μmol/L target molecule
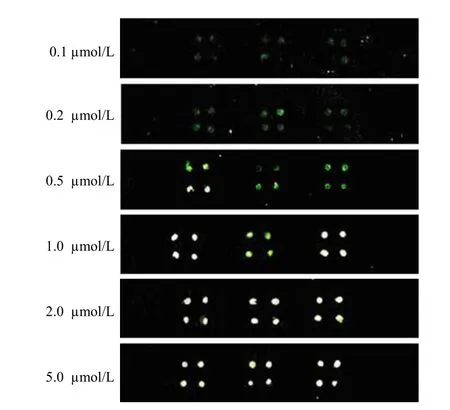
图3 10 µmol/L 探针与不同浓度靶分子杂交的荧光扫描Figure3 The hybridization fluorescence image of 10 μmol/L probe and different concentrations of target molecules
2.1.2 靶分子浓度的选择 以浓度为10 µmol/L的探针构建芯片后,分别加入浓度为0.1、0.2、0.5、1.0、2.0、5.0 µmol/L的Cy5 标记的靶分子杂交 1 h,荧光图像扫描结果显示靶分子浓度为1 µmol/L 时,芯片杂交荧光信号达到饱和(图 3)。
2.2 传感器芯片质量验证
以 OWLS 实时监测醛基化传感器芯片表面探针与靶分子的杂交过程,在A 点加入探针,在B点开始冲洗,待基线稳定后在C 点加入靶分子,D点冲洗,建立结合模型(图 4)。
将与探针完全互补的荧光标记靶分子滴入已固定探针的传感器芯片与之进行杂交,荧光图像扫描结果显示杂交荧光信号非常清晰(图 5A);而将与探针完全不互补的荧光标记靶分子滴入传感器芯片与之进行杂交,荧光图像扫描结果显示无杂交荧光信号(图 5B),说明传感器芯片构建成功。
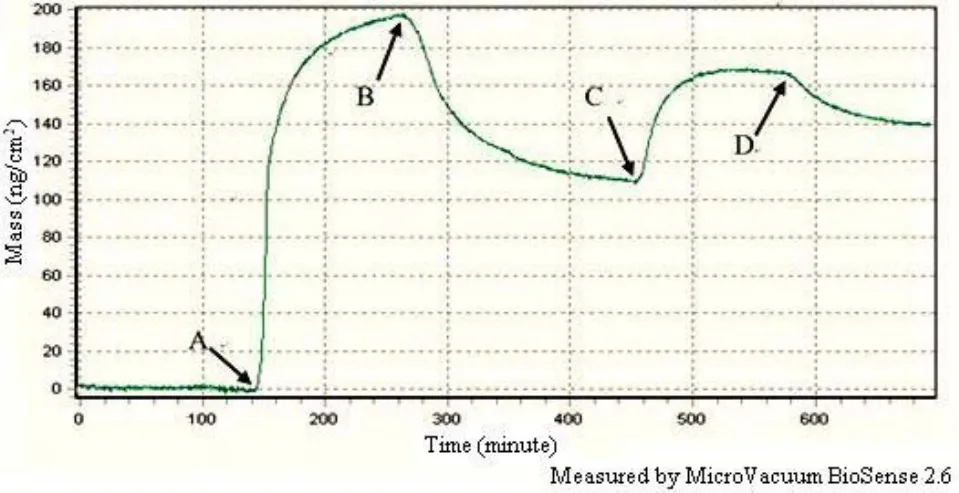
图4 OWLS 实时监测传感器芯片表面探针(10 µmol/L)与靶分子(1 µmol/L)的杂交过程(A:加入探针;B:冲洗;C:加入靶分子;D:冲洗)Figure4 Monitored the hybridization process of probe (10µmol/L) and target molecule (1 µmol/L) on the sensor chip surface.(A: Injected probe; B: Washing; C: Injected target molecule; D: Washing)
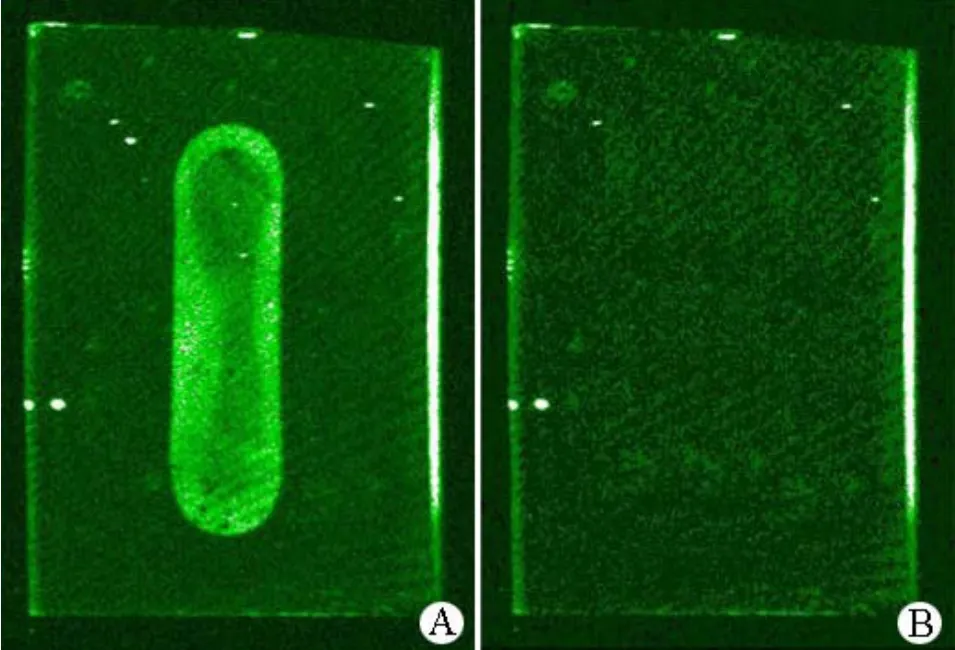
图5 探针与靶分子杂交的荧光图像扫描结果(A:探针与靶分子完全互补;B:探针与靶分子完全不互补)Figure5 The hybridization fluorescence image of probe and target molecule.(A: Probe completely matched with target molecule; B: Probe completely mismatched with target molecule)
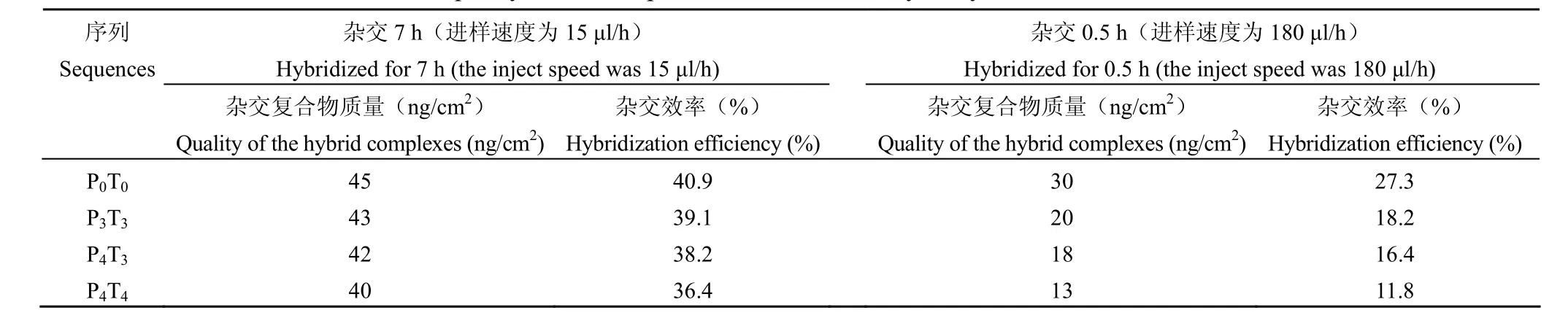
表2 杂交不同时间后形成的杂交复合物质量与杂交效率Table2 The quality of the complexes and the efficiency of hybridization for different time
2.3 传感器芯片的最佳再生条件
选取了 2 种芯片再生方法:0.4% SDS和0.05% NaOH。将杂交后芯片分别浸入上述 2 种溶液中 10、20、30、60 min。荧光图像扫描结果显示,用 0.05% NaOH 处理 30 min 即可达到芯片再生的目的,且重复 5 次后的杂交荧光信号强度依然没有明显改变,表明芯片具有再生稳定性,至少可以重复使用 5 次。
2.4 杂交复合物质量与杂交效率
将靶分子进样速度控制在15 µl/h,杂交 7 h后,OWLS 检测结果显示芯片表面形成的P0T0、P3T3、P4T4、P4T3杂交复合物的质量都在40~45 ng/cm2之间,相当于每 100 nm2芯片面积上结合了 3个靶分子;但完全不互补的P0T4杂交复合物的质量为0,说明与探针非特异性结合的靶分子可被完全洗掉。将靶分子进样速度控制在180 μl/h,杂交 0.5 h 后,OWLS 检测结果显示芯片表面形成的P0T0、P3T3、P4T4、P4T3杂交复合物的质量分别为30、20、13、18 ng/cm2(表 2)。
用 Curve Expert 软件对杂交 7 h 后OWLS所得数据进行曲线拟合分析,4组探针与靶分子的杂交过程均符合朗缪尔一级方程(相关系数 R >0.98):M(t)=Mmax{1-exp[–(K×C×t)]},式中Mmax为探针与靶分子形成的杂交复合物的最大质量;K 为反应速率常数;C 为靶分子浓度。由此方程可得出4组探针与靶分子杂交结合的K值(表 3)。

表3 杂交7h后探针与靶分子杂交结合反应速率常数(K)Table3 The reaction rate constants of probes and target molecules hybridization for 7 h (K)
3 讨论
随着基因芯片杂交机制研究越来越深入,研究者们发现探针及靶分子的互补程度、pH 值、离子强度、温度等是影响芯片杂交的重要因素。但在上述条件都相同的前提下,芯片的杂交效率也不尽相同。对此,我们分析探针及靶序列的二级结构可能是影响芯片杂交的另一重要因素,并在本实验中应用 OWLS 实时分析了探针及靶分子的二级结构对芯片杂交效率的影响。
Gao等[2]学者认为随着探针和靶分子二级结构的增加,即使是完全杂交,形成的杂交复合物质量也会降低。而本实验结果显示,只要杂交时间足够长,完全杂交后,无论探针和靶分子有何种茎环结构,最终在芯片表面形成的杂交复合物质量都是一定的。分析其原因可能是探针与靶分子杂交后,原有的二级结构被破坏,进而降低了由特殊二级结构带来的空间位阻。但随着探针和靶分子二级结构的增加,没有特殊二级结构的P0T0杂交速率常数为0.465×105L/(mol·s),而 P4T4的杂交速率常数为0.081×105L/(mol·s),杂交速率显著降低,对原有二级结构的破坏过程可能是降低杂交速率的主要因素。此外,在3′ 末端出现的2个碱基的错配也会影响杂交速率,这可能是因解离常数增大导致的。
但在一定时间内(0.5 h),随着茎环结构中茎和环碱基数目的增多,尾巴碱基数目的减少,杂交所需要的时间延长,杂交效率降低;而随着茎环结构中茎和环碱基数目的减少,尾巴碱基数目的增多,杂交所需要的时间缩短,杂交效率升高。其原因可能是特殊的二级结构会增加空间位阻,进而使反应速率降低。茎环结构中尾巴碱基的数目也是影响杂交的另一因素,通过本实验的结果可以看出尾巴越长,杂交效率越高,其原因可能是随着尾巴碱基数目的增加,探针和靶分子结合的概率也就越大,进而加快了杂交效率。在3′ 末端出现的2个碱基的错配会略微影响杂交的效率,但不及特殊二级结构带来的影响大。由此提示在进行基因芯片探针设计时,要避免二级结构的出现;在不可避免的情况下,要尽量增加尾巴碱基的数目。而在探针 3′末端出现少量的碱基错配,并不会很明显地影响探针与靶分子的杂交。
目前,国内外学者应用非标记手段研究基因芯片杂交过程的方法主要是 SPR(surface plasmon resonance)技术[3-5]。但 SPR 技术是通过巯基将探针固定在金表面,进而检测金表面探针结合靶分子的质量,这与国内外常用的基因芯片不同,不能完全模拟基因芯片的杂交过程。OWLS 所使用的传感器与常见的基因芯片一致,通过探针上的醛基与基因芯片表面的氨基结合固定探针,可以实现非标记、实时、定量检测传感器芯片表面结合物质的质量。但目前 OWLS 主要被用来检测蛋白与蛋白之间的相互作用,用其检测 DNA 之间相互作用的研究还未见报道。另外,根据具有特殊结构 DNA能与金属离子相结合的特性,设计不同的探针,还可以应用 OWLS 对溶液中 Cu2+、Zn2+等离子进行定量分析。
综上,本研究应用 OWLS 建立了一种可以检测基因芯片杂交过程的新方法,可以实现对基因芯片表面探针与靶分子结合形成杂交复合物的质量进行实时、定量的检测,证实了探针及靶分子的二级结构也是影响芯片杂交的另一重要因素,为研究固-液界面 DNA 之间的杂交过程提供了一个新的技术平台。
[1]Zhang L, Yoder SJ, Enkemann SA.Identical probes on different high-density oligonucleotide microarrays can produce different measurements of gene expression.BMC Genomics, 2006, 7:153.
[2]Gao Y, Wolf LK, Georgiadis RM.Secondary structure effects on DNA hybridization kinetics: a solution versus surface comparison.Nucleic Acids Res, 2006, 34(11):3370-3377.
[3]Kick A, Bönsch M, Katzschner B, et al.DNA microarrays for hybridization detection by surface plasmon resonance spectroscopy.Biosens Bioelectron, 2010, 26(4):1543-1547.
[4]Bishop J, Chagovetz AM, Blair S.Kinetics of multiplex hybridization:mechanisms and implications.Biophys J, 2008, 94(5):1726-1734.
[5]Yu F, Yao D, Knoll W.Oligonucleotide hybridization studied by a surface plasmon diffraction sensor (SPDS).Nucleic Acids Res, 2004,32(9):e75.
