猴痘病毒PCR检测方法的建立
2011-11-18陈国强张敬友唐泰山
张 睿,陈国强,张敬友,朱 娜,蒋 原,姜 焱,唐泰山
(江苏出入境检验检疫局,江苏南京 210001)
1958年,人们就已在实验猕猴中发现猴痘病毒[1]。自1970年首次报导扎伊尔地区出现人的猴痘病例以后,非洲中西部雨林国家都有零星病例发生[2],特别是1996年2月至1997年10月在刚果发生了有史以来的最大的一次疫情暴发,确诊病例达511人[3-4],2003年5月美国威斯康星州报导有猴痘病例的发生[5-6],至此猴痘引起了人们的高度关注。
猴痘是动物传播的一种以皮肤出疹为特征的热性病毒性疾病,通过直接密切接触,可由动物传染给人,并可在人与人之间传染,属人畜共患传染病。猴痘病毒检测方法有血清学方法,但猴痘病毒与痘病毒之间存在抗原交叉,特异性不够,不能准确检测猴痘病毒,此外还有病原分离方法,但检测周期太长,且猴痘病毒被分类为生物安全Ⅲ级生物因子,对实验室生物安全要求极高。因此,两种方法在实际应用中存在一定的局限性。利用PCR方法对猴痘病毒核酸进行检测,灵敏度高,快速仅需几小时即可得到结果,国外也已有相关报导[7-10],但国内就此方面的报道还为数不多。本试验旨在建立更敏感和特异的猴痘病毒PCR检测方法。
1 材料与方法
1.1 材料
猴痘阳性模板为人工合成的MPV(AF380138)F3L基因片段(48 048~48 509 bp),插入质粒pUC57,由南京生兴生物技术公司合成。小鼠出血热病毒、小鼠淋巴细胞脉络丛脑膜炎病毒、鼠痘病毒、鼠仙台病毒、鼠肝炎病毒、鼠肺炎病毒、呼肠孤病毒、脑脊髓炎病毒、多瘤病毒、细小病毒、猴疱疹病毒Ⅰ型、羊痘、鸡痘、鸽痘等灭活病毒,购自中国药品生物制品检定所动物标准化室。
Taq酶、dNTP Mixture、溴化乙锭(EB)、Marker DL-2000、琼脂糖等试剂均由Takara公司生产;PCR凝胶回收试剂盒、HincⅡ限制性内切酶购自大连Takara公司 。
1.2 引物设计
根据猴痘阳性模板的序列,利用primer 5.0软件设计引物,由上海生工公司合成。合成的引物用双蒸水稀释至10 pmol/μL,-20℃保存备用。扩增目的片段为301 bp,引物序列如下。
上游引物:5'TTCCGTCAATGTCTACACAGGCA 3';
下游引物:5'TACAGTTCCGACGATACTCCTC C 3'。
1.3 DNA提取
取阴性对照灭活病毒200μL,加入400μL裂解液、600μL的酚/氯仿混合液混匀,4℃12 000 r/min离心3~5 min;取上清加入600μL的氯仿混匀,4℃12 000 r/min离心5 min;取上清;加入0.8倍体积的异丙醇混匀,4℃10 000 r/min离心10 min,尽量倾去上清液;加入70%乙醇洗涤,离心3~5 min,晾干后加入50μL TE溶解沉淀。
1.4 质粒浓度的测定
取4μL提取的质粒,加入96μL的蒸馏水对待测的样品进行稀释,以蒸馏水作为空白,在波长260 nm处调节紫外分光光度计的读数至零。加入质粒的稀释液,测定260 nm处的吸光值,记录OD260的值通过计算确定浓度dsDNA=50×OD260×稀释倍数(浓度单位为:mg/mL)。
1.5 PCR反应
采用 20μL 的反应体系:2μL 10×buffer、0.4μL的25 mmol/LMgCl2、0.2μLTaq DNA聚合酶、上下游引物各 0.4μL、0.4μL 2.5 mmol/L dNTP、模板 0.5μL,用双蒸水补至20μL。PCR反应程序:95℃预变性5 min后;95℃1 min,51℃1 min,72℃1 min共 35个循环;最后72℃延伸10 min。取8μL扩增产物用1.5%琼脂糖电泳观察结果。
1.6 PCR产物鉴定及序列测定
根据设计的PCR扩增序列,利用premier 5.0软件进行酶切位点的分析,其中HincⅡ为单酶切位点,所以采用此酶进行酶切分析。预期酶切成179 bp和122 bp 2个DNA片段。并同时将PCR产物送大连宝生物工程公司测序并用DNAstar软件分析。
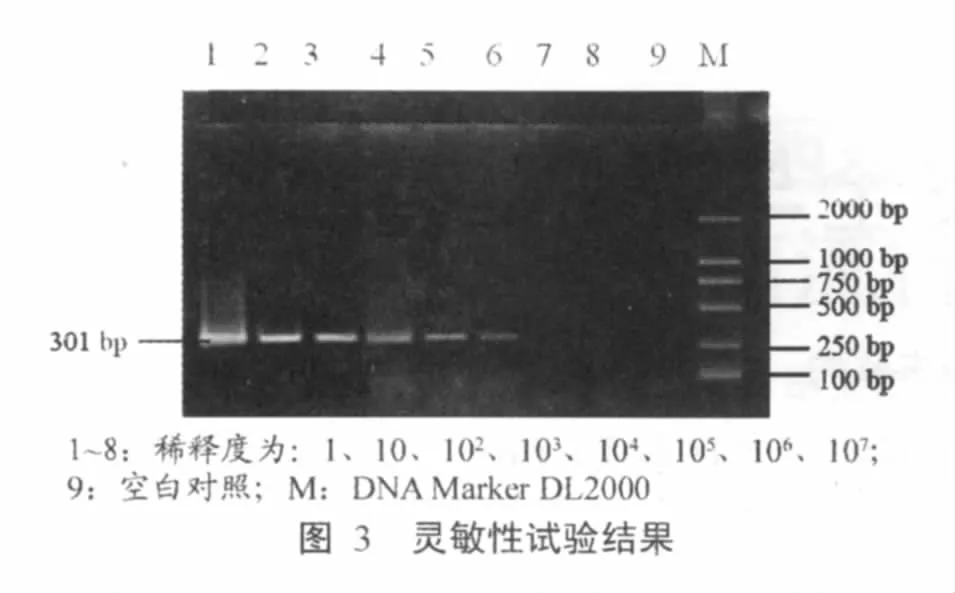
1.7 敏感性
取阳性模板质粒4μL并按上面的实验方法测出其质粒浓度为59.3 ng/μL,并将阳性模板作10倍系列稀释,按照上述的方法分别取各稀释度的阳性模板,进行PCR扩增,PCR产物经琼脂糖凝胶电泳,溴化乙锭染色检测灵敏性。
1.8 特异性
按上述试验方法提取鸡痘等灭活病毒的DNA,在相同的条件下进行PCR扩增,鉴定其特异性。
2 结果
2.1 PCR扩增
经过对引物浓度、Mg2+浓度、退火温度和时间进行优化后,用所设计的引物进行PCR扩增,能扩增出与设计目的片段大小一致的特异性条带(图1)。

2.2 PCR产物酶切鉴定结果
用HincⅡ进行酶切分析,得到与预期一致的179 bp和122 bp 2个DNA片段(图2)。

2.3 敏感性
将阳性模板作10倍系列稀释,分别取各稀释度的阳性模板,进行PCR扩增,PCR产物经琼脂糖凝胶电泳,溴化乙锭染色检测灵敏性。结果表明PCR检测方法可检测的下限为0.3 pg(图3)。
2.4 特异性
分别提取鸡痘等灭活病毒的DNA,在相同条件下进行PCR扩增,发现除猴痘模拟阳性模板出现特异性扩增条带外,其它病毒均没有扩增条带(图4)。

2.5 PCR产物测序结果
PCR扩增产物的测序结果与GenBank的F3L片段基因核苷酸序列完全一致,同源性达到100%。

3 讨论
猴痘是一种以皮肤出疹为特征的病毒性疾病,虽然在我国至今尚无猴痘的报道,但未雨绸缪,做好技术储备,很有必要。因此在我国发展一种快速特异的猴痘病毒感染的分子诊断方法,对预防和控制猴痘病毒的传入有重要意义。限于我国尚无猴痘病毒的毒种,本实验参照文献[11-12]人工合成了含特异检测猴痘病毒靶基因的F3L片段,并插入质粒,作为猴痘病毒检测的模拟阳性模板。
本文就针对F3L片段序列分别设计出特异性引物,建立了可对猴痘病毒进行快速诊断与检测的PCR方法。该方法具有快速、敏感的优点,测序结果和酶切结果均证实了PCR反应的特异性。在日常检测中的应用酶切试验,可确保PCR检测结果的特异性。该方法的建立将有助于猴痘病的快速检测。
[1]Arita I,Jezek Z,Khodakevich L,et al.Human monkeypox:a newly emerged orthopoxvirus zoonosis in the tropical rain forests of Africa[J].Am J Trop Med Hyg,1985,34(4):781-789.
[2]Jezek Z,Grab B,Paluku K M,et al.Human monkeypox:disease pattern,incidence and attack in a rural area of northern Zaire[J].Trop Geogr Med,1988,40(2):73-83.
[3]Landy ID,Ziegler P,Kima A.A human infection caused by monkeypox virus in Basankusu Territory,Democratic Republic of the Congo[J].Bull WHO,1972,46(5):593-597.
[4]Heymann D L,Szczeniowski M,Esteves K.Re-emergence of monkeypox in Africa:a review of the past six years[J].Br Med Bull,1998,54(3):693-702.
[5]Hutin Y J,Williams RJ,Malfait P,et al.Outbreak of human monkeypox,Democratic Republic of Congo,1996 to 1997[J].EID,2001,7(3):434-438.
[6]修文琼.2003年美国多个州发生猴痘暴发[J].海峡预防医学杂志,2004,10(3):78.
[7]Neubauer H,Reischl U,Ropp S,et al.Specific detection of monkeypox virus by polymerase chain reaction [J].J Virol Methods,1998,74(2):201-207.
[8]Meyer H,Ropp SL,Esposito JJ.Gene for A-type inclusion body protein is useful for a polymerase chain reaction assay to differentiate orthopoxviruses[J].JVirol Methods,1997,64(2):217-221.
[9]Ropp S L,Jin Q,Knight J C,et al.PCR strategy for identification and differentiation of small pox and other orthopoxviruses[J].JClin Microbiol,1995,33(8):2069-2076.
[10]Lbrahim M S,Esposito JJ,Jahring PB,et al.The potential of 5’nuclease PCR for detecting a single-base polymorphism in Orthopoxvirus[J].Mol Cell Probes,1997,11(2):143-147.
[11]周为名,谭文杰,郑楠,等.猴痘、天花病毒感染快速分子诊断荧光定量实时PCR方法的建立[J].生物技术通讯,2006,17(5):703.
[12]Kulesh D A,Baker RO,Loveless BM,et al.Smallpox and pan-orthopox virus detection by real-time 3’minor groove binder TaqMan assays on Roche Light Cycle and the Cepheid Smart Cycler Platforms[J].JClin Microbiol,2004,42(2):601-609.
