猪胸膜肺炎放线杆菌PCR快速分型系统的建立及应用
2011-11-18邱索平何孔旺刘中勇林志雄
邱索平,何孔旺,刘中勇,林志雄,陈 文
(1.从化出入境检验检疫局,广东从化 510900;2.江苏省农业科学院兽医研究所,江苏南京 210014;3.广东出入境检验检疫局,广东广州 510623)
猪胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,App)引起的猪接触传染性胸膜肺炎,广泛存在于各年龄段猪。该病全球范围内广泛存在,是猪主要的传染性呼吸道疾病,导致养猪业巨大的经济损失[1]。该病的病理特征是纤维素性胸膜肺炎,肺血管内血栓引起的肺纤维素性坏死性病灶。荚膜(CP)、脂多糖(LPS)、外膜蛋白(OMP)、毒素(Apx)、转铁蛋白(Tbp)、蛋白酶、渗透因子、菌毛等是其主要毒力因子。根据培养过程中App对NAD的依赖性将其分为两个生物型:NAD依赖性的生物Ⅰ型和NAD非依赖性的生物Ⅱ型[2]。生物Ⅱ型(App13,App14)虽然也可使猪致病,但毒力比生物Ⅰ型弱,因此目前国内外研究主要针对生物Ⅰ型进行。至今为止生物Ⅰ型已经被发现有14个血清型(1~12,15和K2:O7)[3-4]。各异型血清型之间很少产生交叉免疫反应,目前还没有一种疫苗可以对App所有血清型都产生保护力[5]。该病于80年代开始在我国流行,目前已广泛存在。该病后期抗生素治疗几乎无效,且各地区的血清型也有差异,所以快速、准确的进行App的鉴定和分型显得尤为重要。
目前,玻片凝集、乳胶凝集、免疫扩散、间接血凝等血清学分型方法已被用于App的分型,但玻片凝集实验等快速血清学分型方法存在交叉反应。比较可靠的血清学分型方法如免疫扩散,间接血凝等又比较费时。血清学分型中存在的交叉反应最可能的原因是由于LPS上存在相同的抗原表位[6],已报道,血清型1和9之间,血清型3、6和8之间,血清型4和7之间存在血清型的交叉反应。PCR分型方法从基因的型特异性着手进行App的分型,避免了血清学分型时的交叉反应,且分型快速、准确。本研究旨在建立一个App的PCR分型体系,可实际用于实验室诊断,以及进行国内流行株的调查。本实验中建立的PCR分型系统由1个单重PCR,3个分别根据omlA基因、apx基因和cps基因建立的多重PCR组成,分别命名为cpx-种属特异性PCR、omlA-PCR、apx-PCR、cps-PCR。
1 材料和方法
1.1 菌株
猪传染性胸膜肺炎放线杆菌参考菌株血清型1型(Shope)、2 型(S1536)、3 型(S1421)、4 型(M62)、5a 型(K17)、5b(L20)、6 型(FemΦ)、7 型(WF83)、8型(405)、9 型(CVJ13261)、10 型(D13039)购自中国兽医药监察所;血清型 11型(56153)、12型(1096)由北京农科院陈晓林研究员惠赠;分离株JS3、ZJ5和JS7系从江苏、浙江等地病猪体内分离并经血清学鉴定为3、5和7型,以上菌株均由江苏省农业科学院兽医研究所保存。
1.2 主要试剂和仪器主要试剂和仪器
Taq酶(上海生工);DL-2000 marker;胰蛋白胨、酵母抽提物(OXOID公司);NAD(Roche 公 司 );Agarose(Promega);TaKaRa PCR Thermal Cycler Dice 和MiniCyclerTM(MJ Research);PTC-100 PCR 仪;DYCP-31D型水平电泳槽;TGL-16G-A型高速冷冻离心机(上海安亭科学仪器厂);THZ-C恒温振荡器(太仓实验仪器厂);复日RF-980生物电泳图像分析系统(上海复日科技有限公司)。
1.3 PCR模板的准备
1.3.1 组织病料的处理
取约1 g病料,剪碎后匀浆器加2 mL水研磨成糊状,先低速4 000 r/min离心2 min,取上清,去除组织块;然后把上清再高速10 000 r/min离心5 min,弃上清,用ddH2O或TE溶解沉淀,煮沸5 min,冰上放置,冷却后10 000 r/min离心2 min,上清-20℃保存备用。
1.3.2 临床分离株的处理
37℃在固体培养基上培养24 h后,挑取单菌落溶于50μL无菌蒸馏水中,煮沸5 min,冰上放置,冷却后10 000 r/min离心2 min,上清-20℃保存备用。
1.4 PCR分型体系的建立
1.4.1 cpx-种属特异性PCR快速鉴定App[7]
合成引物 cpxAF 5'-TAGAACCTTGTAAGCTC GTCCATA-3',cpxAR5'-CGTTTGTTAAGTGGTGTT GAGC-3'。PCR 反应体系:模板 5 μL,10×buffer 5 μL,cpxAF、cpxAR 各 05 uM,100uM dNTP,Tap酶 0.5 U,1.5 uM MgCl2。反应条件:95 ℃ 3 min;94℃ 30 s,60℃ 30 s,72℃ 40 s,30个循环后 72℃ 10 min。
电泳 1%琼脂糖凝胶,含溴化乙锭0.25 μg/mL,缓冲液为0.5×TBE,每孔加样1μL以120V恒压电泳30 min后紫外灯下观察结果。
1.4.2 omlA-PCR分型体系
根据GenBank上已登陆的App不同血清型omlA基因中间部分的差异合成5条引物(表1),其中LPF为公用上游引物,下游引物为LP1R、LP2R[8]、LP3R、LP4R。
反应体系(50μL)模板cpx-种属特异性PCR检测 App阳性的模板 1μL,10×buffer 5μL,LPF各1uM,LP1F、LP2F、LP3F、LP4F 各 0.5 uM,100 uM dNTP,Tap酶 0.5U,1.5 uM MgCl2。反应条件 94℃ 4 min;94℃ 1 min,54 ℃ 30 s,72℃ 1 min,共 30 个循环;72℃ 10 min。

表 1 omlA-PCR扩增omlA基因的引物的位置和序列
电泳 1.5%琼脂糖凝胶,含溴化乙锭0.25μg/mL,缓冲液为0.5×TBE,每孔加样5μL以120V恒压电泳60 min后紫外灯下观察结果。
1.4.3 apx-PCR分型体系
Apx是App最重要的毒力因子,不同血清型的菌株可产生4种Apx即ApxⅠ~Ⅳ,所有血清型菌株都具有apxⅣ基因,但不同血清型菌珠具有不同的apxⅠ、apxⅡ、apxⅢ基因组合。血清型型 1、5a、5b、9、11 具有 apxⅠ和 apxⅡ基因;血清型 2、3、4、6、8 具有apxⅡ和apxⅢ基因,3型因为缺乏ApxⅠBD基因可以从血清型2、4、6、8中区分出来;血清型7和12仅有apxⅡ基因;血清型10仅有apxⅠ基因[9-10]。根据App毒素基因的特点,以apxⅠA基因为模板,引物AIF,AIR在分型体系中预期仅扩增一条约1 035 bp的条带,引物AIIF、AIIR则以apxⅡA基因为模板预期仅扩增一条约482 bp的条带,以apxⅢA基因为模板,引物 AIIIF、AIIIR(由 Gram 等[8]设计)仅扩增一条约635 bp的条带,引物BDIF、BDIR根据分泌基因apxⅠBD设计[11],仅扩增一条约1447 bp的条带(表 2)。
反应体系(50μL) 模板 1μL,10×buffer 5μL,BDIF、BDIR 各 0.75uM;AIF、AIR、AIIF、AIIR、AIIIF、AIIIR 各 0.5uM,200uM dNTP,Tap 酶 1U,1.5uM MgCl2。反应条件:94 ℃ 4 min;94 ℃ 1 min,58 ℃ 30 s,72 ℃ 1.5 min,共 35 个循环;72℃ 10 min。
电泳 1.5%琼脂糖凝胶,含溴化乙锭0.25 μg/mL,缓冲液为0.5×TBE,每孔加样15μL以120V恒压电泳45 min后紫外灯下观察结果。
1.4.4 cps-PCR分型体系
根据GenBank上已登录的序列,自行设计引物cps1F、cps1R、cps8F、cps8R,引物 cps2R、cps6F、cps6R均由Stine等[12]设计(表3)。引物cps1F、cps1R以1型为模板仅扩增一条约1 071 bp的条带,引物cps8F、cps2R以2型为模板扩增一条约1 218 bp的条带,引物cps6F、cps6R以6型为模板扩增一条约718 bp的条带,引物cps8F、cps8R则同时以6型和8型为模板分别扩增出约414 bp和423 bp大小的条带。

表 2 apx-PCR扩增毒素基因的引物的位置和序列

表 3 cps-PCR中扩增cps基因的引物
反应体系(50μL) 模板 1μL,10×buffer 5μL,cps1F、cps1R、cps2R、cps6F、cps6R、cps8F、cps8R 各0.5uM,100uM dNTP,Tap 酶 0.5U,1.5uM MgCl2。反应条件 94℃ 4 min;94℃ 1 min,60℃30 s,72℃ 1.5 min,共33个循环;72℃10 min。电泳:1%琼脂糖凝胶,含溴化乙锭0.25μg/mL,缓冲液为0.5×TBE,每孔加样15μL以120V恒压电泳45 min后紫外灯下观察结果。
2 结果
2.1 参考菌株在PCR分型系统中的结果分析
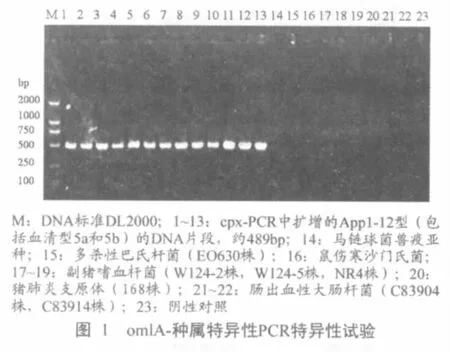
cpx-种属特异性PCR中,App1~12型均扩增出与预期大小一致的约489 bp的条带;对马链球菌兽疫亚种、多杀性巴氏杆菌、鼠伤寒沙门氏菌、副猪嗜血杆菌、产肠毒素大肠杆菌、猪肺炎支原体(168株)等均未扩增出相应条带(图1)。
电泳分析omlA-PCR分型体系PCR产物,与预期结果一致,4对引物将App1~12型分成 5 组,血清型 1、9、11、12为一组(omlAI);血清型 2、8为一组(omlAII);血清型 3、6、7 为一组(omlAIII),血清型4的扩增片段比血清型3、6、7的扩增片段约大37bp,可将其单独归为一组(omlAIV);血 清 型 5a、5b、10 为 一 组(omlAV)(图 2)。
根据Frey等[11]的方法,apx-PCR分型体系将12个血清型的App分成5组,5组分别为:血清型 1、5a、5b、9、11为一组;血清型 2、4、6、8 为一组;血清型3单独为一组;血清型7、12为一组;血清型10单独为一组(图3)。

cps-PCR分型体系中,2和8型模板公用上游引物cps8F,血清型1、2、6和8均扩增出于预期结果大小一致的条带,因6型有两对引物cps6F、cps6R和cps8F、cps8R,所以6型模板扩增出414 bp和718 bp的 2 特异性条带。血清型 3、4、5a、5b、7、9、10、11、12在该体系中均无扩增条带(图4)。

该分型体系由1个单重PCR,3个多重PCR组成,可以区分App生物Ⅰ型1~12个血清型中除血清型9和11外的10个血清型。随后的实验中将分型系统直接用于临床标本的检测,避免样品送检过程中细菌死亡或者其他人为因素未分离出App而不能进一步鉴定和分型的缺陷。
2.2 样品检测
样品经cpx-PCR检测后,阳性者再继续分型,对临床发病病料可以按1.3.1方法提取模板分型12 h内可知道分型结果,健康猪样品37℃增菌培养18 h后再分型。
该分型系统对分离株JS3、ZJ5和JS7的分型结果均与已知血清学分型结果一致。对实验室保存App1、3、5、7型人工发病猪肺脏12份、扁桃体12份,鼻拭子12份(每种血清型样本各3份)增菌后可以分型,并且也可以直接分型,分型结果与已知血清型一致。对以上猪肺脏和扁桃体-20℃保存一年的样品增菌后或者直接提取摸板均可分型。
在35份本实验室收集的临床可疑病料中检出2份阳性,分型结果均为7型。本实验对350头健康猪的肺脏和扁桃体进行了检测,在浙江嘉兴健康猪扁桃体中增菌后检测到3份阳性,分别为血清型12型、4型、3型。在广东从化与河源健康猪扁桃体中增菌后各检测到一份阳性,均为7型,350份肺脏中均未检测出阳性。
3 讨论
根据omlA基因和apx基因的App分型,已有报道[8],但Gram等不能区分血清型1、9、11;血清型2和 8。2003年,Nattawooti Sthitmatee[13]等在 Gram 等报道的apx-PCR分型子体系的基础上结合apxIVA-PCR可将血清型1从血清型9和11中区分出来,但不能区分血清型9和11以及血清型2和8,且apxIVA-PCR扩增产物较大。更早时间,Hennessy等[14]报道了用随机引物对App PCR分型的方法,可以区分App1~12型,但实验需要纯化好的细菌,且实验的重复性差。Hernane等[15]根据aroA基因,建立了PCR-RFLP的分型方法,将App1~12分成3群,Victor等[16]根据tbpA和tbpB基因同样建立了PCR-RELP的分型方法,但不能区分血清型4和11、血清型7和9,两者都过于复杂。
最近,Jaglic等[17]2004年报道了根据apxIVA基因序列的差异,建立了PCR-REA的分型方法,但不能区分血清型8和10,血清型9和11。2003年,Stine等[11]报道了根据cps的差异在同一体系中一次性鉴定血清型 2,5,6 的 PCR 方法。1 年后,Jennifer等[7]报道了根据cps基因区分血清型1、2、8的PCR方法,但不是在一个PCR体系内一次性区分血清型1、2、8。
本实验在omlA基因和apx基因PCR分型系统的基础上,结合cps基因的型特异性PCR将App1~12型中除血清型9和11外的其他10个血清型完全区分。Gram等的omlA-PCR体系中血清型3、6、7的PCR扩增条带约为577 bp,4型约为614 bp,两者相对偏差较小,琼脂糖电泳不易将4型从3、6、7型中区分出来。本实验omlA-PCR体系中将血清型3、6、7扩增出的条带缩小到约为314 bp,4型约为351 bp,加大了两者相对偏差,电泳后明显可以将4型从 3、6、7型中区分出来。另外,本实验中的apx-PCR体系中省去了Gram等的apx-PCR体系中的针对apxBDⅢ基因设计的一对引物,但并不影响分组结果。本分型系统中cps-PCR结合cpx-种属特异性PCR可以单独成一体系用于鉴定血清型1、2、6和8。同时,该分型系统与传统的血清学方法相结合,可以更好的对App进行分型。
目前国内诊断本病的方法大多是采用细菌分离鉴定和血清学诊断。App对外界抵抗力较弱,在送检过程中极易死亡,再加上病料污染,抗生素滥用等因素细菌很难分离,并且细菌分离鉴定费时费力,过程烦琐。而传统的血清学分型方法很难完全区分App生物Ⅰ型的12个血清型。由于交叉反应的存在,血清学方法较难从血清型9和11中区分血清型1,血清型6和8区分同样不易。而本研究成功解决了这一问题。另外,亚临床感染或带菌状态下的假阴性以及目前国内App疫苗大都是灭活苗,血清学方法难以对免疫猪和感染猪作出鉴别诊断等都使血清学分型方法受到局限。本实验建立了快速,准确的App分型系统,可以及时鉴定App暴发地区的主要流行的血清型,为尽早控制疾病提供帮助。
[1]Sidibe M,Messier S,Lariviere S,et al.Detection of Actinobacillus pleuropneumoniae in the porcine upper respiratory tract as a complement to serological tests[J].Can J Vet Res,1993,57(3):204-208.
[2]Pohl S,Bertschinger U,Frederiksen W,et al.Transfer of Haemophilus pleuropneumoniae and the Pasteurella haemolytica-like organism causing porcine necrotic pleuropneumoniae to the genus Actinobacillus(Actinobacillus pleuropneumoniae comb.nov.)on the basis of phenotypic and deoxyribonucleic acid relatedness [J].Int J Syst Bacteriol,1983,33(3):510-514.
[3]Nielsen R,Andresen L O, Plambeck T.Serological characterization of Actinobacillus pleuropneumoniae biotype 1 strains antigenically related to both serotypes 2 and 7[J].Acta Vet Scand,1996,37(3):327-336.
[4]Blackall P J,Klaasen H L B M,van den Bosch H,et al.Proposal of a new serovar of Actinobacillus pleuropneumoniae:serovar 15[J].Vet Microbiol,2002,84(1):47-52.
[5]Fuller T E,Thacker B J,Duran C O,et al.A genetically defined riboflavin auxotroph of Actinobacillus pleuropneumoniae as a live attenuated vaccine [J].Vaccine, 2000,18(25):2867-2877.
[6]Perry M B,Altman E,Brisson J R,et al.Structural characteristics of the antigenic capsular polysaccharides and lipopolysaccharides involved in the serological classification of Actinobacillus(Haemophilus) pleuropneumoniae[J].Serodiagn Immunother Infect Dis,1990,4(4):299-308.
[7]Schuchert J A,Inzana T J,Angen Φ,et al.Detection and Identification of Actinobacillus pleuropneumoniae Serotypes 1,2 and 8 by Multiplex PCR[J].J Clin Microbiol,2004,42(9):4344-4348.
[8]Gram T,Ahrens P,Andreasen M,et al.An Actinobacillus pleuropneumoniae PCR typing system based on the apx and omlA genes—evaluation of isolates from lungs and tonsils of pigs[J].Vet Microbiol,2000,75(1):43-57.
[9]Beck M,van den Bosch J F,Jongenelelen I M C A,et al.RTX toxin genotypes and phenotypes in Actinobacillus pleuropneumoniae feld strains[J].J Clin Microbiol,1994,32(11):2749-2753.
[10]Kamp E M,Vermeulen T M M,Smits M A,et al.Production of Apx toxins by feld strains of Actinobacillus pleuropneumoniae and Actinobacillus suis[J].Infect Immunol,1994,62(9):4063-4065.
[11]Frey J,Beck M,van den Bosch J F,et al.Development of an efficient PCR method for toxin typing of Actinobacillus pleuropneumoniae strains[J].Mol Cell Probes,1995,9(4):277-282.
[12]Jessing S G,Angen Φ,Inzana T G.Evaluation of a Multiplex PCR Test for Simultaneous Identification and Serotyping of Actinobacillus pleuropneumoniae Serotypes 2,5,and 6[J].J Clin Microbiol,2003,41(9):4095-4100.
[13]Sthitmatee N,Sirinarumitr T,Makonkewkeyoon L,et al.Identification of the Actinobacillus pleuropneumoniae serotype using PCR based-apx genes[J].Mol Cell Probes,2003,17(6):301-305.
[14]Hennessy K J, Iandolo J J,Fenwick B W.Serotype identification of Actinobacillus pleuropneumoniae by arbitrarily primed polymerase chain reaction[J].J Clin Microbiol,1993,31(5):1155-1159.
[15]Moral C H,Soriano A C,Salazar M S,et al.Molecular cloning and sequencing of the aroA gene from Actinobacillus pleuropneumoniae and its use in a PCR assay for rapid identification[J].J Clin Microbiol,1999,37(5):1575-1578.
[16]de la Puente-Redondo V A,del Blanco N G,Gutierrez-Martin C B,et al.Detection and subtyping of Actinobacillus pleuropneumoniae strains by PCR-RFLP analysis of the tbpA and tbpB genes[J].Res Microbiol,2000,151(8):669-681.
[17]Jaglic Z,Svastova P,Rychlik I,et al.Differentiation of Actinobacillus pleuropneumoniae by PCR-REA based on sequence variability of the apxIVA gene and by ribotyping[J].Vet Microbiol,2004,103(1):63-69.
