L.PARACASEI HD1-7与S.ALBULUS1-25原生质体融合选育产天然防腐剂的优良菌株
2011-11-14张铁丹金忠斌庄海霁张基亮平文祥周东坡
雷 虹,张铁丹,金忠斌,庄海霁,何 欣,张基亮,平文祥,周东坡
(黑龙江大学生命科学学院微生物黑龙江省高校重点实验室,黑龙江哈尔滨150080)
L.PARACASEI HD1-7与S.ALBULUS1-25原生质体融合选育产天然防腐剂的优良菌株
雷 虹,张铁丹,金忠斌,庄海霁,何 欣,张基亮,平文祥*,周东坡*
(黑龙江大学生命科学学院微生物黑龙江省高校重点实验室,黑龙江哈尔滨150080)
为获得更具优良应用特性的微生物源天然防腐剂,采用原生质体融合技术,以Lactobacillus paracasei HD1-7和Streptomyces albulus 1-25为亲株选育优良菌株,研究了L.paracasei HD1-7和S.albulus 1-25原生质体制备与再生条件,通过表型、抑菌谱、抗药性和总DNA含量比较等手段筛选鉴定融合子,最终选育出3株以L.paracasei HD1-7为受体、获得来自S.albulus1-25的抑酵母菌基因的融合子。
L.paracasei HD1-7,S.albulus1-25,天然防腐剂,原生质体制备,融合子鉴定
在谈防腐剂色变的年代,天然食品防腐剂由于安全无毒,甚至有的对人体有保健作用而受到人们的广泛关注[1-3]。在各种天然源的食品防腐剂开发过程中,人们把目光转向微生物。通过微生物代谢生产天然防腐剂,由于周期短、基因改造易操作等优势而成为天然防腐剂研究的主流方向[4-5],具有广阔开发的前景。S.albulus 1-25菌株代谢产生ε-polylysine,ε-PL具有抑菌谱广(对G+和G-细菌、真菌均有抑菌效果)、水溶性好、安全性高、热稳定性好、抑菌 pH范围广、应用范围广等特点[6-7]。但S.albulus 1-25菌株产生的ε-PL存在分子量大、抑菌效果稍弱的缺点,生长速度慢,产酸少,培养过程中易染菌。因此,进行菌株的改造是必然之势。具有自主知识产权的L.paracasei HD1-7菌株产生的副干酪乳杆菌素具有在酸性条件下对大多数的 G+和G-细菌有很好的抑菌效果,菌株生长周期短,产酸多,生长竞争力强等优点。但副干酪乳杆菌素存在于中性及碱性条件下不抑菌、对真菌无抑制能力等缺点[8-10]。也就是说,2株菌在培养和产物特性的方面具有很好的互补性。原生质体融合技术可在不知道双亲株遗传背景的情况下,实现双亲基因组融合、DNA交换、重组并产生新性状。原生质体融合技术具有广泛适应性和随机性,可实现常规杂交方法无法做到的种间、属间、门间甚至跨界的远缘杂交,并可以大幅度提高亲本之间的重组频率,集中双亲株优良性状的机会更大[11-13]。因此,本课题采用L.paracasei HD1-7与S.albulus 1-25原生质体融合育种方法,是选育优良天然防腐剂产生菌株的理想策略。
1 材料与方法
1.1 实验材料
亲本菌株L.paracasei HD1-7 黑龙江大学微生物重点实验室分离,对潮霉素的最高耐药浓度为5000μg/mL,对卡那霉素的最高耐药浓度为10μg/mL;S.albulus 1-25 黑龙江大学微生物重点实验室保藏,对潮霉素(Hym)的最高耐药浓度为10μg/mL,对卡那霉素(Km)的最高耐药浓度为100μg/mL;指示菌株 Bacillus subtilis、Escherichia.coli、Saccharomyces cerevisiae 本院微生物重点实验室保存;Staphylococcus aureus、Micrococcus flavus 黑龙江省微生物研究所提供;Bacillus megaterium、Listeria sp.、Salmonella sp.、Proteus vulgaris、Shigella sp.、Bacillus cereus 哈医大二院赠送;培养基 M6培养基[14],酵母膏-麦芽粉培养基[15],S培养基[16],种子培养基[6];L.paracasei HD1-7再生培养基 a.再生培养基1-改良M6培养基,在M6培养基的基础上加入2.5%明胶,蔗糖0.5mol/L,5mL 2%的无菌牛血清白蛋白;b.再生培养基2-乳酸菌原生质体再生固体培养基[12];c.再生培养基3-改良MRS再生培养基[12];溶菌酶(lysozyme) 上海蓝季科技发展有限公司;Marker-DL-2000(Cat#MD 114)、2×Taq PCR MasterMix(Cat#KT-201) TIANGEN公司;P缓冲溶液[17],HM液[18]。
1.2 实验方法
1.2.1 L.paracasei HD1-7原生质体的制备与再生L.paracasei HD1-7菌株在M6液体培养基中,37℃培养20h,4000r/min离心10min,弃上清液收集菌体后,用 HM液洗涤2次,再用 HM液稀释制成108cfu/mL菌悬液。加入溶菌酶,在适宜的温度条件下水浴酶解,用平皿裂解法[21]统计原生质体的制备率;采用双层平板法[21]再生原生质体。
原生质体制备率(%)=(酶解前的菌落数-酶解后的菌落数)/酶解前的菌落数×100%
再生率(%)=[从平皿上算得的总菌数-总菌数×(1-制备率)]/(总菌数×制备率)×100%
1.2.2 S.albulus 1-25原生质体的制备 从S.albulus斜面上刮取全部孢子,用无菌水制成粗制孢子悬液,激烈振荡后用塞有脱脂棉的一次性注射器过滤到无菌离心管中,6000r/min离心10min,使孢子沉淀,弃上清,加入4mL无菌水轻微振荡后,取2mL孢子悬液接种于50mL种子培养基中,30℃振荡培养48h。
以10%的接种量将种子液接入到25mL添加10.3%蔗糖的S培养基中,30℃振荡培养。培养液6000r/min离心10min,收集S.albulus 1-25菌丝体,并用15mL蔗糖溶液洗涤沉淀2次,将菌丝体悬于4mL溶菌酶溶液中,水浴酶解,吹吸,保温15min,补加5mL P缓冲液,用差速离心法(3500r/min,7min;6000r/min,10min)除去未酶解的菌丝体,收集原生质体。血球计数计算原生质体形成量。
1.2.3 L.paracasei HD 1-7与S.albulus 1-25的原生质体融合 取双亲株原生质体各1mL混合,加入2mL 50%的PEG(MW2000)溶液,20℃水浴3min,取出6500r/min离心10min,HM液离心洗涤2次,用HM液稀释10-4~10-6,涂于改良的M6平板上,37℃培养,计算原生质体融合率。
原生质体融合率(%)=(再生平皿上的总菌落数-双亲裂解剩余菌落数)/[单方(较少方)原生质体再生数]×100%
1.2.4 融合子的筛选与鉴定 将再生菌落用无菌牙签依次点接到分别含有50μg/mL的卡那霉素、潮霉素、卡那霉素和潮霉素及无抗生素的M6培养基上,在两种抗生素选择性培养基上都能生长或都不能生长的菌落可初步判断为融合子。将获得的融合子连续传代10次,再检测其抗药性的稳定性。
以亲株L.paracasei HD1-7作对照,采用双层平板法[8]检测融合子对 B.subtilis、S.aureus、M.flavus、E.coli、 S.cerevisiae、 L.plantarum、 S. albulus、 B. megaterium、Listeria sp.、Salmonella sp.、P.vulgaris、Shigella sp.、B.brevis的抑菌能力;以B.subtilis为指示菌,检测融合子在pH在3、5、7条件下的抑菌效果。
提取S.albulus 1-25、L.paracasei HD1-7及融合子R1、R2、R3的总DNA进行电泳检测[19-20],比较其DNA总量,鉴定是否为融合子。
2 结果与讨论
2.1 L.paracasei HD1-7原生质体制备与再生条件的确定
2.1.1 酶解温度对原生质体制备的影响 酶解温度可直接影响到酶促反应的速率和原生质体化的程度,因为它直接关系到溶菌酶的解离基团的状态和活性基团的作用。如图1所示,30℃和37℃条件下原生质体的制备率均较高,但37℃时再生率更高,为25.9%,因此确定37℃为最佳酶解温度。

图1 酶解温度对L.paracasei HD1-7原生质体制备和再生的影响
2.1.2 酶浓度对原生质体制备的影响 原生质体形成率在一定范围内与溶菌酶的浓度成正比。但溶菌酶浓度过高,虽然原生质体形成率高,而由于溶菌酶中往往含有一些对原生质体有害的酶类(如过氧化物酶、核糖核酸酶等),因此,当达到一定浓度时,必然会严重地影响原生质体的活性;而且酶量过大会使细菌脱壁太彻底,失去了原生质体再生时合成细胞壁的引物,易使菌体凝集,降低原生质体的再生率;溶菌酶浓度低,则原生质体形成率低,影响融合[21-23]。从图2可以看出,随着溶菌酶浓度的增加,原生质体形成率不断提高,但再生率却随着酶浓度的增加依次下降,当溶菌酶浓度为2mg/mL时再生率最高,为22.7%,因此确定2mg/mL为最佳酶浓度。
2.1.3 酶解时间对原生质体制备的影响 图3表明,酶解时间越长,原生质体制备率越高,而再生率越低。酶解1~5h时的制备率从68.1%、69.5%升高到72.95%,再生率从21.5%、23.2%降低到9.2%。原因
同溶菌酶浓度过高一样,降低了原生质体的活性,因此确定酶解时间为3h。
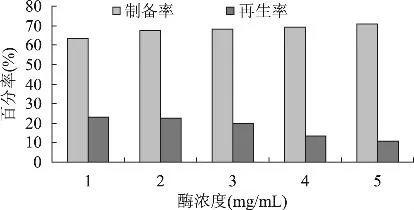
图2 酶的浓度对L.paracasei HD1-7原生质体制备和再生的影响

图3 酶解时间对L.paracasei HD1-7原生质体制备和再生的影响
2.1.4 再生培养基对原生质体再生的影响 再生培养基是原生质体进行再生过程的最重要的外界环境因素之一,它对原生质体既有维系保护的作用,又有支持的功效和营养功能,它直接关系到再生率的高低。如图4所示,再生培养基1-改良M6培养基的再生率最高达28%。明胶和牛血清白蛋白的作用是既可起到对原生质体保护剂的作用,同时也可以起到原生质体扩张剂的作用,刺激原生质体的再生过程,因此在L.paracasei HD1-7生长良好的M6培养基的基础上,加上明胶、牛血清白蛋白和0.5mol/L蔗糖创造的高渗环境,很适宜原生质体再生。
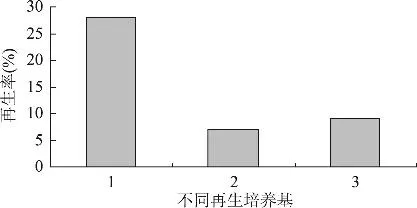
图4 不同再生培养基对L.paracasei HD1-7原生质体再生的影响
2.1.5 再生温度对原生质体再生的影响 再生温度对再生率的影响效果与原来培养细胞时的温度有关,一般认为最佳的再生温度低于菌体适宜培养温度。从图5可以看出,35℃条件下的再生率最高达43.7%,因此确定35℃为最佳再生温度。
经以上各条件摸索,确定L.paracasei HD1-7的最佳原生质体条件为:37℃酶解、溶菌酶浓度为2mg/mL、酶解时间为3h、改良M6培养基为再生培养基、35℃再生,在此条件下可使原生质体的制备率达70%以上,再生率达40%以上。
2.2 S.albulus 1-25原生质体制备条件的确定
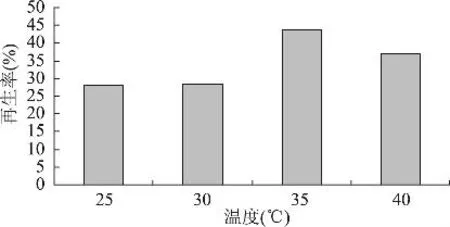
图5 再生温度对L.paracasei HD1-7原生质体再生的影响
2.2.1 S.albulus 1-25的生长曲线 由图6可知,S.albulus 1-25菌株在0~12h为延迟生长期,12~36h为对数生长期,36~60h为稳定生长期,培养64h后进入衰退期。

图6 S.albulus 1-25菌株的生长曲线
2.2.2 菌龄对原生质体制备的影响 一般认为菌体生长至对数生长期后期制备原生质体最适宜,菌龄对S.albulus 1-25原生质体形成量的影响见图7,培养40h时,形成的原生质体最多,为4.675×107cfu/mL。因此,确定最佳菌龄为40h,即为稳定生长期的初期。

图7 菌龄对S.albulus 1-25原生质体形成量的影响
2.2.3 甘氨酸对原生质体制备的影响 放线菌在加入甘氨酸的培养基中培养后,易于使细胞壁的网状结构松动,释放原生质体。甘氨酸对S.albulus 1-25原生质体形成量的影响见图8,随着加入甘氨酸量的增多,原生质体形成量不断增多,直至添加量为2.0%时,达到最高值5.275×107cfu/mL。添加甘氨酸后,发酵液的状态也有所改变,菌丝结块、挂壁现象减少,菌丝分散更加均匀。
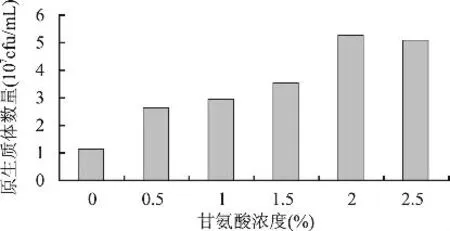
图8 甘氨酸添加量对S.albulus 1-25原生质体形成量的影响
2.2.4 酶解温度对原生质体制备的影响 不同的酶具有各自不同的最适温度,同时还要注意菌株生长的最适温度,以避免因温度不当而导致原生质体活性降低,甚至破坏,因此确定酶解温度通常要二者兼顾,这对水解细胞壁是至关重要的。酶解温度对S. albulus 1-25原生质体形成量的影响见图9,35℃酶解时原生质体形成率最高,为4.975×107cfu/mL,因此确定为最佳酶解温度。

图9 酶解温度对S.albulus 1-25原生质体形成量的影响
2.2.5 酶浓度对原生质体制备的影响 原生质体制备时,酶的浓度要适当。酶量过低,作用不彻底,不利于原生质体形成;浓度过高,又会影响原生质体数量和活性,致使再生频率下降。酶浓度对S.albulus 1-25原生质体形成量的影响见图10,可看出随酶浓度增加,原生质体形成量不断增加,酶浓度达到2.0mg/mL后,原生质体形成量不再增加,为1.34×108cfu/mL,因此确定最佳酶浓度为2.0mg/mL。
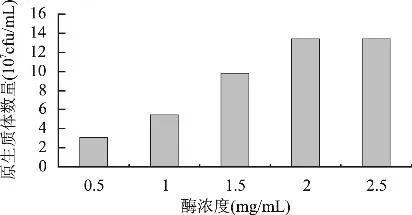
图10 酶浓度对S.albulus 1-25原生质体形成量的影响
2.2.6 酶解时间对原生质体制备的影响 充足的酶解时间是细菌原生质体化的必要条件,原生质体形成率随酶解时间延长而增加,但再生率会由于随酶解时间过长导致细胞壁脱壁彻底无法再生而降低。酶解时间对S.albulus 1-25原生质体形成量的影响见图11,酶解180min后,原生质体的数量大大增加,达到1.74×108cfu/mL。为避免酶解时间过长,对原生质体破坏过度,影响融合,确定酶解时间为180min。

图11 酶解时间对S.albulus 1-25原生质体形成量的影响
经以上各条件摸索,确定最佳酶解条件:菌龄为40h,甘氨酸添加量为2.0%,酶解温度为35℃,酶解时间为 180min,溶菌酶浓度为 2.0mg/mL,可使S.albulus 1-25原生质体形成量达1.7×108cfu/mL。
2.3 融合子的筛选及鉴定
检出和鉴别融合重组体细胞的主要依据是亲本的遗传标记,同时还要结合DNA的含量和孢子形态等遗传学和形态学方面特性加以确定。本课题结合了亲本抗药性标记、菌体形态、菌落形态、DNA含量、稳定性等方面对融合子进行了鉴定,以确保获得的融合子为稳定遗传的目的重组子。
2.3.1 融合子的筛选 本实验的目的是只筛选L.paracasei HD1-7作为受体的融合子。由于L.paracasei HD1-7和S.albulus 1-25的菌体形态、菌落形态相差悬殊,因此非常容易区分L.paracasei HD1 -7作为受体的再生菌落。而且改良的M6双层再生平板及37℃再生培养温度等均是L.paracasei HD1-7作为受体的融合子的最佳再生条件,S.albulus 1-25作为受体的融合子生长会很缓慢,一般在培养3d后才出现。因此,筛选时只选择前3d出现的菌落形态类似L.paracasei HD1-7的菌株进行鉴定。
抗药性标记筛选结果见表1,先后对12478个再生菌落进行抗药性标记的筛选,获得带有双标记的融合子465个,融合率为3.7%,经10代抗药性稳定性检测,有65个重组体能够保持双标记抗生素抗性,占初筛融合子的1.4%,融合率为0.52%。
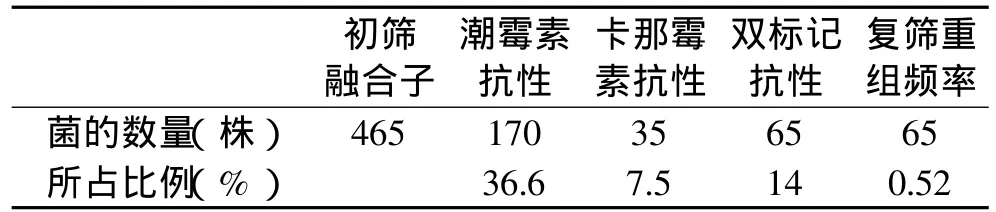
表1 融合子筛选结果
2.3.2 融合子的抑菌能力 首先以B.subtilis(G+细菌)、E.coli(G-细菌)和S.cerevisiae(真菌)为指示菌对稳定的重组体进行抑菌能力测定,结果有3个重组体(命名为R1、R2、R3)从亲株S.albulus 1-25获得了对酵母菌的抑菌基因,使其抑菌范围扩宽。这3株融合子对其他指示菌的抑菌效果见表2,由表可知R3对多个菌株的抑菌能力均超过了亲株。抑菌最适pH实验结果(图12)表明,3株融合子在中性条件下仍不具抑菌活性。
2.3.3 融合子与亲株的形态学特征比较 融合子与亲株的形态学见表3,结果表明融合子在表型上均发生了变化,菌体和菌落面积均变大。
2.3.4 总DNA含量比较进一步鉴定融合子 提取S.albulus 1-25、L.paracasei HD1-7、融合子R1、R2、R3的总DNA,计算得到A260/A280值均在1.8±0.2范围内,纯度达到标准。由表4可看出,融合子R1、R2、R3的A260值大于双亲株的A260值,而又介于双亲株的A260值和之间,说明融合子R1、R2、R3的DNA总量较亲株增多,确实发生了融合,是重组体。
由电泳图13可观察到,融合子总DNA的亮度远远大于亲株L.paracasei HD1-7总DNA,也说明了融合子R1、R2、R3的DNA总量较亲株增多,进一步证明了R1,R2,R3为融合子。
3 结论
选用溶菌酶浓度为2mg/mL,酶解温度为37℃,酶解时间3h,使L.paracasei HD1-7原生质体产量最高,制备率达70%以上;再生培养基为改良的M6培养基,再生温度37℃,此时再生率达40%以上。采用S.albulus 1-25稳定生长初期的菌丝,添加量2.0%的甘氨酸,溶菌酶浓度2.0mg/mL,酶解温度35℃,酶解时间 180min,使原生质体形成达到最高 1.74× 108cfu/mL。两亲株都随着酶浓度、酶解温度和时间的增加,原生质体形成率不断提高,但原生质体再生率升高到一定程度会下降。
重组子R1、R2、R3具有双亲株的优良性状,获得了来自S.albulus 1-25的抑酵母菌基因,使其抑菌范围扩宽,且为遗传稳定性菌株。
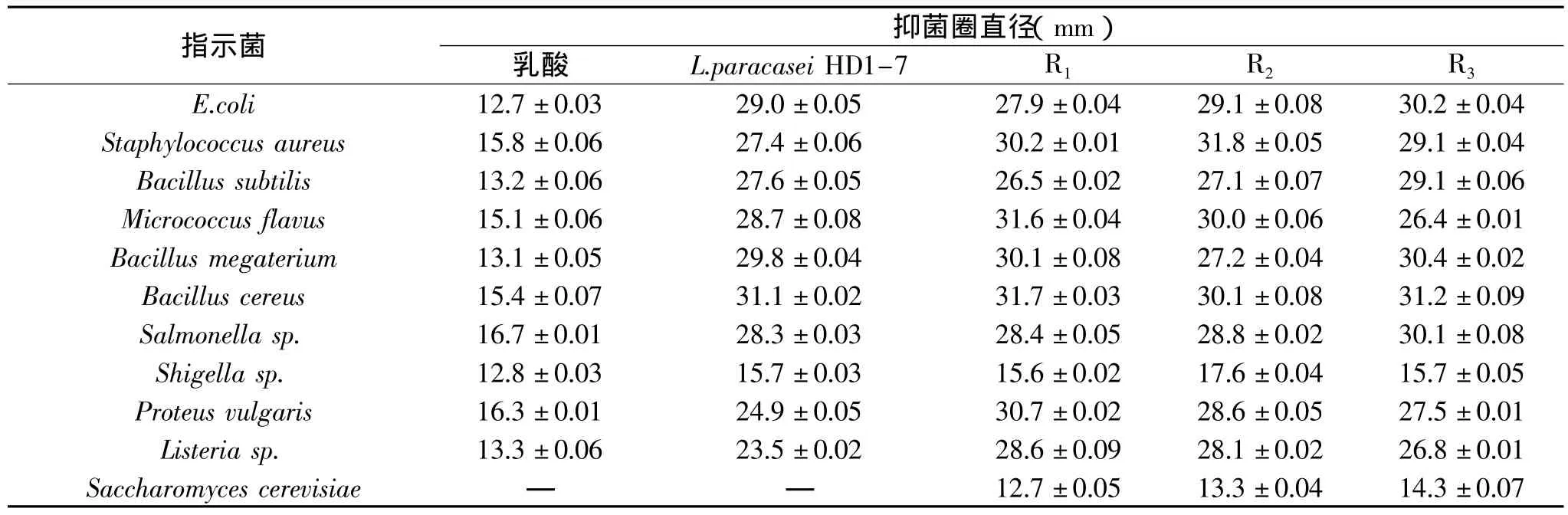
表2 重组体对各指示菌的抑菌效果

表3 融合子与双亲株的形态学特征比较

表4 双亲株和融合子总DNA紫外检测结果

图12 重组体在pH为3、5、7条件下的抑菌效果(B.subtilis)

图13 重组体总DNA的电泳图
[1]Kawai T,Kubota T,Hiraki J,et al.Biosynthesis of epsilonpoly-L-lysine in a cell-free system of Streptomyces albulus[J]. Biochem Biophys Res Commun,2003,311(3):635-640.
[2]Caridi A.Selection of Escherichia coli-inhibiting strains of Lactobacillus paracasei subsp.paracasei[J].Journal of Industrial Microbiologyamp;Biotechnology,2002,29:303-308.
[3]Cacdiu B.Bacterioncin Produced by Lactobacillus acidophilus[J].Applied and Environmental Microbiology,2002,29:1808 -1815.
[4]Nes Ingolf F,Johnsborg Ola.Exploration of antimicrobial potentialin LAB by genomics[J].CurrentOpinion in Biotechnology,2004,15(5):100-104.
[5]Kwon Hyuk-Sang,Yang Eun-Hee,Yeon Seung-Woo,et al. Rapid entication of probiotic Lactobacillus species by multiplex PCR using species-speci.c primers[J].J Industrial Microbiolo,2004,239(11):138-142.
[6]Nicholas Delihas,Lee W Riley,Winnie Loo,et al.High sensitivity of Mycobacterium species to the bactericidal activity by polylysine[J].FEMS Microbiology Letters,1995,132(5):233-237.
[7]雷虹,孙艳波,何堃,等.关于天然防腐剂ε-多聚赖氨酸的研究进展[J].中国食品添加剂,2005,71(4):14-17.
[8]雷虹,李秀凉,平文祥,等.L-乳酸菌酸菜发酵液中小肽类天然防腐剂的研究[J].中国林副特产,2005,75(2):44-45.
[9]雷虹,李秀凉,庄海霁,等.副干酪乳杆菌HD1.7产生抗菌物质的初步研究[J].工业微生物,2007,37(4):16-19.
[10]雷虹,齐桂云,李秀凉,等.乳酸杆菌小分子抗菌肽产生菌的筛选及鉴定[J].中华微生物学和免疫学杂志,2006,26(7):671.
[11]孙剑秋,周东坡.微生物原生质体技术[J].生物学通报,2002,37(7):9-11.
[12]张莉滟.双歧杆菌与乳杆菌原生质体融合的初步研究[D].重庆医科大学,2002.
[13]何忠宝.原生质体融合构建葡萄酒降酸酵母的研究[D].西北农业科技大学,2004.
[14]中国普通微生物菌种保藏管理中心.菌种目录[M].第三版.北京:中国农业科技出版社,1997:230.
[15]沈萍.微生物学实验[M].北京:高等教育出版社,2001:214,218,221.
[16]施巧琴,吴松刚.工业微生物育种学[M].第二版.北京:科学出版社,2004:331.
[17]骆健美,李建姝,等.响应面优化褐黄孢链霉菌原生质体再生培养基[J].食品科学,2009,30(7):154-158.
[18]刘新梅,高宇,赵静,等.纳豆菌原生质体制备与再生条件的研究[J].食品科学,2007:28(5):231-236.
[19]杜连祥,路福平.微生物学实验技术[M].北京:中国轻工业出版社,2005:198-201.
[20]赵宗江,张玉祥.分子生物学实验参考手册[M].北京:化学工业出版社,2005:59-63.
[21]周东坡,平文祥.微生物原生质体融合[M].黑龙江:黑龙江科技出版社,1990:158.
[22]Ikeda H I,Inoue M,Omura S.Improvement of macrolide antibiotic-producing streptomycete strain by the regeneration of protoplasts[J].J Antibiol,1983,36(3):283-288.
[23]Hopwood DA,Wright HM.Bacterial protoplast fusion:recombination in fused protoplast of Streptomyces[J].Mol Gen Genet,1978,162:307-317.
Breeding strains of excellent biopreservative by L.paracasei HD1-7 and S.albulus 1-25 protoplast fusion
LEI Hong,ZHANG Tie-dan,JIN Zhong-bin,ZHUANG Hai-ji,HE Xin,ZHANG Ji-liang,PING Wen-xiang*,ZHOU Dong-po*
(Key Laboratory of Microbial,College of Life Science,Heilongjiang University,Harbin 150080,China)
ln order to obtain microbial preservative with excellent applicability,L.paracasei HD1-7 and S.albulus 1-25 were used as parents to construct strains through protoplast fusion technique.Optimal protoplast fusion conditions were systematically investigated.Through phenotype characteristic,antibacterial spectrum,drug resistance property and DNA content,3 optimal fusants were identified.The fusants had the gene of inhibiting yeast from S.albulus 1-25.
L.paracasei HD1-7;S.albulus 1-25;biopreservative;protoplast fusion;fusant identification
TS202.3
A
1002-0306(2011)01-0146-06
2010-02-04 *通讯联系人
雷虹(1971-),女,博士,副教授,硕导,研究方向:食品微生物。
黑龙江省科技厅重大攻关项目(GA07B401);黑龙江省科技厅重大攻关项目(GB05B401);哈尔滨市科技局科技攻关项目(2009AA3CN079);黑龙江省科技厅青年基金项目(QC03C24)。
