实时荧光RT-PCR检测凝血块中乙脑病毒RNA*
2011-11-13张拥军王金章朱莉莉
张拥军,王金章,朱莉莉,陈 端,陈 炜
2.福建医科大学公共卫生学院教学基地;
3.福建省实验动物质量检测中心;
4.厦门出入境检验检疫局;
流行性乙型脑炎(简称乙脑)是一种经蚊传播的人兽共患病,主要流行于东南亚及澳洲一些国家和地区。以严重的脑炎和神经疾病为特征,病死率和致残率高。其致病因子-乙脑病毒(Japanese encephalitis virus,JEV)属于黄病毒科黄病毒属,基因组为全长约11 kb的单股正链RNA,编码3个结构蛋白(衣壳蛋白C、膜蛋白M和外膜蛋白E)及7个非结构蛋白(NS1、NS2A 、NS2B、NS3、NS4A、NS4B和NS5)[1]。
尽管人类作为JEV传播链中的终末宿主,病毒血症期比较短暂,且病毒载量较低,从患者组织、血液或其它体液中检测JEV特异RNA依然是实验室确诊JEV感染的手段之一[1]。国内外多家实验室先后建立起一些检测JEV RNA的方法,包括逆转录PCR、逆转录套式PCR、逆转录实时荧光PCR、逆转录环介导等温扩增(LAMP)等[2-7],其中逆转录实时荧光PCR因为其快速、简便、灵敏成为主流发展方向。但我们在实际工作中发现,该方法的灵敏度还不能胜任临床样品的检测[7],因此JEV核酸检测还没有作为实验室常规诊断的备选方案。
本研究的目的,一是评价部分文献报道和自行设计的实时荧光PCR引物的检测效果,以建立更加灵敏便捷的检测方法。二是采用新建立的检测体系,分别选用部分急性期患者血清和凝血块提取病毒核酸,比较来自同一患者的两类样品分别用于JEV核酸检测的差异。现将结果报告如下。
1 材料与方法
1.1 毒株、标本 武汉生物制品研究所生产的乙型脑炎减毒活疫苗 SA14-14-2株作为阳性参比品,0.5mL生理盐水复溶,滴度不低于5×105pfu/mL。所用血清和凝血块(包括IgM阳性血清和相应凝血块各15份,IgM阴性的血清和相应凝血块各15份)来自2010年6-12月福州市部分医院送检疑似乙脑患者样品,均处于感染急性期。血清样品用上海贝西公司ELISA试剂盒检测JEV-IgM抗体,保存于-20℃备用。分离血清后,将凝血块置于微量离心管,保存于-20℃,集中处理。
1.2 主要试剂、仪器 JEV-IgM 抗体检测ELISA试剂盒购自上海贝西公司,病毒DNA/RNA提取试剂盒(MiniBEST Viral RNA/DNA Extraction Kit Ver.4.0)及一步法SYBRGREEN I RT-PCR试剂盒(One Step SYBR PrimeScript RT-PCR Kit II)购自T aKaRa公司(大连),病毒 RNA提取试剂盒(QIAamp Viral RNA Mini kit)购自QIAGEN公司(美国)。实时荧光PCR仪为7500 real time PCR system(Applied Biosystem,美国),高速台式离心机为Eppendorf(美国)产品。
1.3 凝血块处理、核酸提取根据文献[8],将凝血块转入玻璃匀浆器,以适量(2~3mL)红细胞裂解缓冲液浸泡凝血块约20min,研磨,离心弃上清,重悬于100μ L生理盐水。其余步骤按TaKaRa公司试剂盒说明书进行,以70μ L洗脱液洗脱。疫苗株RNA模板提取采用QIAGEN公司病毒RNA提取试剂盒(QIAamp Viral RNA Mini kit),共使用 140μ L 悬液,50μ L洗脱。
1.4 引物序列及扩增反应 本研究部分引物来自相关文献报道[2-6],部分引物根据NCBI数据库中选取的48个乙脑病毒全基因序列,用Primer Express 3.0软件分析,并参考乙脑病毒减毒活疫苗SA14-14-2株序列(NCBI登录号:AF315119)设计(见表1)。所有引物由上海生工生物工程有限公司合成。
实时荧光 RT-PCR按 TaKaRa公司试剂盒说明书进行,总体积20μ L,其反应体系配制及反应条件设定见表2。

表1 JEV核酸实时荧光检测引物Table 1 Primer sequences of real-time RT-PCR assays for Japanese encephalitis virus RNA
2 结 果
2.1 9对JEV引物的扩增效果评价 取复溶的JEV减毒活疫苗悬液提取病毒 RNA,并进行连续10倍稀释,得到分别相当于 5×104、5×103、5×102、50 、5 、0.5 、0.05pfu/mL 病毒量的 RNA 参比品。按试剂盒说明书配制20μ L的反应体系,其中加入2μ L RNA模板。在相同条件下,分别进行9对引物与系列稀释样品的扩增,并进行融解曲线分析,见图1。逐一比较扩增曲线及解链温度,确定出这9对引物的检测限在50-500pfu/mL之间,其中对5×104pfu/mL参比品的Ct值在18.01~29.36的范围。因此,结合各自的检测限、阳性产物解链温度的稳定性、阳性产物与非特异扩增产物解链温度的差异等因素,见表1,选择针对病毒衣壳蛋白区域的引物6为最佳,其检测限为50 pfu/mL,解链温度为82.4℃。
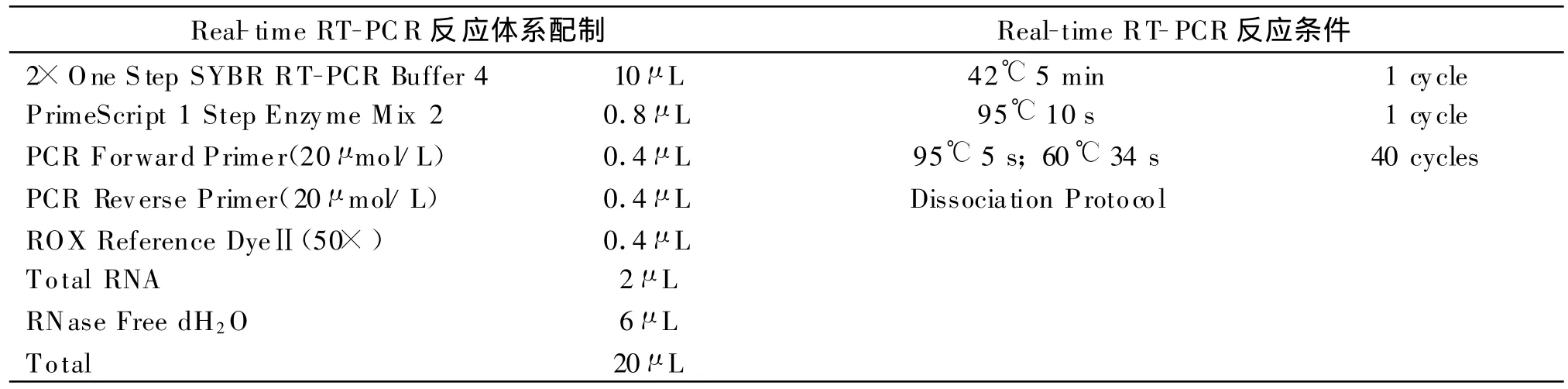
表2 荧光PCR反应体系及反应条件Table 2 Real-time PCR reaction mixture and amplification parameters

图1 阳性样品及阴性对照的融解曲线A-I:分别代表引物1-9Fig.1 Dissociation plots of amplification products for positive samples and negative controlA-I:refers to primer pair 1-9 respectively
2.2 血清和凝血块样品的检测 选取2010年送检的临床疑似乙脑患者凝血块样品,包括乙脑IgM抗体阳性和IgM阴性各15份,同时选择这些凝血块对应的血清样品,提取病毒DNA/RNA。按照新建立的反应体系及相同条件,分别检测这部分血清和凝血块中JEV RNA。结果显示,凝血块样品中,有7份在82.4℃附近出现明显扩增产物,与非特征扩增产物明显不同,因此判为阳性,见图2A。其中包括IgM阳性样品5例,IgM阴性样品2例,见表3。而所有血清样品均为阴性(在特征82.4℃解链温度处无扩增产物),见图2B。

图2 部分样品及阳性对照的融解曲线A:凝血块;B:血清Fig.2 Dissociation plots of amplification products for 7 selected samples and positive controlA:blood clots;B:sera

表3 荧光PCR检测血清和凝血块样品中病毒RNATable 3 Summary of real-time PCR results for viral RNA in sera and blood clots
3 讨 论
目前JEV感染的实验室诊断仍然以ELISA方法检测患者血清中病毒特异性IgM抗体为主,病毒RNA的检测是血清学方法的补充手段[1]。开展病毒RNA检测,一方面可以对处于病毒血症期而IgM抗体阴性的患者进行确诊,避免出现漏诊;另一方面,病毒RNA阳性,意味着患者处于病毒血症期,可以指导临床实验室有针对性地进行病毒分离,有利于监控JEV野毒株在环境中的进化和变异[1]。由于乙脑病毒的传播主要通过猪、水禽、蚊之间的自然循环,只有猪和水禽产生的病毒血症才足以感染蚊子,因而是JEV维持、扩增及传播的重要宿主。虽然人、马感染JEV可以导致致死性脑炎,由于病毒血症期病毒载量低、持续时间短,对JEV的传播扩散贡献不大,只被认为是病毒的终末宿主[1]。如何从低病毒载量临床样品中快速检出JEV RNA,一直是各级临床实验室努力发展的方向。
鉴于JEV在患者样品中病毒载量较低,必须建立高度敏感的核酸检测方法。文献报道各种核酸检测方法中,检测限在0.1~64pfu之间[2-7],尤其以实时荧光PCR敏感、快速。其中TaqMan探针的实时荧光PCR方法,尽管灵敏度高、特异性强,由于试剂昂贵,其大规模推广应用受到限制。而以 SYBR Green I染料为主的实时荧光PCR方法,尽管由于非特异性扩增的干扰,在方法的特异性上可能稍逊,其敏感性与TaqMan方法相差无几,试剂成本则大大降低,因此受到基层实验室的青睐,更加适合于大规模监测和调查。我们在建立自己实验室的SYBR Green I实时荧光PCR体系过程中发现,一些文献所报道的体系,主要针对标准参比毒株或分离培养物,无法满足低病毒载量临床样品的检测。因此,我们对文献报道及自行设计的9对引物进行了检测效果评价。
有别于传统PCR引物设计,实时荧光PCR引物还有一些特别的要求。Applied Biosystems公司的Primer Express3.0软件中主要遵循以下原则:扩增产物长度50~150bp;最适引物长度为20寡核苷酸;G+C%在30%~80%之间;解链温度Tm在58℃~60℃,最佳Tm为59℃,并且2个引物之间Tm应该比较接近;3'末端最后5个核苷酸不能有2个以上G+C残基;尤其要避免相同的核苷酸重复,更不能有连续4个G残基。按照这样的原则,我们发现文献中出现的引物T m在51.3℃~68.6℃,同一对引物之间相差最大的达到7℃;并且10个引物中有3个引物的最后5个核苷酸有2个以上G+C,甚至还出现连续的4个G残基;部分扩增产物长度也超过150bp(表1)。这可能就是这批引物检测效果欠佳的原因。而重新设计的4对引物,T m值在58.55℃~61.98℃之间,同一对引物之间Tm相差在1℃以内,也避免了那些容易导致“表现不佳的结构”。因此,新引物均能得到较低的检测限(50pfu/mL,见表1),检测效果明显优于文献中的引物。
检测病毒DNA或 RNA通常采用全血、血浆、血清、脑脊液、唾液、尿液等材料,对于来自同一个患者,不同来源的材料得到的病毒载量结果是否存在差异,类似的报道不多见,利用血清分离后剩下的凝血块作为检材的报道更加少见[9-15]。我们首次采用实时荧光PCR检测凝血块的病毒DNA/RNA提取物中JEV RNA,发现凝血块样品较血清样品敏感,可能基于以下因素。1)病毒载量在不同检材中的分布存在不均一。以人免疫缺陷病毒(HIV)为例,Lee等人检测同一患者的新鲜血液、外周单核细胞(PBMCs)、血浆、血小板、红细胞等血液成分中 HIV DNA及感染性病毒,发现血小板中存在大量HIV,称之为血小板相关HIV-1,并伴随HIV感染的各个阶段[11]。另外Bruisten等人检测全血、血浆、PBMCs和血小板中HIV,几乎所有PBMCs均为阳性,其余样品检出率低于PBMCs[12]。类似结果同样在丙型肝炎病毒(HCV)RNA检测中得到验证。Schmidt等人通过改进RNA提取方法,发现部分患者血浆HCV RNA阴性,而全血样品为阳性[13]。2)一些病毒本身可以感染并长时间存在于PBMCs中。例如HCV、乙型肝炎病毒(HBV)除了具有肝细胞嗜性外,还可以感染其它细胞如PBMCs[14]。而另一方面,血浆或血清中的部分HCV RNA,可能随着免疫复合物沉淀及冷球蛋白凝集,导致出现假阴性;而采用全血样品,可以同时提取细胞内和血浆中RNA,可能有助于低病毒载量患者的诊断[15]。对于JEV,病毒感染初期JEV能够在单核细胞和巨噬细胞中有效复制并存活较长时间,可能充当JEV进入中枢神经系统的载体[2,12]。Sapkal等人尝试用12名乙脑患者(9例IgM阳性,3例阴性)凝血块中的白细胞分离JEV,通过与植物血凝素P刺激过的PBMCs共同培养,成功分离到 2株 JEV。同时以这12名患者脑脊液样品接种小鼠,却未分离到病毒[8]。3)样品处理过程中的浓缩效应。常用的从患者血清、血浆中提取病毒DNA/RNA的方法,一般需要的样品量在 200μ L以下,相当于500μ L左右全血。我们选择的红细胞裂解液浸泡加上机械研磨、离心的处理程序,可以一次处理3mL以上全血的凝血块,因此也能够提升检测灵敏度。另外,从血清或血浆中提取的DNA/RNA样品,往往缺乏合适的内对照,无法对样品处理及PCR过程进行有效质控。而凝血块样品中提取的DNA/RNA,由于存在大量人类细胞成分,很容易利用一些人类管家基因,实现对实验过程的质量控制。
我们建立的SYBR Green I实时荧光RT-PCR检测JEV RNA方法,尽管其敏感度稍逊于敏感度最高的套式PCR方法,仍然从30例确诊或疑似乙脑患者凝血块中检出7例阳性,而血清样品无一例阳性。该方法快速、简便、灵敏,尤其避免了套式PCR中经常出现的污染。目前病毒性脑炎相关的病原体核酸检测,因为病毒载量不高,一些病原体的检测不得不采用繁琐的套式PCR来提高检出阳性率。以上结果和分析表明,利用凝血块样品提取病毒DNA/RNA,对病毒性脑炎的实验室诊断具有重要价值。
[1]Gubler DJ,Kuno G,Markoff L.Flaviviruses[M]//Knipe D M,Howley P M,Griffin DE,et al.Fields virology,5th ed.Lippincott Williams&Wilkins Publishers,Philadelphia,Pa.2007.
[2]刘卫滨,付士红,宋宏,等.乙型脑炎病毒T aqMan PCR检测方法的建立及初步应用[J].中华微生物学和免疫学杂志,2005,25(8):656-662.
[3]黄福新,高世同,张仁利,等.乙型脑炎病毒TaqMan逆转录聚合酶链反应检测方法的建立[J].中国热带医学,2008,8(9):1481-1482.
[4]Santhosh SR,Parida MM,Dash PK,et al.Development and evaluation of SYBR Green I-based one-step real-time RT-PCR assay for detection and quantitation of Japanese encephalitis virus[J].J Virol Methods,2007,143(1):73-80.
[5]Chao DY,Davis BS,Chang J.Development of Multiplex Real-Time Reverse Transcriptase PCR A ssay s for Detecting Eight Medically Important Flaviviruses in Mosquitoes[J].J Clin Microbiol,2007,45:584-589.
[6]阳帆,刘建军,何建凡,等.TaqMan PCR检测乙型脑炎病毒方法的建立及应用[J].中国卫生检验杂志,2008,18(10):1962-1964.
[7]张拥军,谢剑锋,王金章,等.三种核酸扩增方法检测临床乙脑标本的比较[J].中国人兽共患病学报,2009,25(5):406-409.
[8]Sapkal GN,Wairagkar NS,Ayachit VM,et al.Detection and isolation of Japanese encephalitis virus from blood clots collected during the acute phase of infection[J].Am J T rop Med Hyg,2007,77(6):1139-45.
[9]Hjelle B,Spiropoulou CF,Torrez-M artinez N,et al.Detection of Muerto Canyon virus RNA in peripheral blood mononuclear cells from patients with hantavirus pulmonary syndrome[J].J Infect Dis,1994,170(4):1013-7.
[10]McCulloch E,Ramage G,Jones B,et al.Don't throw y our blood clots away:use of blood clot may improve sensitivity of PCR diagnosis in invasive aspergillosis[J].J Clin Pathol,2009,62(6):539-41.
[11]Lee T H,Stromberg RR,Heitman JW,et al.Distribution of HIV type 1(HIV-1)in blood components:detection and significance of high levels of HIV-1 associated with platelets[J].Transfusion,1998,38(6):580-8.
[12]Bruisten S,van Gemen B,Koppelman M,et al.Detection of HIV-1 distribution in different blood fractions by two nucleic acid amplification assays[J].AIDS Res Hum Retroviruses,1993,9(3):259-65.
[13]Schmidt WN,Klinzman D,LaBrecque DR,et al.Direct detection of hepatitis C virus(HCV)RNA from whole blood,and comparison with HCV RNA in plasma and peripheral blood mononuclear cells[J].J Med Virol,1995,47(2):153-60.
[14]Mazurek U,Wilczok T,Mazur W,et al.Distribution of hepatitis C virus RNA in whole blood of patients with HCV infection and HBV-HCV coinfection[J].Med Sci Monit,2002,8(2):CR 125-30.
[15]Daniel HD,David J,Grant PR,et al.Whole blood as an alternative to plasma for detection of hepatitis C virus RNA[J].J Clin Microbiol,2008,46(11):3791-4.
