朱黄青霉α-1,6-葡聚糖酶在毕赤酵母中的分泌表达
2011-11-06庄灵习陈龙军凌雪萍卢英华
庄灵习,段 然,陈龙军,凌雪萍,卢英华,*
(1.厦门大学化学化工学院,福建厦门361005; 2.广州甘蔗糖业研究所,广东广州510316)
朱黄青霉α-1,6-葡聚糖酶在毕赤酵母中的分泌表达
庄灵习1,段 然1,陈龙军2,凌雪萍1,卢英华1,*
(1.厦门大学化学化工学院,福建厦门361005; 2.广州甘蔗糖业研究所,广东广州510316)
α-1,6-葡聚糖酶是专一作用于α-1,6糖苷键产生小分子葡聚糖的一类水解酶,广泛的运用于制糖工业和啤酒工业中。采用PCR法扩增朱黄青霉(Penicillium minioluteum)C12114的α-1,6-葡聚糖酶基因,将其插入毕赤酵母表达载体pPIC9K。经Sac I酶线性化电击转入毕赤酵母基因组,构建重组酵母GS115/pPIC9K-dex。对构建成功的转化子进行1.5%的甲醇诱导表达,在30℃条件下培养7d时酶活达到最大值,为88.35U/mL。
α-1,6-葡聚糖酶,朱黄青霉,毕赤酵母,诱导
1 材料与方法
1.1 实验材料
朱黄青霉C12114和大肠杆菌E.coli DH5α 由本实验室保存;毕赤酵母表达载体pPIC9K和毕赤酵母菌株GS115 Invitrogen公司;胶回收试剂盒、酵母基因组提取试剂盒 深圳尚能生物科技有限公司;限制性内切酶、pMD18-T载体系统和T4 DNA连接酶 日本TaKaRa公司;DNA相对分子质量标准、Taq DNA聚合酶 大连宝生物工程公司;质粒提取试剂盒、无氨基酸的硫酸铵酵母氮源培养基、抗生素G418、蛋白分子标准 上海生工生物工程技术服务有限公司;测序及引物合成 由上海生工生物工程技术服务有限公司完成;其他生化试剂 国产分析纯;朱黄青霉斜面培养基PDA(g/L) 酵母膏5,葡萄糖10,琼脂20,自然pH;朱黄青霉菌丝体液体培养基(g/L) 玉米浆20,蔗糖20,酵母膏5,CaCO35,pH 5.8;LB培养基用于大肠杆菌DH5α培养,YPD、MD培养基用于重组毕赤酵母的筛选,BMG和BMM培养基用于重组毕赤酵母的培养表达,具体配方见Invitrogen公司的毕赤酵母操作手册[8];引物 使用引物序列如表1所示,其中 F1、F2为朱黄青霉C12114中α-1,6-葡聚糖酶基因的上下游引物,在上游引物F1的5’端引入EcoR I酶切位点,下游引物F2的5’端引入Not I酶切位点(表中划线部分)。

表1 实验相关引物
1.2 实验方法
1.2.1 朱黄青霉的菌体培养、DNA的提取及dex基因的获得 将PDA斜面培养基(30℃恒温培养)上的朱黄青霉C12114接种至菌丝体液体培养基中,30℃,150r/min摇床培养约3~4d。离心收集菌丝,无菌水冲洗,液氮速冻,研磨后参照吴发红等[9]使用SDS法提取朱黄青霉的总DNA。
以获得的总DNA为模板,PCR扩增dex基因。反应体系含4μL 25mmol/LMgCl2、0.5μL 10mmol/L dNTP、0.5μL(2.5U)Taq DNA聚合酶、各 0.5μL 10μmol/L的上下游引物(F1和F2)和总DNA模板0.5μL,扩增条件见表2。PCR产物经琼脂糖凝胶电泳后,回收预期大小的片段,与pMD-T载体连接,转化入大肠杆菌DH5α感受态细胞,涂布在含氨苄青霉素LB平板上,挑选阳性克隆,提质粒进行测序验证。
1.2.2 重组毕赤酵母表达载体的构建 将测序正确定义的α-1,6-葡聚糖酶基因用EcoR I和Not I双酶切,并与同样经过 EcoR I和 Not I双酶切的载体pPIC9K连接,连接产物转化感受态大肠杆菌DH5α,得到的转化子经氨苄抗性和卡那霉素选择筛选出阳性克隆。提取质粒进行测序验证,构建重组载体pPIC9K-dex,如图1所示。
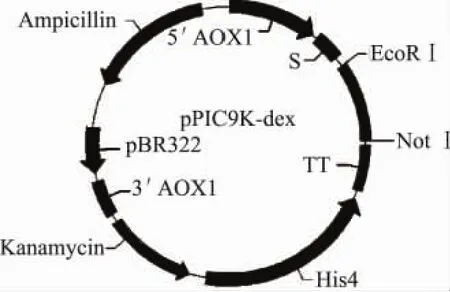
图1 重组质粒pPIC9K-dex
1.2.3 重组毕赤酵母的转化和筛选 将活化后的毕赤酵母 GS115菌株接种到30mL YPD培养基中,30℃、200r/min下培养过夜至 OD600为1.0~1.5。取5mL 4℃离心并收集菌体,用预冷的无菌水和1mol/L山梨醇分别洗涤菌体两次,将所得菌体悬浮于80μL预冷的1mol/L山梨醇溶液中。加入20μL经Sac I线性化的重组表达载体充分混匀,将上述混合液移至0.2cm电击杯中,冰浴5min,用电转化仪电击,条件为1500V,25μF。电击结束后向电击杯内加入1mL预冷的1mol/L山梨醇溶液,分别取200、300、500μL涂布于缺少组氨酸的MD平板,30℃条件下培养至转化子出现。以不含载体的GS115为阴性对照。
用灭菌牙签挑取转化子分别点种到含0.25、0.5、1.0、1.5、2g/L G418的YPD培养基平板上,30℃培养2d,在高浓度G418平板上生长的即为高拷贝转化子。获得的高拷贝转化子点种于筛选培养基MM和MD平板上,确定其甲醇利用表型,在MD和MM上均能正常生长的转化子为Mut+(methanol utilization plus)型,指可利用甲醇为唯一碳源的野生型菌株。将获得的高拷贝转化子点种于MM-蓝色葡聚糖T2000平板,出现透明水解圈则是表达成功的阳性转化子。
1.2.4 重组毕赤酵母菌株的诱导表达 将阳性转化子接种于含30mL BMG培养基的250mL摇瓶中,30℃、200r/min摇床培养24h。离心收集菌体,将菌体转移至30mL BMM诱导培养基中,30℃、200r/min继续培养168h,每24h补加适量甲醇至体积分数1%。每24h取样,10000r/min离心5min,收集上清液即为粗酶液。
1.2.5 SDS-PAGE检测表达产物 将粗酶液进行SDS-PAGE(分离胶12%,浓缩胶5%),粗酶液加入4×上样缓冲液,沸水浴5min后上样10μL进行电泳。电泳结束后采用银染法显色[10]。
1.2.6 重组毕赤酵母表达产物分析 采用DNS法[11]测定重组α-1,6-葡聚糖酶的活性。酶活定义在pH5.0,温度37℃下,将每分钟催化产生1μmol还原糖所需的酶量定义为一个酶活力单位(U)。
1.2.7 重组毕赤酵母摇瓶优化 以BMG培养基为生长培养基,BMM为诱导培养基,分别考察诱导温度和甲醇浓度对蛋白表达的影响。选择诱导温度分别为25、28、30、32℃进行优化;分别在诱导过程中添加0.5%、0.75%、1.0%、1.5%、2.0%体积分数的甲醇,测定重组α-1,6-葡聚糖酶的活性,选择合适的甲醇添加浓度。
2 结果与讨论
2.1 dex基因的获得
经菌丝体培养基培养朱黄青霉后,采用液氮-SDS法提取总DNA,结果如图2所示。图2中泳道1和2分别为未添加及添加液氮研磨的结果。在研磨过程中由于液氮对细胞内物质结构的保护作用,可以看出泳道2的条带比较亮,DNA提取效果较好。
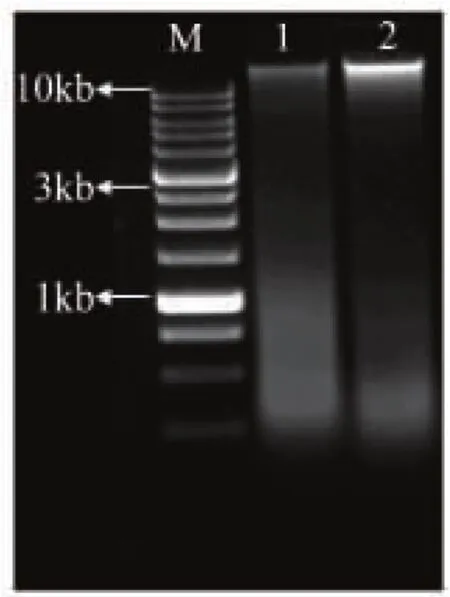
图2 朱黄青霉C12114的总DNA
提取的总DNA经温度梯度PCR扩增得到目的基因约为1800bp,结果如图3所示。经测序后,与朱黄青霉α-1,6-葡聚糖酶基因具有100%同源性,至此成功获得dex基因。将dex基因连入T载体,挑取含氨苄青霉素平板上的阳性转化子提取质粒,成功得到载体pMD18-T-dex(图略)。
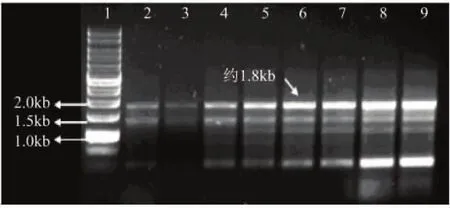
图3 α-1,6-葡聚糖酶基因扩增结果注:1-DNA ladder;2~9-不同退火温度40、42、44、46、48、50、52、54℃扩增片段。
2.2 重组载体pPIC9K-dex的构建
将重组体pMD18-T-dex和载体pPIC9K分别经EcoR I和Not I双酶切,回收相应片段、连接产物转化大肠杆菌DH5α,挑取转化子扩增并抽提质粒。将抽提的质粒经EcoR I和Not I双酶切,得到了1800bp左右和9000bp左右的条带(见图4),证实dex基因成功插入载体pPIC9K,将重组质粒命名为pPIC9K -dex。
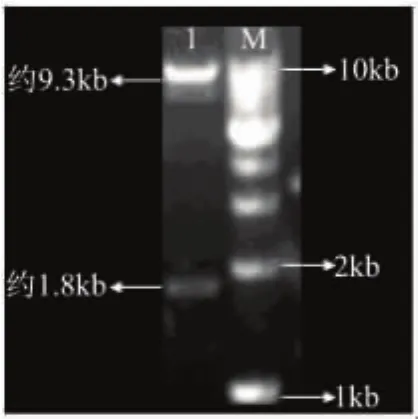
图4 双酶切验证重组质粒pPIC9K-dex注:M-DNA ladder;1-经EcoR I和Not I双酶切片段。
2.3 重组毕赤酵母GS115/pPIC9K-dex的构建与筛选
重组质粒用Sac I酶切线性化,电击转化毕赤酵母GS115,涂布于MD平板上筛选目的基因整合到宿主菌染色体上的转化子。考虑到基因拷贝数的增加一般可以提高基因产物的表达量,首先利用载体上的G418抗性基因筛选高基因拷贝的转化子。将MD平板上获得的转化子点种于含0.25、0.5、1、1.5和2g/L G418的 YPD平板上,30℃培养 3d后,筛选出抗1.5mg/mL G418的 5株菌,一般每抗 0.25mg/mL G418即为一个拷贝数,因此最终得到约6个拷贝数的重组毕赤酵母。从MD平板点种到MM上的转化子都能生长且菌落比MD平板上的小,故判断其甲醇利用表型为Mut+。
将筛选得到的阳性转化子点板于MM-蓝色葡聚糖T2000平板,结果见图5。在菌落周围可以明显见到透明水解圈,证明dex基因不仅已经整合进酵母基因组中,而且成功实现了在毕赤酵母中的活性表达。

图5 MM-蓝色葡聚糖T2000平板
2.4 SDS-PAGE电泳检测表达产物
挑取表达菌株接种于30mL BMG的培养基中,30℃振荡培养约24h,离心收集菌体,用含1%甲醇的BMM培养基重悬菌体,诱导表达。不同时间取样,发酵液上清溶于5×上样缓冲液,SDS-PAGE检验结果见图6。从图6中可见,在66ku附近有一相应条带,其与天然的朱黄青霉α-1,6-葡聚糖酶理论分子量相符(67ku),而阴性对照中没有相应条带。毕赤酵母对重组蛋白的糖基化作用可能是目的蛋白分子量稍大的原因。
2.5 温度和甲醇浓度对重组毕赤酵母表达的影响
以1%甲醇为碳源诱导重组毕赤酵母进行表达,α-1,6-葡聚糖酶活性随时间变化曲线如图7所示。图7中显示培养基中的α-1,6-葡聚糖酶活性在诱导120h时可达到42.51U/mL。
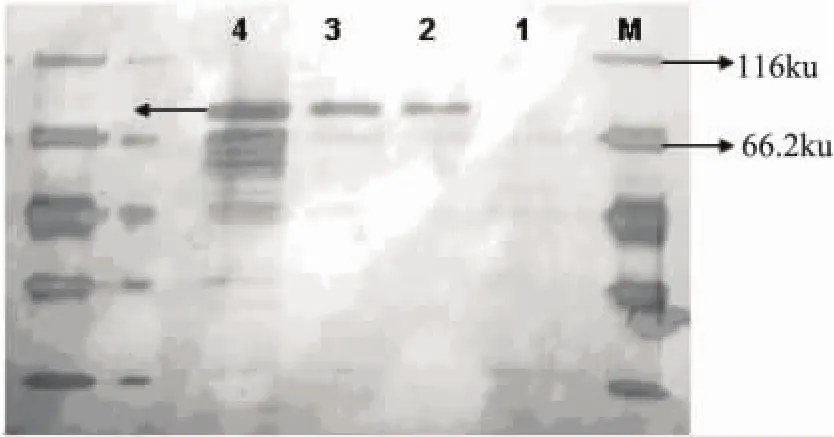
图6 重组酵母的表达产物SDS-PAGE电泳结果注:1-P.pastoris GS115的上清;2~4-经甲醇诱导24、72、120h的P.pastoris GS115/pPIC9K-dex上清。

图7 重组毕赤酵母在BMM培养基中的产酶曲线
温度是影响微生物生长和表达的最为关键的因素之一。温度升高,有利于微生物的生长代谢和蛋白表达,但温度过高也会使菌体过早衰老,发酵周期缩短,降低蛋白表达量和活性。因此,必须选择合适的温度,而且在不同阶段,应选择不同的温度。图8为诱导温度对重组毕赤酵母产酶的影响。28℃与30℃对产酶的影响不大,当温度为32℃时,目的蛋白的表达远远低于其他三个温度,与文献报道的毕赤酵母在超过32℃的情况下生长缓慢,衰退提前,已造成菌体过早死亡,表达低下[12]等相符。由于实验室摇床温度限制,故后续实验温度选择30℃。
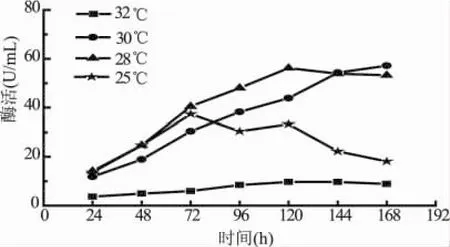
图8 诱导温度对表达外源α-1,6-葡聚糖酶的影响
培养基的组成特别是碳源直接影响菌体生长和诱导表达,故选择合适的碳源及浓度也对重组毕赤酵母表达十分重要。甲醇作为外源蛋白表达的诱导剂,也是诱导过程中的碳源。在甲醇连续添加的情况下,可能造成甲醇蓄积,对菌体产生毒害作用,添加量不足,又会造成碳源不足,影响菌体生长。通过优化甲醇添加浓度发现1.5%体积分数的甲醇添加量对α-1,6-葡聚糖酶的表达最为合适,在144h时酶活达到88.35U/mL,见图9。
3 结论

图9 甲醇浓度对表达外源α-1,6-葡聚糖酶的影响
α-1,6-葡聚糖酶在医疗、牙科及制糖工业中具有十分重要的应用[13],但目前国内外关于α-1,6-葡聚糖酶的研究相对于其他类型的葡聚糖酶类如β-1,3-葡聚糖酶等并不深入。本研究通过PCR技术从朱黄青霉C12114菌株中成功扩增出α-1,6-葡聚糖酶基因,通过基因重组在毕赤酵母中成功表达α-1,6-葡聚糖酶基因。此外,对利用毕赤酵母诱导培养基BMM对α-1,6-葡聚糖酶的表达的温度和甲醇诱导浓度进行简单的优化,结果表明:30℃,1.5%体积分数的甲醇添加量为α-1,6-葡聚糖酶最适表达条件,最高酶活可达到88.35U/mL。毕赤酵母作为高效表达外源蛋白的表达系统,可高密度发酵是其重要的优点,今后将结合摇瓶培养的优化结果指导重组毕赤酵母GS115/pPIC9K-dex的发酵罐培养,使α-1,6-葡聚糖酶能够高效表达。
[1]葡聚糖对制糖工业的影响及其测定方法[J].甘蔗糖业,1985(1):30-42.
[2]Eggleston G,Monge A.Optimization of sugarcane factory application of commercial dextranases[J].Process Biochemistry,2005,40:1881-1894.
[3]Khalikova E,Susi P,Korpela T.Microbial dextran-hydrolyzing enzymes:fundamentals and applications[J].Microbiol Mol Biol R,2005,69:306-325.
[4]Walker G J.Dextrans[J].Biochemistry of Carbohydrates II,1978,16:75-126.
[5]Raices M,Molerio M C,Li I M,et al.Purificacion parcial de una enzima dextranasa a partir de una cepa de hongo del genero Penicillium[J].Biotechnol,1991(8):248-255.
[6]Sue M P,Mariana L F,Brian,et al.Heterologous protein production using the Pichia pastoris expression system[J].Yeast,2005,22:249-270.
[7]李洪淼,王红宁,许钦坤.毕赤酵母高密度发酵研究进展[J].生物技术通讯,2005,16(2):210-212.
[8]陈苗,商汉桥.毕赤酵母表达操作手册[M].美国: Invitrogen公司,2002.
[9]吴发红,黄东益,周鑫,等.几种内生真菌DNA提取方法的比较[J].中国农学通报,2009,25(8):62-64.
[10]沃兴德.蛋白质电泳与分析[M].北京:军事医学科学出版社,2009.
[11]Ghose T K.Measurement of cellulase activities[J].Pure and App Chem,1987,59(2):257-268.
[12]林俊涵.毕赤酵母高密度发酵工艺的研究[J].中国生物工程杂志,2009,29(5):120-125.
[13]Lin Chen,Xiangshan Zhou,Weimin Fan,et al.Expression,purification and characterization of a recombinant Lipomyces starkey dextranase in Pichia pastoris[J].Protein Expression and Purification,2008,58:87-93.
Expression of α-1,6-dextranase from Penicillium minioluteum in P.pastoris
ZHUANG Ling-xi1,DUAN Ran1,CHEN Long-jun2,LING Xue-ping1,LU Ying-hua1,*
(1.College of Chemistry and Chemical Engineering,Xiamen University,Xiamen 361005,China; 2.Guangzhou Sugarcane Industry Research Institute,Guangzhou 510316,China)
α-1,6-dextranase,which can hydrolyze dextran specifically by cutting off the α-1,6-glycosidic bond to release shorter saccharides,was widely used in many fields such as sugar industry and beer industry.The gene of α-1,6-dextranase(dex)was amplified through PCR by using Penicillium minioluteum C12114 genomic DNA as template.The amplified gene was cloned into vector pPIC9K and the recombinant plasmid pPIC9K-dex was linearzed with Sac I,then transformed into P.pastoris GS115 by electroporation.The positive transformant was induced to express the enzyme with 1.5%methanol for 7 days under the 30℃,and the activity of the enzyme could reach 88.35U/mL.
α-1,6-dextranase;Penicillium minioluteum;P.pastoris;induction
TS201.3
A
1002-0306(2011)11-0194-04
α-1,6-葡聚糖(Dextran)是α-D-吡喃型葡萄糖的聚合物,主要通过α-1,6糖苷键连接,含有少量的α-1,2、α-1,3和α-1,4糖苷键。葡聚糖在医疗上可以代替血浆,控制药物释放;在牙科中,葡聚糖会与唾液中的糖蛋白形成牙菌斑;而在制糖工业中,肠系膜状白念珠菌(Leuoconostoc mesenteroides)利用蔗糖合成葡聚糖,造成糖分损失,使糖汁粘度增高导致过滤困难,蔗糖的结晶效率降低,糖的精炼质量下降等[1-2]。α-1,6-葡聚糖酶能够切断葡聚糖中的α-1,6-糖苷键,产生异麦芽糖或异麦芽三糖以及分子量较小的葡聚糖,使其失去亲水性和粘性,提高精糖的质量和制糖效率。真菌中的青霉菌、油脂酵母、黑曲霉以及细菌中的链球菌、芽孢杆菌都能产生α-1,6-葡聚糖酶[3]。真菌中的朱黄青霉(Penicillium minioluteum)产生的α-1,6-葡聚糖酶具有较高的热稳定性,适合运用于制糖工业中[4]。朱黄青霉来源的α-1,6-葡聚糖酶属于糖苷水解酶类的GH49类,分子大小为67ku,等电点为3.88,其最适反应pH为5.0[5]。由于青霉菌的生长较慢,产物的活性和产量较低,提取纯化不易,难以适合工业化生产。毕赤酵母(P.pastoris)表达系统是近年来发展起来的一种优秀的真核表达系统,不仅能够大量表达异源蛋白,而且也能对外源蛋白进行翻译后修饰如适度糖基化、正确折叠、形成二硫键等,从而保持异源蛋白的生物活性[6-7]。本实验将朱黄青霉C12114的α-1,6-葡聚糖酶基因导入毕赤酵母表达载体pPIC9K中构建重组菌,研究α-1,6-葡聚糖酶在毕赤酵母中的表达,以提高 α-1,6-葡聚糖酶的产量用于工业化生产。
2010-11-17 *通讯联系人
庄灵习(1986-),女,硕士,在读研究生,研究方向:微生物发酵。
广东省科技计划项目。
