活性绿 19修饰花生壳粉微球的制备及对溶菌酶的吸附
2011-10-09杨丽超孙小梅李步海
杨丽超,孙小梅,李步海
中南民族大学化学与材料科学学院分析化学国家民委重点实验室,武汉 430074
活性绿 19修饰花生壳粉微球的制备及对溶菌酶的吸附
杨丽超,孙小梅,李步海*
中南民族大学化学与材料科学学院分析化学国家民委重点实验室,武汉 430074
以天然产物花生壳粉作为基质,环氧氯丙烷为交联剂,活性绿 19(Reactive Green 19,简称 RG19)为修饰剂,制备了新型的生物吸附剂 RG19修饰花生壳粉微球,比较了 RG19修饰花生壳粉前后对溶菌酶的吸附性能,包括吸附溶液的 pH,溶菌酶的初始浓度,吸附时间,温度及 NaCl的浓度对吸附的影响。结果表明,用 25.0 mg RG19修饰花生壳粉微球处理溶菌酶溶液 10 mL,pH值 7.4,吸附时间 4 h的条件下,对溶菌酶的吸附量是 149.6 mg·g-1,其酶活力保持率为 96.4%,而未修饰的花生壳粉微球对溶菌酶的吸附量只有 23.6 mg·g-1,修饰后是修饰前的 6.3倍。在上述条件下从鸡蛋清中分离纯化溶菌酶,纯化倍数为 31.0,收得率为 64.2%。而且该吸附剂的复用性好。
花生壳粉;活性绿 19;修饰;吸附;溶菌酶
Abstract:A new bio-adsorbent from natural product peanut shellwas prepared with epichlorohydrin and Reactive Green 19(RG19)as crossliking and modification agents,respectively.The adsorption behavior of the modified product for lysozyme in the different conditions,including pH,initial concentration of lysozyme,contact time,temperature,and NaCl concentration,was investigated by comparison with unmodified one.The lysozyme adsorption capacity of RG19 modified peanut shellwas 149.6 mg·g-1,when 10 mL lysozyme solutionwas absorbedwith 25.0 mgmodified peanut shell atpH 7.4,and stirring for 4 h.However,the adsorption capacityof unmodified peanut shell justwas23.6 mg·g-1,and the former is 6.3 times of the latter.The seperation and purification of lysozyme from egg white were achieved.The lysozyme was purified 31.0-fold in a single step with a recovery 64.2%.In addition,the repeat usefulness of this new-style absorbent is better.
Key words:peanut shell;Reactive Green 19;modification;adsorption;lysozyme
我国花生产量约占世界总产量的 1/3,其加工过程中产生的花生壳每年约有 450万吨,大部分当作燃料或废渣弃去,造成资源的极大浪费,直接影响了花生的综合利用和经济价值。花生壳的主要成分是木素,纤维素和半纤维素,即含有大量的羟基,能与许多配基 (如三嗪环)发生反应。近年来,花生壳的开发利用已引起人们的重视,将其用于废水处理方面的研究已有报道[1-3]。
碱性蛋白溶菌酶 (1ysozyme)常被作为研究蛋白质的模型体,是一种能特异水解微生物细胞壁多糖类物质的酶,它能损坏细菌细胞壁使细菌死亡,而对无细胞壁的人体细胞不会产生不良影响,所以在临床上溶菌酶广泛用于某些炎症的治疗和清除坏死的组织等,除此在食品工业、医疗、生物学领域也有着广泛的应用。因此开发用天然产物作基质的吸附剂,分离纯化家禽蛋清中的动物溶菌酶具有十分重要的现实意义。溶菌酶广泛存在于自然界动物、植物及微生物中,但以卵清中含量为最高 (约 3%),而且蛋清来源广泛,因此多数商品溶菌酶是从蛋清中提取的,有关蛋清中提取溶菌酶的报道有很多[4-6]。
有用三嗪类染料修饰壳聚糖微球[7]和聚合物薄膜[8]分离纯化蛋白质的报道。本文选用新的基质——花生壳粉,用配基染料 RG19进行修饰制备了一种新的生物吸附剂,考察了此吸附剂对溶菌酶的吸附性能,并从鸡蛋清中提取了动物溶菌酶。
1 实验部分
1.1 仪器与试剂
LAMBDA B10 35紫外可见分光光度计 (美国珀金-埃尔默公司);拉曼光谱仪 (renishaw inVia Raman Microscope,UK);SHZ-03恒温水浴摇床 (上海堪鑫仪器设备有限公司);TGL-16G台式离心机 (上海安亭科学仪器厂);DF-101S集热式恒温加热磁力搅拌器 (上海东玺制冷仪器设备有限公司);手提式中药粉碎机 (青州天地中药设备厂);pHS-3C型精密酸度计 (上海虹益仪表有限公司)。
Reactive Green 19(美国 Sigma);溶菌酶 (Sigma公司);溶壁微球菌干粉 (Sigma公司);花生壳 (购于武汉市农贸市场,花生壳用粉碎机打碎过筛,选取100-120目的颗粒)。
1.2 RG19修饰花生壳粉的制备与表征
1.2.1 制备方法
称取花生壳粉 10.0 g置于 250 mL的烧瓶中,分别加入 1.25 mol·L-1的 NaOH溶液 80 mL和环氧氯丙烷 30 mL,于 40℃下搅拌反应 1 h,过滤,用蒸馏水洗至滤液呈中性,70℃下干燥至恒重,得到交联花生壳粉[9]。
称取交联花生壳粉 1.0 g置于 20 mL 0.5 mol·L-1的 NaCl溶液中溶胀 1 h。将 0.5 g RG19溶解在15 mL水中,在电动搅拌下转入上述 NaCl溶液中。加 Na2CO3调节 pH至 10.0,于 80℃下搅拌反应 4 h,抽滤,水洗至滤液无色,再用无水乙醇洗几次,60℃烘干至恒重 (约 1.1 g),置于干燥器备用。
1.2.2 制备条件的正交设计
设计三因素三水平 L9(33)的正交实验确定制备反应中各因素的影响。三因素三水平为:A:NaCl溶液 :0.5 mol·L-1,1.0 mol·L-1,2.0 mol·L-1;B:RG19用量:30,50,150 mg;C:反应时间:2,4,6 h。
1.2.3 红外和拉曼光谱
用 KBr压片,FTIR检测 400~4000 cm-1处各峰的变化,研究交联前后花生壳粉表面官能团的变化。
用拉曼光谱仪测定和比较修饰 RG19前后的花生壳粉微球,选择氩离子激光器,激光波长 514 nm,透过率 50%检测。
1.3 吸附实验
分别称 25.0 mg RG19修饰或未修饰的花生壳粉微球置于 50 mL锥形瓶中,加 10 mL 0.2 mg·mL-1的溶菌酶溶液,放入摇床 (转速 120 r·min-1)吸附 4 h后离心,用分光光度法测定上清液在 280 nm处的吸光度,并用对照法计算溶菌酶的吸附率。
吸附率 =(吸附前溶菌酶的量-吸附后上清液中溶菌酶的量)/吸附前溶菌酶的量 ×100%
1.4 洗脱实验
吸附完毕,离心,弃上清液,加 10 mL洗脱剂溶液,将锥形瓶放入摇床 (转速 120 r·min-1)振荡洗脱,4 h后离心,用分光光度法测定上清液在 280 nm处的吸光度,计算洗脱率。
1.5 溶菌酶活力的测定
按文献[10]提供的方法。
1.6 从鸡蛋清中提取溶菌酶
取蛋清,用 0.05 mol·L-1的磷酸缓冲液稀释一倍,离心 (120000 r·min-1)15 min吸取上清液放入冰箱备用。
取 10 mL上述处理的蛋清放入 50 mL锥形瓶中,在选定的吸附条件下吸附饱和后,用 0.7 mol·L-1的NaCNS溶液解析。并分别测定蛋清液纯化前后在 280 nm处的吸光度,依 Brodford法[11]计算蛋清中的蛋白含量,代入酶的标准曲线计算溶菌酶含量。按 1.5节方法测定蛋清纯化前后的酶活力。
2 结果与讨论
2.1 微球制备的正交结果与评价
极差 R计算分析,R值越大的因素重要性越强,表 1可知:RG19用量的 R最大 (R=18.5)说明是关键因素,时间为一般因素,NaCl为次要因素。根据 T值的大小,NaCl的三个水平的 T值差异小,因此 NaCl浓度选 0.5 mol·L-1;反应时间 4 h时,T值最大;结果分析 RG19用量影响为主,因此,再用单因素实验确定 RG19用量是 500 mg。

表1 RG19修饰花生壳粉微球的正交表Table 1 Orthogonal experimental design of modified peanut shellwith RG19
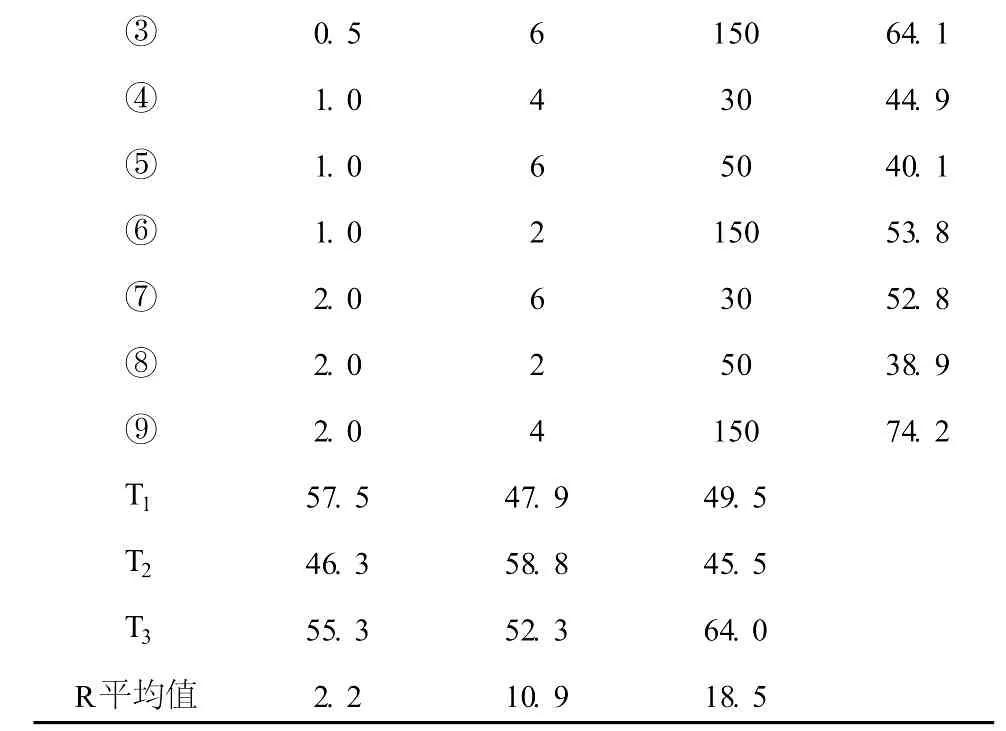
0.5 6 1 5 0 6 4.1④1.0 4 3 0 4 4.9⑤1.0 6 5 0 4 0.1⑥1.0 2 1 5 0 5 3.8⑦2.0 6 3 0 5 2.8⑧2.0 2 5 0 3 8.9⑨2.0 4 1 5 0 7 4.2 T1 5 7.5 4 7.9 4 9.5 T2 4 6.3 5 8.8 4 5.5 T3 5 5.3 5 2.3 6 4.0 R平均值 2.2 1 0.9 1 8.5③
2.2 红外和拉曼光谱分析
图1为交联前后花生壳粉的红外光谱。3360 cm-1为 O-H的伸缩振动吸收峰,交联后明显减弱,表明-OH参与交联反应;1740 cm-1为 C=O吸收峰,交联后消失,说明 C=O参加了反应;1380 cm-1为纤维素和半纤维素中 C-H的变形振动吸收峰,1270 cm-1为愈创木基芳香环上甲氧基和木质素中 C-O的振动吸收峰,1060 cm-1为纤维素和半纤维素中 C-O伸缩振动吸收峰,交联后这三个峰明显减弱,说明在交联过程中被脱除的混合物中含有芳香环和 C-O键。

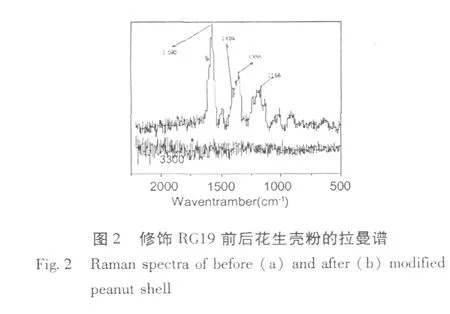
图2为修饰 RG19前后的花生壳粉微球的拉曼谱图。两者相比,修饰后出现的几处明显峰波:1580 cm-1为芳香类 C-C的伸缩振动;1409 cm-1为 N=N(芳香取代)的伸缩振动;1355 cm-1和 1166 cm-1分别为(-C)SO3的对称伸缩振动和反对称伸缩振动。与RG19的结构含 6个苯环,两个芳香取代的-N=N-基团,6个 (-C)SO3H基团相符。由此可见,RG19已修饰到花生壳粉微球上。
2.3 RG19修饰花生壳粉微球吸附溶菌酶的条件
2.3.1 溶液 pH
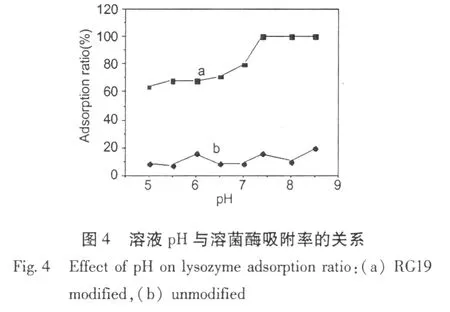
图4可见,pH从 5.0到 7.4,吸附率逐渐增加;7.4到 8.5时,溶菌酶完全吸附。这是基于两个因素影响溶菌酶的吸附:一、溶菌酶的等电点为 11.2,当 pH小于 11.2时,溶菌酶带正电荷;二、活性绿 19为阴离子染料,结构 (如图 3)包括六个磺酸基,一个伯氨基,四个仲氨基和几个疏水苯环。pH从 5.0到7.4,溶菌酶所带正电荷逐渐减少,而磺酸基的质子化逐渐减弱 (即与正电荷结合的能力逐渐增加),而此时后者对吸附的影响较大,所以随 pH增加对溶菌酶的吸附能力增加,吸附率提高。由此可知,pH在 7.4~8.5的范围内 RG19修饰的花生壳粉微球对溶菌酶的吸附效果都较好。而未修饰 RG19的花生壳粉微球在相同酸度下对溶菌酶的吸附量都很小。

图3 活性绿 19的结构Fig.3 Chemical struction of Reactive Green 19
2.3.2 吸附时间
选择不同的吸附时间,考察了修饰 RG19前后花生壳粉微球的吸附性能。结果发现,修饰后的微球开始时吸附速率较大,3 h时达到吸附饱和。这是因为吸附开始时,溶液中的溶菌酶浓度较高,而微球上的吸附位点很多,因此吸附速率较高,随着吸附的进行,溶液中溶菌酶浓度减小,微球上的位点也逐渐占满,导致吸附速率下降。而修饰前的微球由于对溶菌酶的吸附量很小,很短时间内就达到吸附饱和。
2.3.3 溶菌酶的浓度
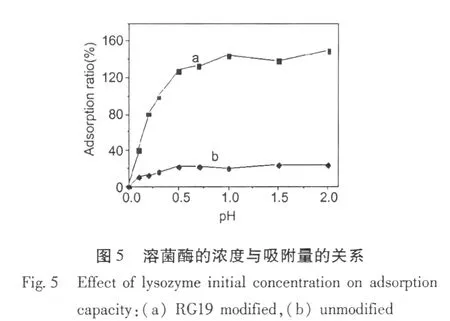
图5显示,溶菌酶浓度增大,吸附量也增大。当溶菌酶的浓度为 1.0 mg·mL-1时,达到最大吸附量149.6 mg·g-1,再加大溶菌酶浓度,吸附量不会增加。而未修饰 RG19的微球对溶菌酶的吸附量只有23.6 mg·g-1。这是因为染料 RG19与蛋白分子间存在特异性和非特异性作用,其中特异性亲和吸附是主要的,所以对溶菌酶的吸附量大;而未修饰RG19的微球对溶菌酶只是非特异性吸附,吸附量很小。证实修饰后的吸附剂性能优于修饰前。
2.3.4 吸附温度
当温度低于 15℃时吸附效果会明显下降。在实验温度范围内 (20~45℃)吸附剂对溶菌酶的吸附率不受温度的影响。
2.3.5 离子强度
离子强度对吸附行为有重要的影响。由图 6可见,随着离子强度的增加,溶菌酶的吸附率明显减小。当 NaC1的浓度从 0.0 mol·L-1增加到 0.5 mol·L-1时,修饰 RG19的微球对溶菌酶的吸附率由100%降至 2.13%。因为离子强度的增加使蛋白质分子处于更多的离子氛围中,与配体结合的空间阻碍和静电排斥作用增大;而且盐离子也会与配体分子的基团作用,阻碍配体与蛋白质的结合。当 NaC1的浓度为 0.2 mol·L-1时,未修饰 RG19的微球对溶菌酶无吸附。
2.4 溶菌酶的洗脱及吸附剂的复用性
研究了两种洗脱剂 NaCNS和 NaCl在不同浓度下的洗脱效果。图 7表示,两种洗脱剂都随盐浓度的增加,洗脱率加大;当盐浓度再升高时,洗脱率略下降。不同的是洗脱剂不同对溶菌酶的脱附效果不同,当 NaCNS浓度为 0.7 mol·L-1洗脱率达 97.4%;而 NaCl浓度为 1.0 mol·L-1时,洗脱率仅 71.6%。说明NaSCN比NaC1对溶菌酶的解吸作用更好。这种现象解释如下:一方面随着洗脱剂中盐浓度的增加,体系中离子强度也随之增加,使蛋白分子和染料配体间的静电相互作用减弱,而且,离子强度的增加,也会影响蛋白质分子的构象,使蛋白质的疏水作用减弱,从而促进了蛋白的脱附。此外,SCN-离子极易与蛋白分子结合,也促进了蛋白质的洗脱。此外,经三个吸附一洗脱周期后,吸附剂的吸附量仅减少了 1%,证明吸附剂的复用性能较好。


2.5 吸附过程溶菌酶活力的变化
为了考察吸附过程对溶菌酶活力的影响,对吸附前后的溶菌酶进行了活力测定,平行实验 3次。吸附前酶的比活力为 18667 U·mg-1,吸附后洗脱下的酶比活力为 17994 U·mg-1。酶的比活力保持率为96.4%。
2.6 从鸡蛋清中分离纯化溶菌酶
为了考察该吸附剂提取溶菌酶的实用性,平行三次从鸡蛋清中提取分离溶菌酶,结果见表 2:提纯前鸡蛋清的比活力是 126 U·mg-1,提取的粗溶菌酶的比活力是 3900 U·mg-1,纯化倍数为 31.0,收得率为 64.2%。

表2 鸡蛋清中溶菌酶的分离纯化结果Table 2 Purification of lysozyme from eggwhile
3 结论
用 RG19修饰环氧氯丙烷交联的花生壳粉微球,制备的生物吸附剂可亲和吸附溶菌酶。因三嗪染料配基与蛋白质的特异性作用,使该生物吸附剂具有吸附平衡快,吸附容量大,酶活力保持率高,吸附剂复用性好的特点。从鸡蛋清中纯化溶菌酶,纯化效果明显。
1 ZhangQF(张庆芳),Zhu YB(朱宇斌),Li JP(李金平),et al.Compared experimenton heavymetal removal bymodified peanut shell and corncob.J Peanut Sci(花生学报),2009,38:6-10.
2 Huang K(黄宽 ),Qiu Z M(邱志明 ),Fan QC(樊庆春 ),et al.Study on preparation of an ion-exchange fibers from rice husk cellulose and its perfo rmance.Applied Chem Indus(应用化学),2008,37:41-44.
3 Shi YZ(石亚中),Wu YH(伍亚华).The utilization of peanut hull in biochemical engineering.J Peanut Sci(花生学报),2008,37:41-44.
4 Yu HF(余海芬),Ma MH(马美湖),Liu Y(刘岩).Study on the abstraction of lysozyme from egg white by cation-exchange chromatography.China Poultry(中国家禽),2008,30:22-25.
5 Liu H(刘慧 ),Wang FS(王凤山 ),Ghu J(楚杰 ).Study on some enzymologicalproperties and activity influencing factors of eggwhite lysozyme.Chin J B iochem Pha rm(中国生化药物杂志),2008,29:385-391.
6 Chen J(陈捷 ),Xue B(薛博 ),Bai Z(白姝 ).Novelmagnetic affinty supportpreparation and application in lysozyme adsorption.J Tianjin Univ(天津大学学报),2001,34:103-106.
7 Zhang J,Zhang ZP,Song Y,et al.Bovine serum albumin(BSA)adsorption with Cibacron blue F3GA attached chitosan microspheres.React Funct Polym,2006,4:640-644.
8 Meltem Y,Gulay BM,Yakup A.Separation and purification of lysozyme by reactive green 19 immobilised membrane affinity chromatography.Food Chem,2005,89:11-18.
9 Liu Y,Sun XM,LiBH.Adsorption of Hg2+and Cd2+by ethylenediamine modified peanutshells.Carbohydr Polym,2010,81:335-339.
10 Stellmach Bruno(施特尔马赫),Qian JY(钱嘉渊译).Best immungsMethoden Enzyme.Beijing:China Light Industry Press,1992.37.
11 BradfordMM.A rapid and sensitive method for the quantitation ofmicrogram quantities of proteins utilizing the principle of protein dye binding.AnalB iochem,1976,72:248-251.
Preparation of Reactive Green 19 Modified Peanut Shell and Adsorption Behavior for Lysozyme
YANGLi-chao,SUN Xiao-mei,L IBu-hai*
Key Laboratory of Analytical Chem istry of the State Ethnic Affairs Comission,South-central University forNationalities,W uhan 430074,China
O652.6;X712
A
1001-6880(2011)01-0030-05
2010-05-17 接受日期:2010-09-10
国家民委院校基金(MJY00004)
*通讯作者 E-mail:libh@scuec.edu.cn
